Контроль качества изнутри: как это устроено
Качество — одна из важнейших характеристик в фармацевтике, ведь терапевтические препараты непосредственно могут влиять на жизнь и здоровье людей. На первый взгляд может показаться, что контроль и обеспечение качества — это скучная бумажная волокита. Но на самом деле за этими процессами скрываются многоступенчатые поиски причин и следствий, увлекательные расследования и внезапные риски, на которые нужно быстро и четко реагировать. Обо всем этом расскажем с помощью карты-путеводителя по Направлению качества BIOCAD.
Что такое качество в фарминдустрии
Если обращаться к специализированным документам, качество определяется как степень соответствия совокупности присущих характеристик объекта требованиям. Расшифруем это описание: сначала мы задаем какие-то требования к продукту или процессу, а затем проверяем, насколько эти характеристики удовлетворяют требованиям — это и будет процесс обеспечения и контроля качества. Если применить это определение в отношении фарминдустрии, то при разработке лекарственного препарата сначала определяют его целевое назначение — способность лечить ту или иную болезнь у конкретных пациентов. А чтобы объективно оценить действие лекарственного препарата, используют характеристики, например подлинность, дозировку, чистоту. Все эти характеристики определяют качество лекарства, а значит, его эффективность и безопасность.
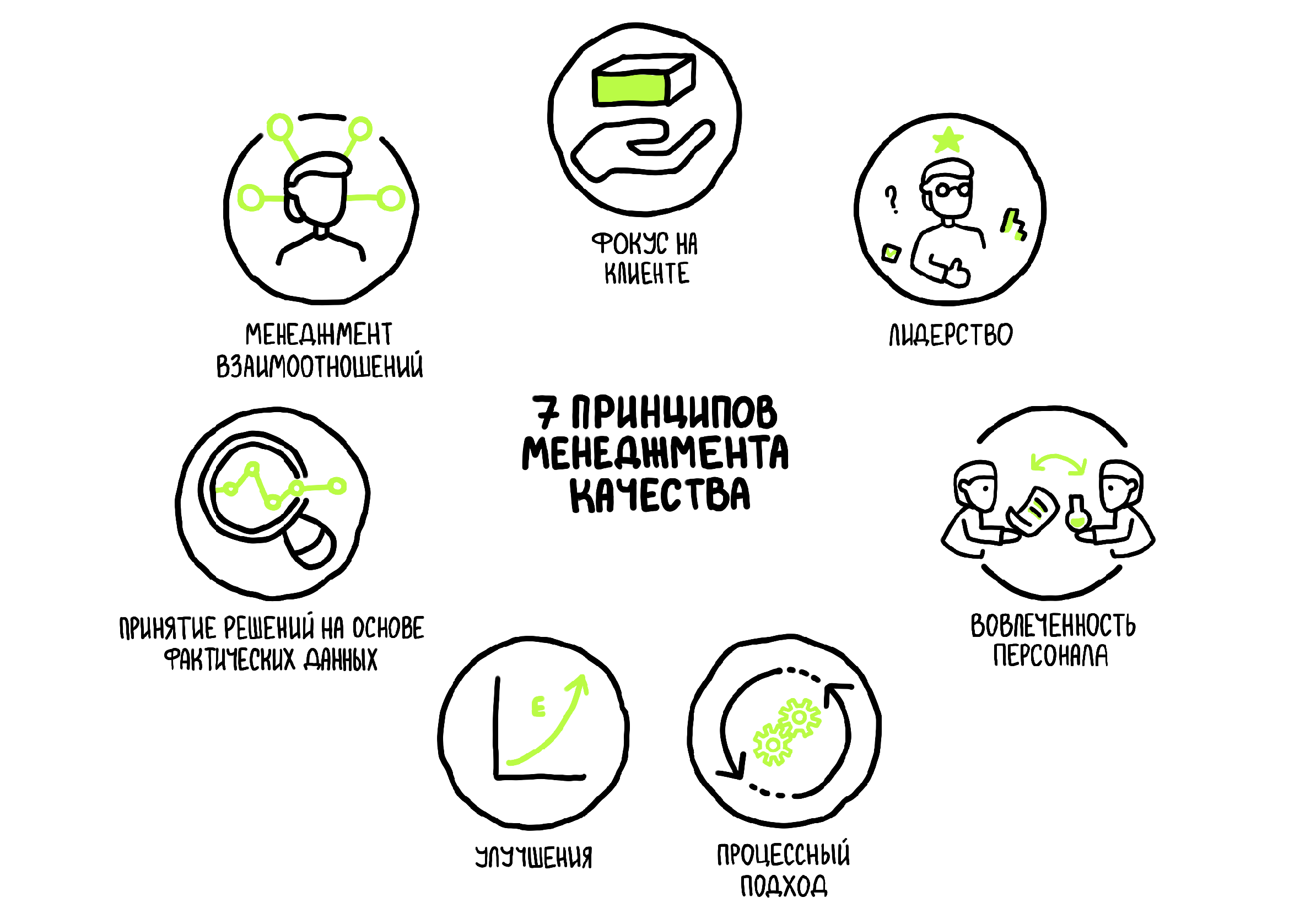
Процессы управления качеством определяются следующими принципами:
- Ориентация на клиента: главное в производстве лекарственных препаратов — улучшение жизни пациентов.
- Лидерство: каждый руководитель или владелец процесса на каждом из этапов производства лекарственных препаратов стремится обеспечить стандарты качества.
- Вовлеченность персонала: компетентные и заинтересованные сотрудники фармкомпании играют ключевую роль в повышении качества лекарственных препаратов.
- Процессный подход: хорошее понимание процесса производства лекарственных препаратов позволяет быстрее и эффективнее разрабатывать новые фармацевтические продукты.
- Улучшения: на любом уровне производства лекарственных препаратов можно непрерывно улучшать процессы и повышать их качество.
- Принятие решений на основе фактических данных: решения, основанные на анализе и оценке данных и информации, с большей вероятностью приведут к желаемым результатам.
- Менеджмент взаимоотношений: чтобы обеспечить долгосрочный успех, фармкомпания поддерживает отношения со всеми заинтересованными сторонами — поставщиками, заказчиками, инвесторами, государством.
Процесс разработки и производства лекарственных препаратов подчиняется строгому регулированию законодательными нормами. Одной из таких законодательных норм являются правила GMP — надлежащей производственной практики. Цель правил GMP — сделать так, чтобы производство и контроль качества лекарственных препаратов соответствовали целям их использования и выполнялись так, как описано в регистрационном досье или досье на клиническое исследование.
Дальше мы по шагам разберем все процессы обеспечения качества в фармацевтической компании, и в этом нам поможет карта:
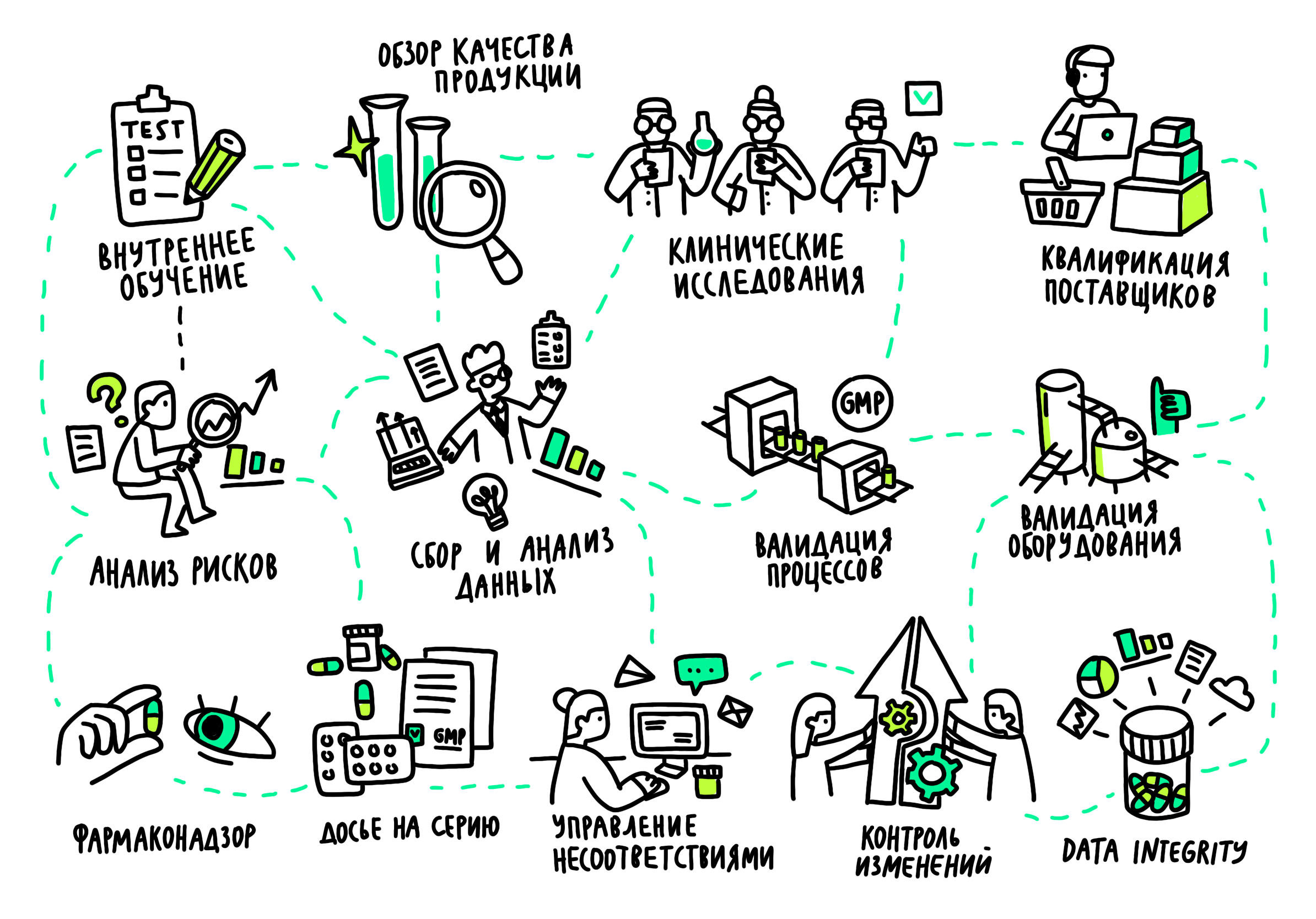
Внутреннее обучение
Первая остановка — класс для обучения сотрудников. Производство лекарственных препаратов — сложный и трудоемкий процесс, который требует постоянного совершенствования навыков и умений. В лабораториях и на промышленных линиях могут появляться новые приборы и оборудование, с которым нужно учиться работать. А уже отлаженные схемы и процессы работы могут совершенствоваться и меняться — и с ними тоже нужно познакомиться и обучиться новому подходу к работе.
Вот основные составляющие, которые входят в процесс внутреннего обучения:
- правила GxP, надлежащих практик, которые охватывают все этапы производства лекарственных препаратов — от лаборатории до производства и выхода на рынок;
- стандарты и процедуры, разработанные для выполнения конкретных рабочих процессов;
- правила работы на конкретном фармацевтическом предприятии;
- инструктажи по охране труда и безопасности.
Процесс внутреннего обучения непрерывен и не стоит на месте: с усовершенствованием процессов и изменением правил изменяются и процедуры работы, которым нужно научиться. Поэтому все сотрудники компании BIOCAD регулярно учатся чему-то новому.
Обзор качества продукции
Далее переходим на «линию улучшений» — и начинаем изучать этап качества продукции. Специалисты по качеству регулярно проводят оценку лекарственных препаратов, чтобы убедиться в стабильности процессов их производства и в том, что лекарственное сырье и готовые препараты соответствуют действующим спецификациям. Цель такого мониторинга — подтвердить надежность производственных процессов и, при необходимости, усовершенствовать уже сложившиеся практики.
Из названия может показаться, что обзор качества продукции ограничивается готовым лекарственным препаратом или сырьем, которое используется для его производства. Но, помимо непосредственно лекарственного средства, специалисты по качеству контролируют упаковочные материалы, которые непосредственно контактируют с лекарством, а также критические точки в процессе производства, включая мониторинг окружающей среды и состояние инженерных систем. Ведь даже самый качественно произведенный препарат должен безопасно храниться и транспортироваться на протяжении всего своего жизненного цикла.
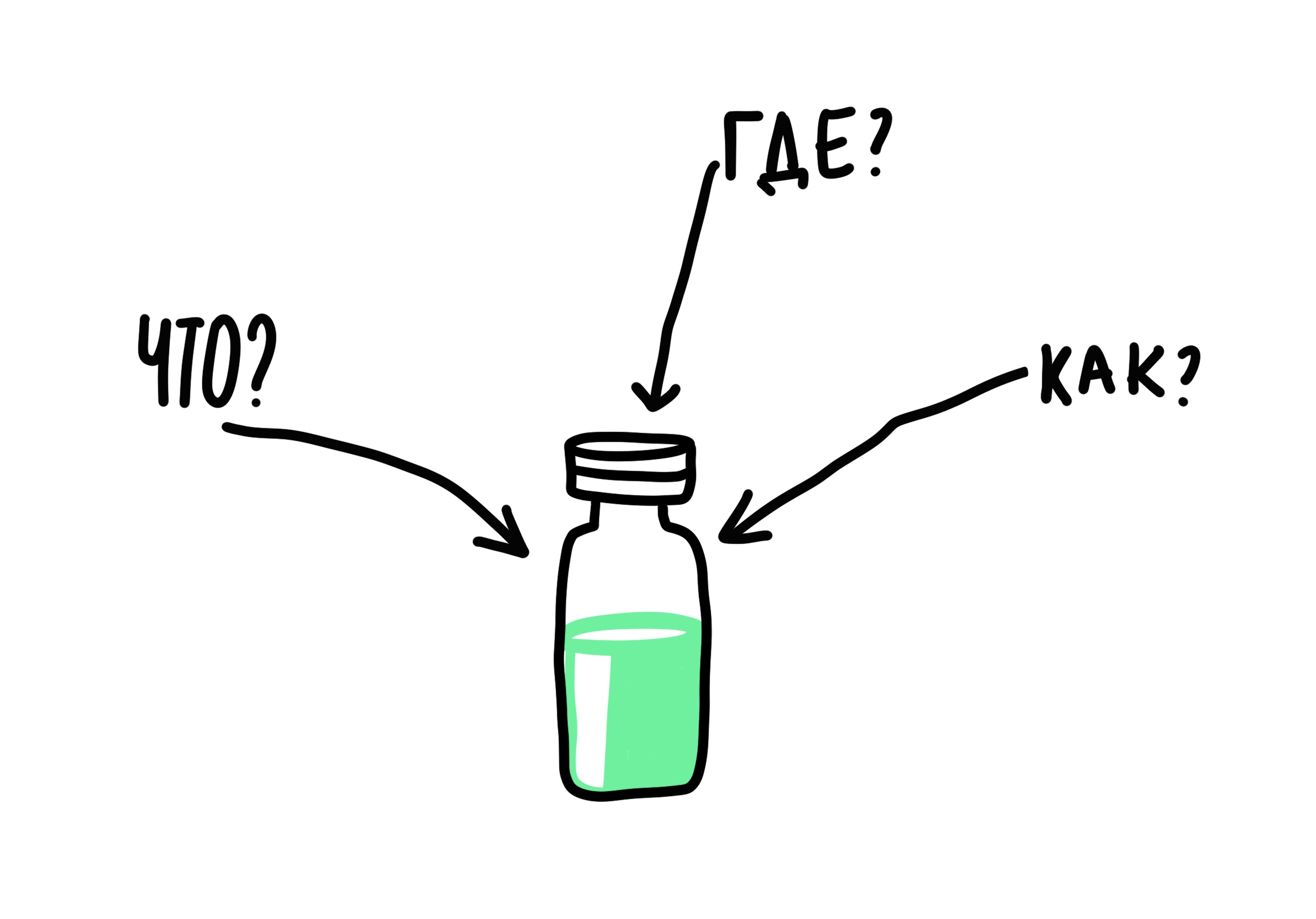
Если сильно упрощать, то обзор качества продукции отвечает на несколько вопросов: что мы производим и соответствует ли наш препарат спецификации? где и при каких условиях производят и хранят? как можно улучшить существующие процессы производства?
Порядок сбора и статистического анализа данных
Новая остановка, которая во многом дополняет этап обзора качества продукции, — это математическая лаборатория, где занимаются сбором и статистическим анализом данных. За сухими цифрами статистики и сложными на первый взгляд диаграммами скрываются секреты эффективного управления процессами. Чем больше данных о процессах производства лекарственных препаратов мы накопим, тем больший контроль над ситуацией получим — а значит, сможем эффективнее планировать результат и устранять возможные проблемы.
Так же как и в случае с обзором качества продукции, в процессе сбора и анализа статистики изучают информацию о лекарственных препаратах, оборудовании для их производства, инженерных системах и коммуникациях. А основной способ сбора этой информации — это обратная связь: именно с ее помощью получается контролировать числа и результаты «вживую», а не в абстрактном математическом вакууме.
Анализ рисков
Продолжая путешествие по процессам качества, задержимся на станции аналитики, где изучают и оценивают риски. Любой процесс неизбежно влечет за собой риски, и производство лекарственных препаратов не исключение. Но чем больше мы знаем о возможных рисках и способах их устранения или о минимизации последствий, тем качественнее будет результат.
Может показаться, что риски важно изучать при внедрении какого-то нового процесса, когда мы сталкиваемся с непредсказуемым результатом. Однако этим процесс анализа рисков не ограничивается — важно учитывать возможные риски при любом изменении и улучшении процесса. Эта оценка позволяет если не свести к минимуму все возможные негативные последствия в случае возможных изменений, то по меньшей мере обеспечить наиболее важные для качества лекарственного препарата характеристики, связанные с его безопасностью и эффективностью.
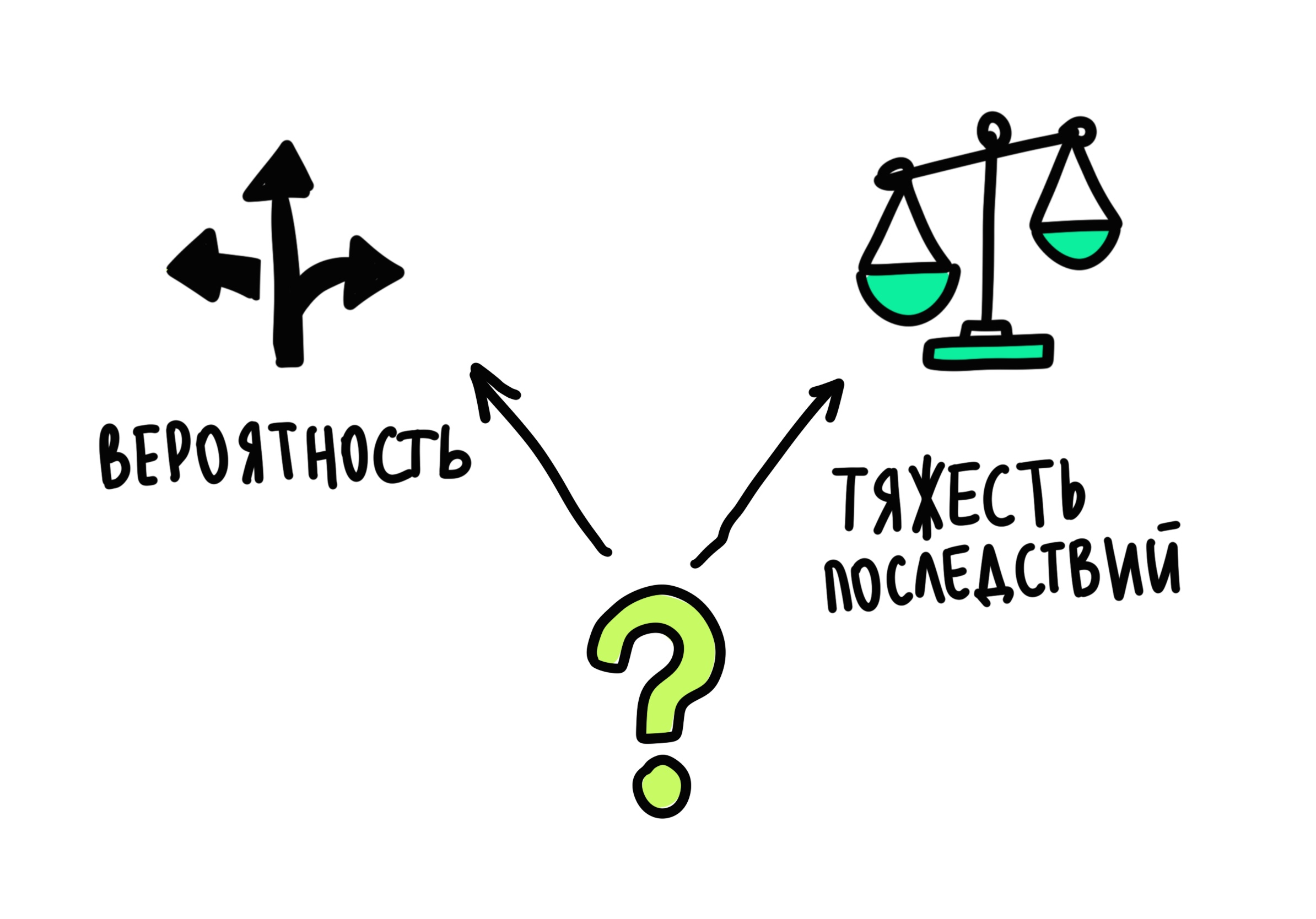
Любой риск — это сочетание вероятности возникновения неблагоприятных событий и тяжести их последствий.
Контроль изменений
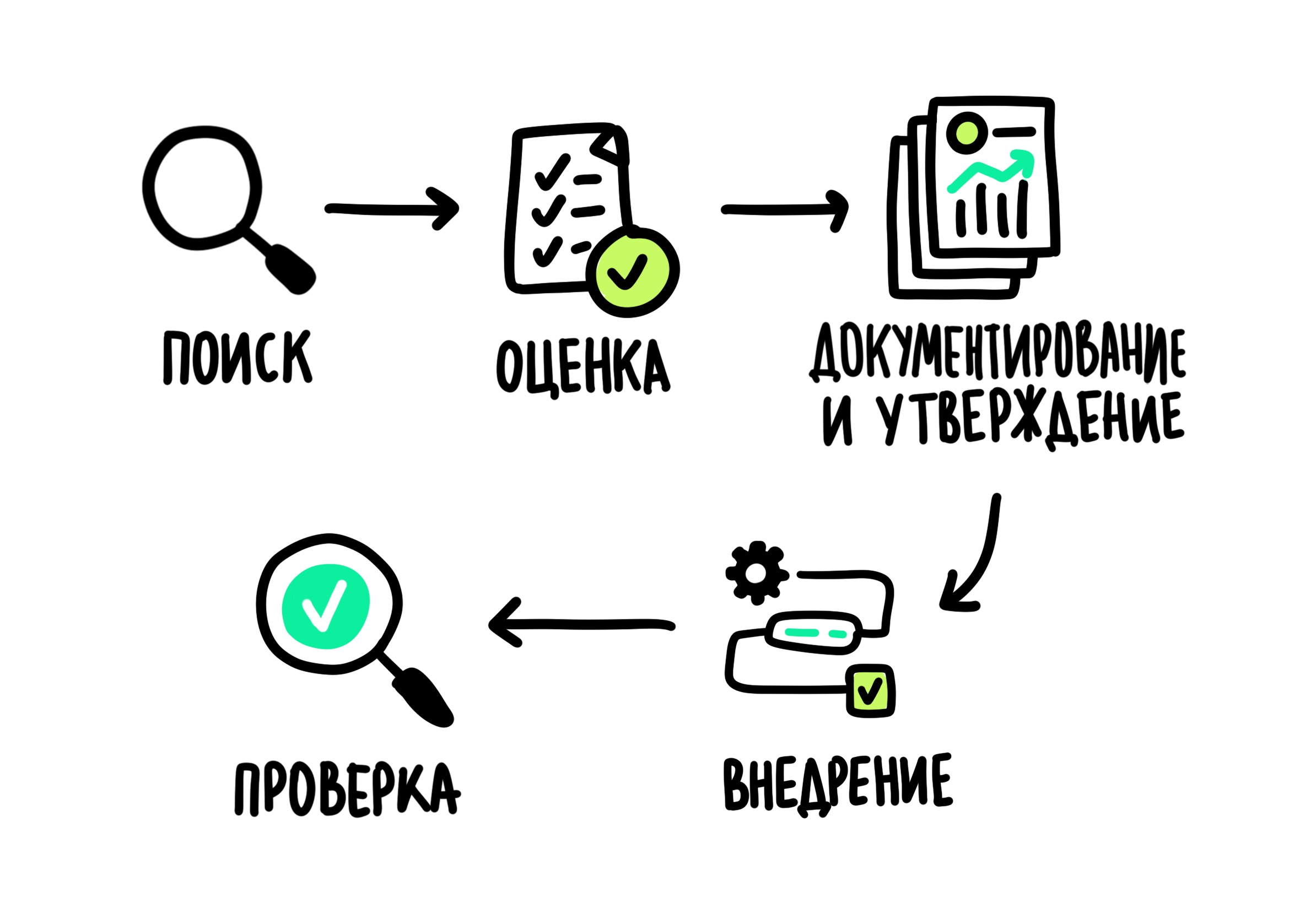
Следующая остановка на нашем пути — контрольная лаборатория, где оценивают изменения. Ни один технологичный процесс не стоит на месте, и производство лекарственных препаратов тоже не исключение. Для того чтобы быть уверенными в безопасности и эффективности изменений, специалисты по качеству разработали целую систему. Эта система включает в себя несколько этапов:
- Поиск изменений. Сначала изучаем возможность улучшения или модификации уже сложившейся практики. Эти изменения могут происходить на любом этапе жизненного цикла препарата — от замены оборудования в лаборатории до поиска новых поставщиков готовой продукции.
- Оценка. Эксперты по качеству и все сотрудники, участвующие во внедрении изменений, проводят предварительный анализ того, как это изменение повлияет на качество лекарства или внутренние процессы компании. Например, замена прибора потребует перестановки другого оборудования или обучения сотрудников для работы с новым прибором.
- Документирование и утверждение. При возникновении идеи о возможном изменении его регистрируют в электронной системе, где его подробно описывают и обосновывают необходимость такого изменения. Это помогает изучить суть изменения перед утверждением.
- Внедрение. Предпоследний этап работы с изменениями, в процессе которого разрабатывают план внедрения и реализацию на практике.
- Контроль эффективности. Просто внедрить изменение недостаточно — на первых порах за модернизированным процессом тщательно наблюдают, чтобы оценить, все ли в порядке, нет ли ухудшения качества смежных процессов.
Валидация
Очередная остановка на производственной линии — этап валидации. Если обращаться к определению GMP, валидация — это систематический процесс, цель которого — убедиться в том, что производственные процессы и системы работают должным образом. Перефразируя более простыми словами, валидация — это доказательство того, что все процессы жизненного цикла препарата — от разработки и производства до контроля качества и упаковки — приводят к желаемому результату. Например, оборудование функционирует именно так, как нужно, в требуемых диапазонах и с нужными параметрами настройки, а сотрудники, которые работают с этим оборудованием, обучены и квалифицированны для такой работы.
Процессы валидации производства малых и больших молекул различаются, ведь контролировать и обеспечивать качество биотехнологических процессов намного сложнее, чем качество лекарств, полученных путем химического синтеза. По сравнению с малыми молекулами, качество терапевтических белков гораздо сильнее зависит от процесса их получения, так как биопрепараты очень чувствительны к разным условиям производства. Так же как в природе не бывает двух абсолютно идентичных белков, так и в производстве очень сложно создать совершенно одинаковые биомолекулы. Это связано со структурными и функциональными особенностями сложных белковых молекул и большим разнообразием их модификаций.
В процессе валидации производства малых молекул и биотехнологических препаратов проверяют все условия, которые могут повлиять на качество финального продукта. В их числе — проверка состояния помещений и оборудования, а также соблюдение всех этапов процесса производства лекарственного средства в соответствии с требованиями GMP. Это критически важный процесс производства, который обеспечивает безопасность и эффективность лекарственных препаратов. Благодаря тщательной проверке всех систем и процессов компания может быть уверена в том, что ее продукция соответствует самым высоким стандартам качества.
Квалификация оборудования
Отдельно задержимся на линии разработки и производства лекарств, где проверим работу приборов. Здесь специалисты по качеству проверяют необходимое оборудование: как оно работает, правильно ли оно установлено и смонтировано, корректно ли эксплуатируется. Для этого разработали процедуру квалификации, чтобы убедиться в качестве и надежности процесса.
Фактически квалификация оборудования — это часть процесса валидации, который связан с производственным контуром. Так, все оборудование фармпредприятия должно находиться внутри производственного помещения и быть корректно вписано в общий профиль производства.
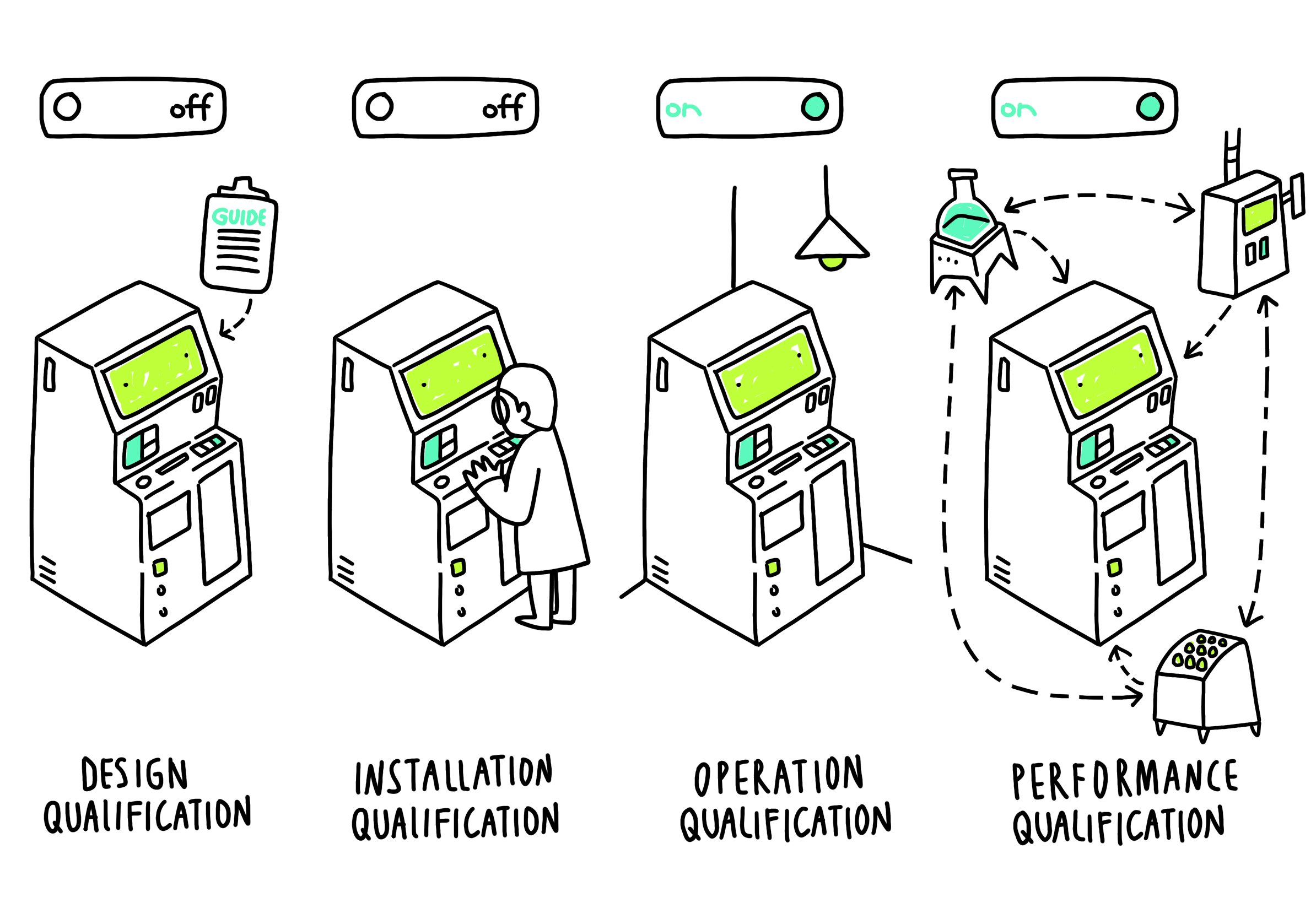
Квалификацию оборудования проводят в четыре этапа:
- Design Qualification — проверяем оборудование само по себе: правильно ли оно спроектировано и соответствует ли принятым стандартам.
- Installation Qualification — проверяем установку оборудования: все ли детали на месте и правильно ли они подключены.
- Operation Qualification — проверяем работу оборудования «вне контекста»: выполняет ли оно все предназначенные функции в соответствии с правилами эксплуатации.
- Performance Qualification — проверяем работу оборудования «в деле»: работает ли оно в реальных условиях в общей производственной системе.
Досье на серию
Следующая остановка — на упаковочной линии, когда мы уже произвели препарат и готовим его к дальнейшей поставке. Здесь определяющим будет понятие «серия препарата». Все фармкомпании производят различные лекарства в течение длительного времени. Это значит, что один и тот же препарат будут производить не одномоментно сразу на большой период времени, а порциями — сериями. Каждая серия препарата по-своему уникальна: на производственной линии в разные моменты времени могут работать разные люди, разные взаимозаменяемые марки приборов, и это происходит в разное время суток и в разные сезоны. Все эти различия могут добавлять особые характеристики серии лекарственного препарата.
Для того чтобы исключить возможные проблемы на любом этапе производства, специалисты по качеству формируют досье на каждую серию лекарственного препарата. Этот документ — основной источник данных для оценки процесса производства, контроля качества и соответствия препарата регуляторным требованиям. Благодаря досье на серию можно проверить, были ли соблюдены все стандарты и процедуры, а также удостовериться в том, что каждая серия лекарственного препарата прошла все необходимые испытания и получила положительную оценку.
Data Integrity
Новая остановка на нашем пути — архив с данными. Любая фармкомпания, которая соблюдает стандарты GxP, разрабатывает детальную документацию для каждого этапа разработки лекарственного препарата. Жизненный цикл всех этих данных можно описать принципом Data Integrity, или целостности данных. Data Integrity — это гарантия того, что все данные, используемые в производстве лекарств, являются точными, полными и надежными на всех этапах — от разработки до выпуска. В соответствии с принципами Data Integrity, информация не должна подвергаться изменениям или искажениям, а хранить ее следует в том же виде, в котором она была собрана.
Почему выполнение правил Data Integrity так критично для фармкомпаний?
Во-первых, это важно для обеспечения безопасности пациентов, ведь неверные данные могут привести к серьезным последствиям, которые могут повлиять на жизнь и здоровье людей. Если информация о составе препарата или его свойствах окажется неверной, это может вызывать побочные эффекты и даже привести к угрожающим жизни ситуациям.
Во-вторых, правила Data Integrity важны для соответствия требованиям. Так, фармацевтические компании обязаны строго следовать строгим регуляторным требованиям и стандартам. Неправильные или недостоверные данные могут приводить к штрафам, отзыву продукции и даже к уголовной ответственности.
В-третьих, соблюдение правил Data Integrity вызывает доверие к продукции. Потребители и медицинские работники должны быть уверены в безопасности и эффективности выпускаемых компанией препаратов. Именно надежные данные формируют доверие к компании и ее продуктам.
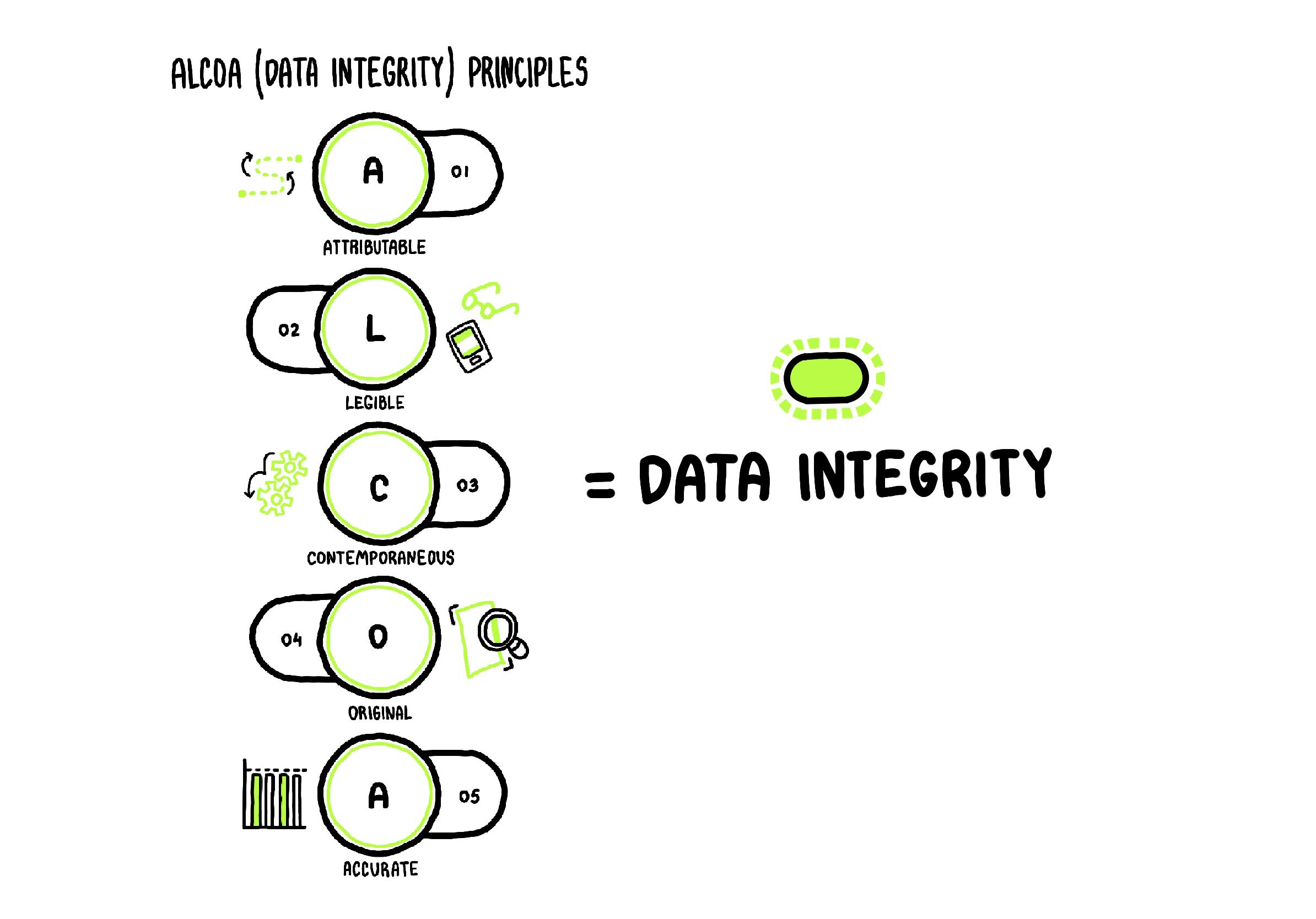
Соблюдение правил целостности данных можно описать с помощью аббревиатуры ALCOA, где каждая буква обозначает конкретный подход:
Attributable — прослеживаемость данных: в любой момент можно идентифицировать автора записи и всех, кто редактировал данные.
Legible — легкая считываемость: вся информация хранится в цифровом виде и остается доступной на протяжении всего срока жизни данных.
Contemporaneous — своевременность: занесение новых данных должно совпадать с началом выполнения задачи.
Original — обеспечение подлинности данных: например, приказы и распоряжения визируются электронными подписями.
Accurate — точность: информация должна быть полной и корректной.
Клинические исследования
Из производственных помещений мы перемещаемся в офис, где сидят эксперты по качеству проведения клинических исследований препарата. Кратко напомним, что клинические исследования — это самый масштабный и ресурсозатратный этап всего жизненного цикла разработки. Для того чтобы исключить возможные несоответствия при проверке лекарственных препаратов среди здоровых добровольцев и пациентов, разработали правила надлежащей клинической практики — GCP (Good Clinical Practice). Эти правила охватывают все возможные аспекты проведения клинических исследований.
Но, несмотря на свою монументальность, GCP — это все же верхнеуровневые правила, а для разработки плана клинических исследований (КИ) необходимо каждый раз разрабатывать уникальную схему: кто будет целевой аудиторией, по какой схеме вводить препарат, сколько участников войдут в КИ. Чтобы контролировать этот многопотоковый процесс, нужны эксперты по качеству проведения КИ. Среди задач, которые решают специалисты по качеству, — обучение и инструктирование сотрудников (например, врачей, которые будут взаимодействовать с пациентами), разработка и внедрение процедур для проведения КИ, мониторинг и аудит.
Фармаконадзор
Следующая остановка — пространство фармаконадзора, куда стекается вся важная информация о безопасности препарата в ходе клинических исследований и вся информация по безопасности и эффективности препарата после его выхода на рынок. Эффективность и безопасность препаратов необходимо контролировать постоянно и очень тщательно. Вот лишь некоторые задачи, которыми занимаются эксперты по фармаконадзору:
- собирают и оценивают информацию о возможных нежелательных реакциях на препараты и о других проблемах, связанных с их применением;
- аккумулируют и оценивают данные о нежелательных реакциях, которые могли быть связаны с нарушением рекомендаций по применению;
- выявляют возможные проблемы с безопасностью и эффективностью препаратов;
- информируют регуляторные органы о результатах работы по непрерывному сбору и оценке информации по безопасности на этапе клинических исследований и пострегистрационного применения в составе срочных сообщений и периодических отчетов;
- обеспечивают выполнение мер, направленных на применение препаратов в условиях превышения пользы над риском.
Работа сотрудников BIOCAD, которые занимаются всеми этими вопросами, напоминает фильтр, через который просеивается огромное количество информации о терапевтическом действии всех препаратов компании — и на каждое сообщение необходимо отреагировать должным образом. В совокупности весь этот информационный поток позволяет вовремя выявлять новую информацию по безопасности применения лекарственных препаратов и реализовывать необходимые меры.

Управление несоответствиями
Очередная остановка — информационный зал, куда поступают рекламации и отклонения. Рекламация — это претензия от потребителей или контрагентов, у которых возникли вопросы к качеству лекарственного препарата. А отклонения скорее относятся к «внутренней кухне» компании — например, когда на каком-то из этапов производства произошло нарушение или отступление от принятой процедуры. И рекламации, и отклонения внимательно изучают специалисты по качеству и выносят свой вердикт — что могло повлиять на возникшую ситуацию, насколько она критична, как ее исправить и какие меры предпринять, чтобы не допустить повторения.
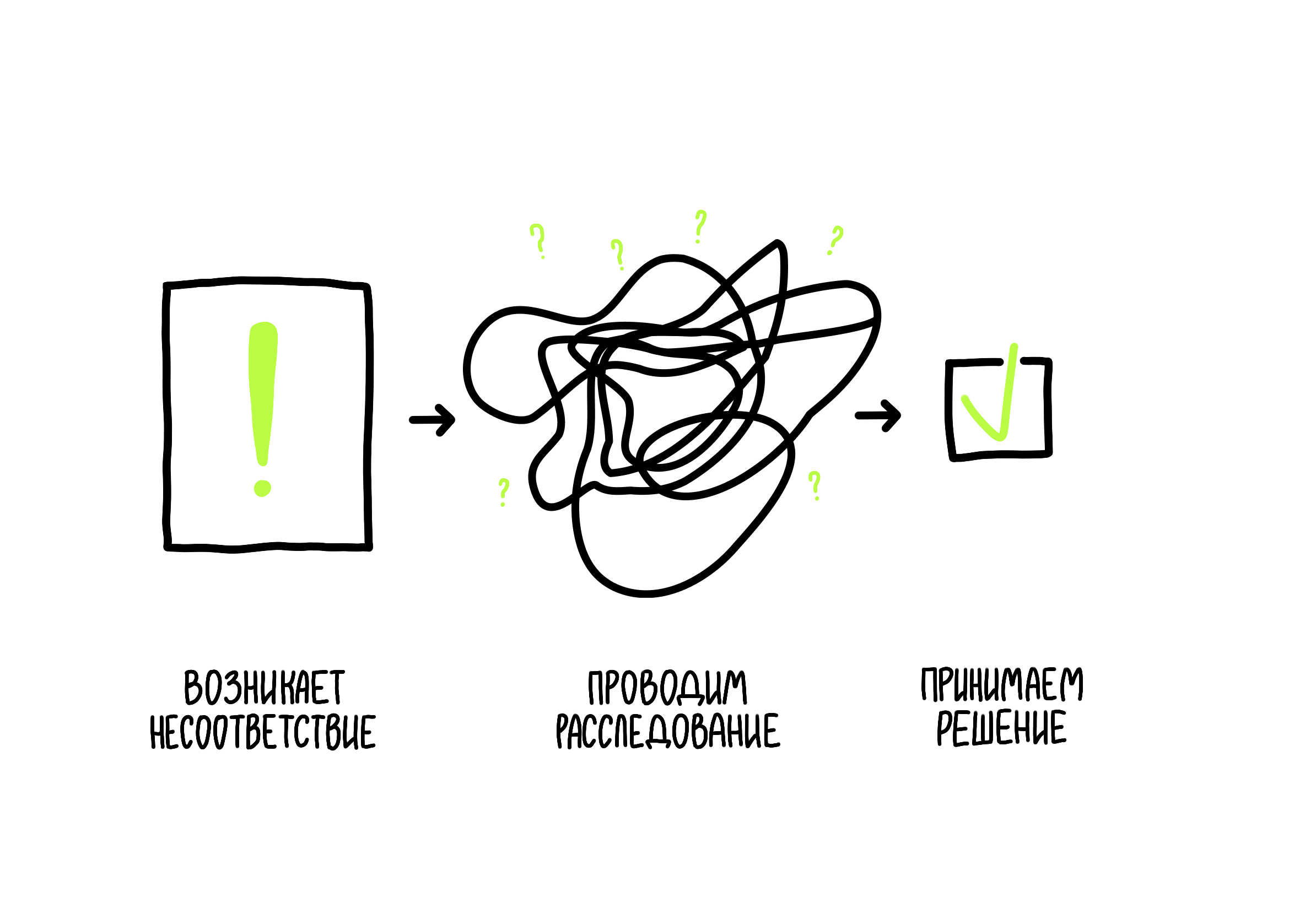
Управление несоответствиями происходит поэтапно:
- Сначала несоответствие или рекламацию регистрируют: что, где и когда произошло.
- Затем ситуацию расследуют, чтобы разобраться в причинах и следствиях.
- После этого проводят оценку: как отклонение могло повлиять на лекарственные препараты и производственные процессы и насколько эти отклонения критичны.
- По результатам оценки специальная комиссия принимает решение — насколько полным было расследование и какие меры необходимо предпринять, чтобы устранить последствия, например отозвать серию препарата.
- После устранения инцидента специалисты по качеству разрабатывают документацию, в которой описаны корректирующие и предупреждающие действия — такой документ называется CAPA-план. Этот план — превентивная мера: с его помощью можно предотвратить возникновение похожих инцидентов в будущем.
Квалификация поставщиков
Наконец, последняя остановка в нашем путеводителе по качеству — линия поставок, на которой проверяют контрагентов. При разработке лекарственного препарата требуются сотни и тысячи ингредиентов, которые невозможно и, наверное, бессмысленно производить в пределах одной компании. Для этого на помощь приходят многочисленные контрагенты — фирмы-производители, которые обеспечивают производство всем необходимым: реактивами, расходными материалами, оборудованием.
Чтобы качество лекарственного препарата не пострадало, важно тщательно отбирать поставщиков. Обычно этот процесс проходит через несколько этапов:
- Оценка: у каждой потенциальной компании-поставщика проверяют все необходимые документы — лицензии, сертификаты и регистрации. Кроме этого, специалисты по качеству изучают историю компании, ее репутацию на рынке и качество продукции — например, изучая образцы расходных материалов или анализируя результаты испытаний приборов.
- Аудит: в зависимости от возможных рисков со стороны компании-поставщика определяется частота и объем проверок, во время которых специалисты по качеству проверяют производственные процессы, условия хранения и перевозки материалов и оборудования.
- Мониторинг и пересмотр: даже за уже налаженными цепями поставок требуется приглядывать — регулярно оценивать качество продукции компании-поставщика.
Все эти шаги позволяют обеспечить высокую надежность контрагентов, чтобы поддерживать на должном уровне процесс производства препаратов в BIOCAD.