
Дайджест #17. Как «подружить» иммунные клетки и вирусы для борьбы с раком
Существует особая группа вирусов, которые используют при лечении рака, — это так называемые онколитические вирусы. Их особенность — в узнавании и целенаправленном уничтожении клеток опухоли. С помощью методов генной терапии можно модифицировать онколитические вирусы так, чтобы они не размножались в здоровых клетках организма, а воздействовали бы только на опухолевые. Но что будет, если «умножить» действие онколитических вирусов и эффект от TIL-терапии с помощью опухоль-инфильтрующих лимфоцитов? О том, что получилось в результате совмещения этих двух способов терапии, — читайте в новом дайджесте.
Обнаружен потенциальный ингибитор для терапии РМЖ
Один из важных регуляторов клеточного цикла — циклин CDK1. В норме этот белок контролирует переход клетки в фазу деления, но в клетках опухолей он часто становится «спусковым крючком» для запуска неконтролируемых делений. Вот почему CDK1, да и остальные циклинзависимые киназы считаются перспективными мишенями для лечения рака. Ранее уже было известно, что запуск транскрипционной активности CDK1 происходит благодаря взаимодействию этого белка с другим циклином, CCNB1, а это, в свою очередь, требует связывания транскрипционного фактора FOXM1. Но недавнее исследование показало, что небольшой фрагмент белка FOXM1 на его карбоксильном конце (пептид M1-20) может служить также и ингибирующим пролиферацию клеток фактором, участвуя в распространенной системе «сдержек и противовесов», поддерживающей равновесие процессов в клетке. Эксперименты на мышиной модели спонтанного рака молочной железы показали: M1-20 связывается именно с CDK1 и ускоряет его деградацию в клетке за счет убиквитинирования — мечения особым сигнальным белком, направляющим получившийся комплекс в протеасому, органоид системы утилизации клетки. Эти результаты продемонстрировали важную роль пептида M1-20 в качестве потенциального ингибитора для терапии рака. — The antitumor peptide M1-20 induced the degradation of CDK1 through CUL4-DDB1-DCAF1-involved ubiquitination.
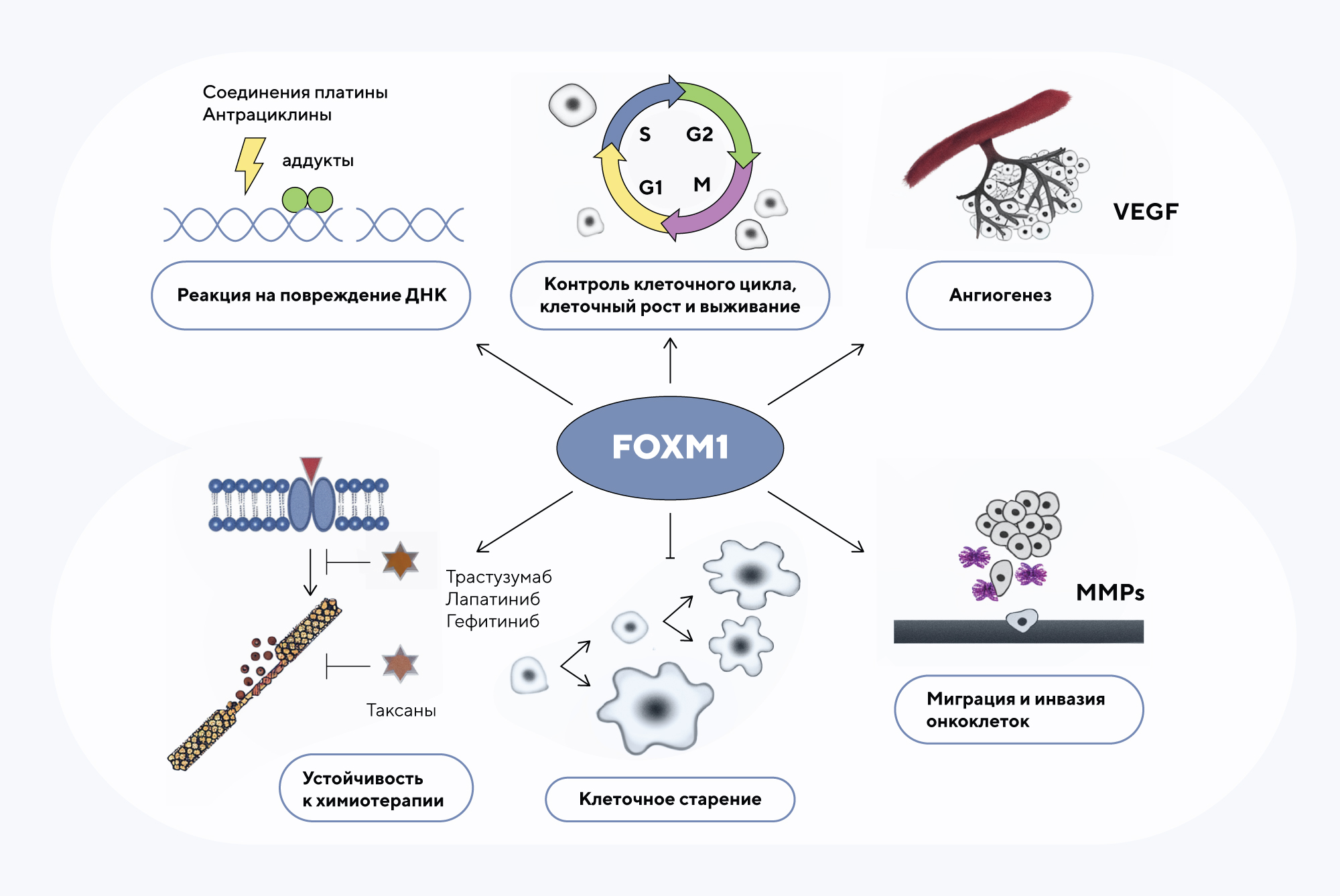
Функциональная роль белка FOXM1 не ограничивается ингибированием CDK1; помимо этого, FOXM1 регулирует различные биологические процессы в клетках. Источник: Science Direct
Онколитические вирусы для поддержки адоптивной терапии
Некоторые вирусы могут работать не против человека, а на него. К ним относятся «хорошие» онколитические вирусы, способные помогать иммунной системе подавлять опухоли. Для этого на вооружение берут и естественные природные вирусы, способные избирательно находить и уничтожать раковые клетки, и «вооружают» вирусы искусственно — методами генной инженерии. Но онколитические вирусы не обязательно воздействуют на опухоли напрямую — в некоторых случаях они умножают терапевтический эффект опухоль-инфильтрующих лимфоцитов, повышая эффективность TIL-терапии. Например, за последние несколько лет уже накопилось достаточно доказательств, что онколитические вирусы улучшают прогнозы TIL-терапии при раке полости рта, раке толстой кишки и раке поджелудочной железы. Недавно решили изучить терапевтический эффект онколитических вирусов при TIL-терапии гепатоцеллюлярной карциномы — одного из агрессивных видов рака печени. В исследование включили онколитические вирусы, кодирующие фактор некроза опухоли 4-1BBL и IL-15. Выяснилось, что введение этих вирусов в сочетании с адоптивной TIL-терапией вызывало уменьшение объема опухоли и формирование противоопухолевой иммунной памяти — это удалось продемонстрировать в ксенотрансплантатах человека и на мышиных моделях. Более того, такое сочетание онколитиков с опухоль-инфильтрующими лимфоцитами дополнительно активировало Т-клетки и перепрограммировало опухолевые макрофаги, нацеливая их против раковых клеток. Этот способ лечения может открыть широкие перспективы в клиническом применении против рака печени. — Oncolytic virus encoding 4-1BBL and IL15 enhances the efficacy of tumor-infiltrating lymphocyte adoptive therapy in HCC.
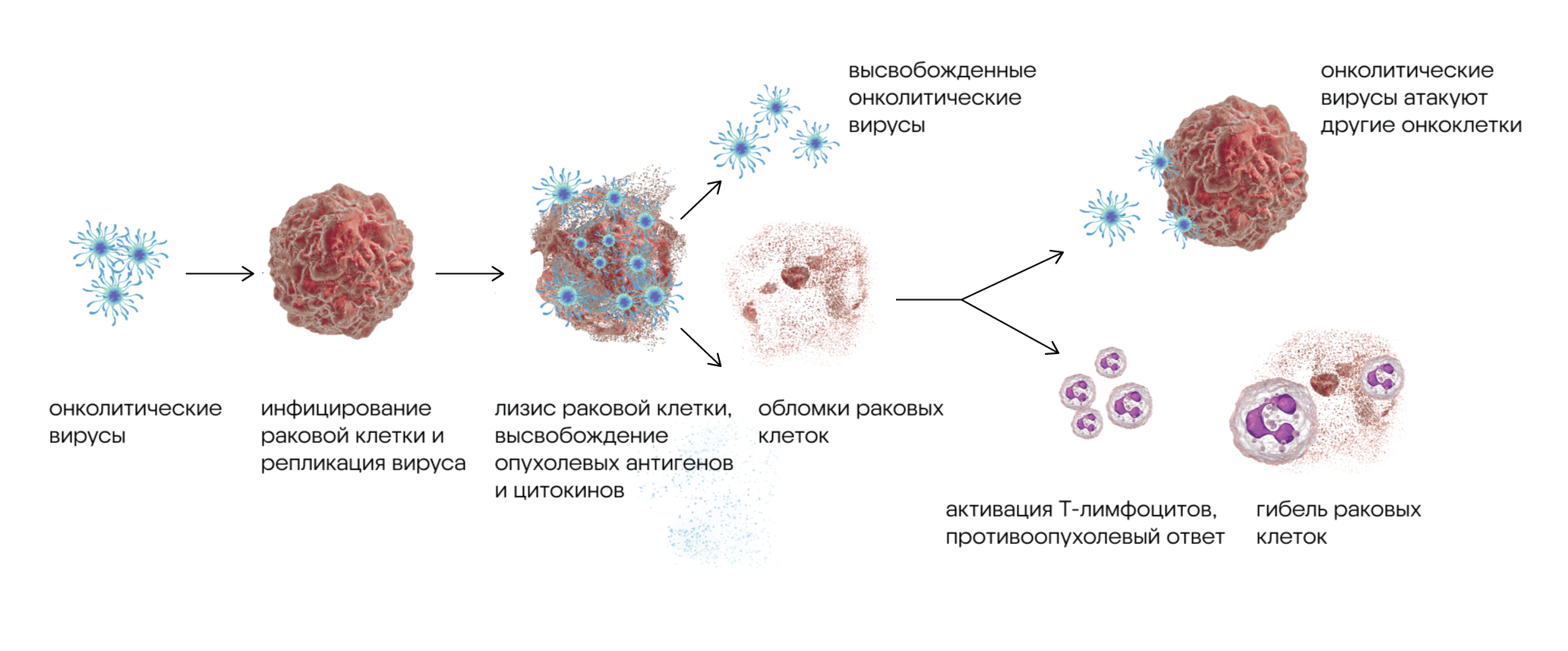
Механизм воздействия онколитических вирусов на раковые клетки: сначала вирус инфицирует раковую клетку и реплицируется. Это приводит к разрушению (лизису) раковой клетки, в результате чего высвобождаются опухолевые антигены и активируются Т-лимфоциты. Это приводит к противоопухолевому иммунному ответу, который заставляет онкоклетку погибнуть. Источник: адаптировано из Esco VacciXcell News
Создана «бессмертная» линия клеток, которая поможет в изучении рака гортани
Развитие рака гортани, как и других видов опухолей, начинается постепенно — и одним из предвестников служит лейкоплакия. Это такое состояние, при котором поражаются слизистые оболочки и нарушается ороговение плоского эпителия. Изучение подобных предраковых поражений гортани осложняется небольшим размером эпителиальных клеток и их недолгой продолжительностью жизни в клеточных культурах. Чтобы лучше разобраться с лейкоплакией голосовых связок, исследователи из Китая разработали «бессмертную» линию клеток hVCL-MSDEP01 на основе эпителиальных клеток голосовых связок человека, иммортализованных с помощью так называемого большого Т-антигена вируса SV40. Эта клеточная линия уже показала отличия в динамике клеточного цикла и процессах апоптоза по сравнению с обычными эпителиальными клетками, а также может служить оптимальной моделью для исследований рака гортани in vitro. Конечно, это исследование не решает проблему лечения рака гортани, но может значительно ускорить этот непростой процесс. — Establishment and characterization of the first immortalized vocal cord leukoplakia epithelial cell line.
Структура большого Т-антигена вируса SV40. Этот белок способен вызывать злокачественную трансформацию различных типов клеток. Источник: Википедия
Найдена потенциальная мишень для терапии рака легких
Рак легких, а точнее одна из его разновидностей — аденокарцинома, остается одной из основных причин смертности от онкологических заболеваний во всем мире. В свое время удалось выявить одну из возможных причин, которая запускает процесс пролиферации опухолевых клеток, — виновником стал трансмембранный рецептор EGFR (epidermal growth factor receptor). Повышение активации EGFR в результате каскада реакций приводит к повышенному делению онкоклеток, росту опухоли и метастазированию. Разработка ингибиторов тирозинкиназ на какое-то время помогала эффективно улучшать прогноз для пациентов с раком легкого. Однако затем лечение осложнилось резистентностью — это когда в клетках возникают мутации EGFR, обеспечивающие резистентность опухоли к терапии с помощью ингибиторов тирозинкиназ. И вот, чтобы преодолеть этот барьер, группа исследователей детально изучила молекулярные аспекты лекарственной устойчивости, сопряженной с EGFR при аденокарциноме легкого. Выяснилось, что существенный вклад в резистентность раковых клеток вносит белок CCDC34 — в более ранних исследованиях его роль была показана только при метастазировании и быстром делении клеток опухоли. Нокдаун гена CCDC34, то есть его «выключение», в сочетании с терапией с помощью ингибиторов тирозинкиназ может стать многообещающим методом лечения аденокарциномы при немелкоклеточном раке легкого. — CCDC34 maintains stemness phenotype through β-catenin-mediated autophagy and promotes EGFR-TKI resistance in lung adenocarcinoma.
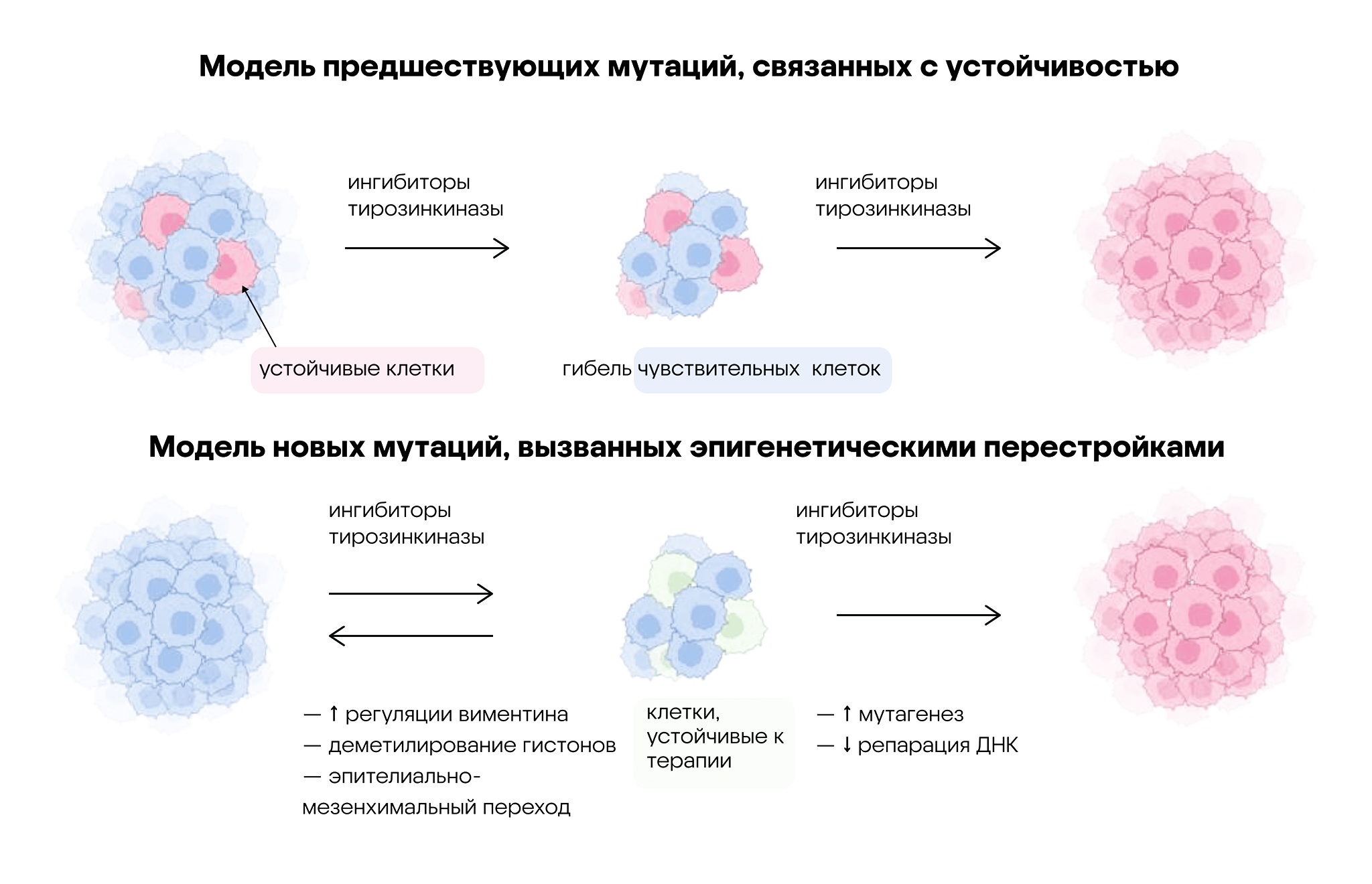
Существуют две модели, объясняющие устойчивость опухолей к ингибиторам тирозинкиназы. Согласно первой модели (показана в верхней части рисунка), в опухолях имеется несколько раковых клеток, устойчивых к терапии. После воздействия ингибиторов тирозинкиназы все чувствительные клетки погибают, а опухоль повторно заселяется резистентными клетками.
Согласно второй модели (показана в нижней части рисунка), воздействие ингибиторов тирозинкиназы вызывает генерацию активных форм кислорода (АФК) и массовую гибель клеток. Однако вместе с этим терапия одновременно провоцирует эпителиально-мезенхимальный переход среди небольшой популяции клеток, устойчивых к ингибиторам. Несмотря на то что этот переход обратим, постоянное воздействие препарата повышает уровень антиоксидантов, из-за чего снижается степень репарации ДНК — и в результате клетки опухоли приобретают постоянную резистентность к ингибиторам тирозинкиназы. Источник: MDPI
Как вылечить рак желудка методами генной терапии
В пятерку наиболее распространенных в мире видов рака входит рак желудка. Чтобы лучше разобраться в молекулярно-генетической природе этого заболевания, исследователи из Китая изучили молекулу гликопротеина CEACAM6. Ранее уже была показана роль этого белка в развитии рака — так, у пациентов с раком желудка отмечалась повышенная экспрессия гена, кодирующего CEACAM6. Ученые разобрались в сигнальных путях, в которых участвует CEACAM6, и выяснили: этот гликопротеин опосредованно влияет на экспрессию другого белка, SLC27A2, который играет ключевую роль в биосинтезе липидов и жирных кислот. Активное накопление жирных кислот, в свою очередь, идет на пользу раковым клеткам: благодаря большим энергетическим запасам клетки опухолей быстрее делятся и разрастаются. Если же ингибировать SLC27A2 — например, за счет подавления экспрессии гена, кодирующего этот белок, — можно снизить уровень жирных кислот в клетках опухолей и улучшить прогнозы для пациентов с CEACAM6-положительным раком желудка. — CEACAM6 facilitates gastric cancer progression through upregulating SLC27A2.
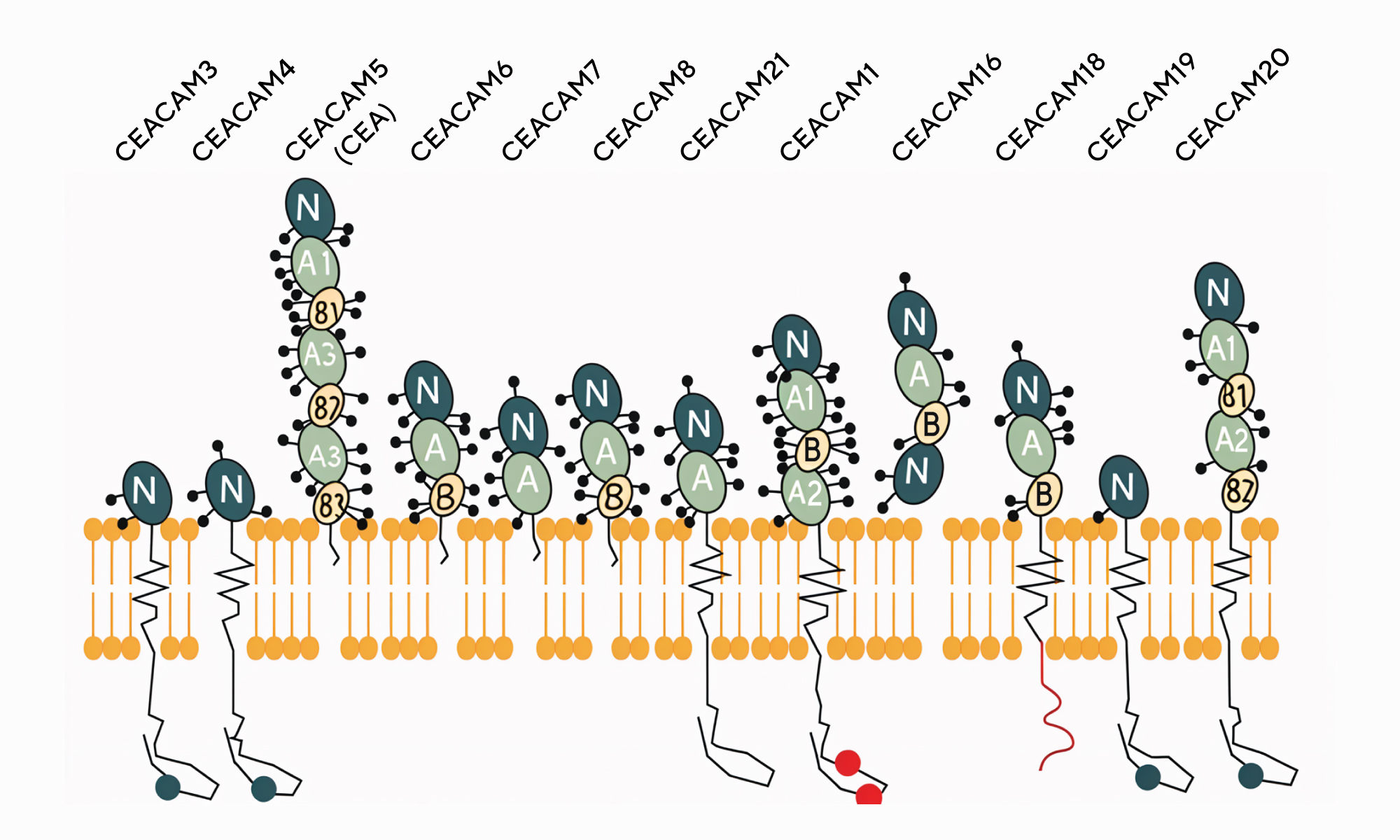
В суперсемейство CEACAM входят 12 иммуноглобулин-подобных белков. В их числе и CEACAM6 — одно из главных «действующих лиц» нового исследования. Источник: Europe PMC
Обнаружен перспективный способ терапии при лейкозе
При остром миелоидном лейкозе нарушается нормальный процесс размножения лейкоцитов. Они накапливаются в костном мозге и подавляют рост нормальных клеток крови, приводя к злокачественному перерождению этого кроветворного органа. Выделяют несколько причин, почему может происходить такая трансформация лейкоцитов, и в их числе — мутация FLT3-ITD, при которой в гене тирозинкиназы FLT3 возникают тандемные повторы. Недавно выяснилось, что важную роль в нарушении экспрессии FLT3 играет рибосомальная протеинкиназа RSK1. Если каким-то образом нарушить работу этого белка, белок FLT3 не фосфорилируется, а значит, не активируется и не запускает каскад реакций, приводящих к злокачественному перерождению клеток. Более того, «выключение» RSK1 приводит к выраженному апоптозу — направленной гибели «неправильных» клеток. Кстати, в качестве ингибитора RSK1 использовали PMD-026 — первый в классе препарат, который в настоящий момент проходит вторую фазу клинических исследований, но по другому показанию — лечение рака молочной железы. Терапия с помощью PMD-026 на моделях лейкемии предварительно показала успешные результаты — и, возможно, этот ингибитор станет эффективным против рака крови. — RSK1 dependency in FLT3-ITD acute myeloid leukemia.
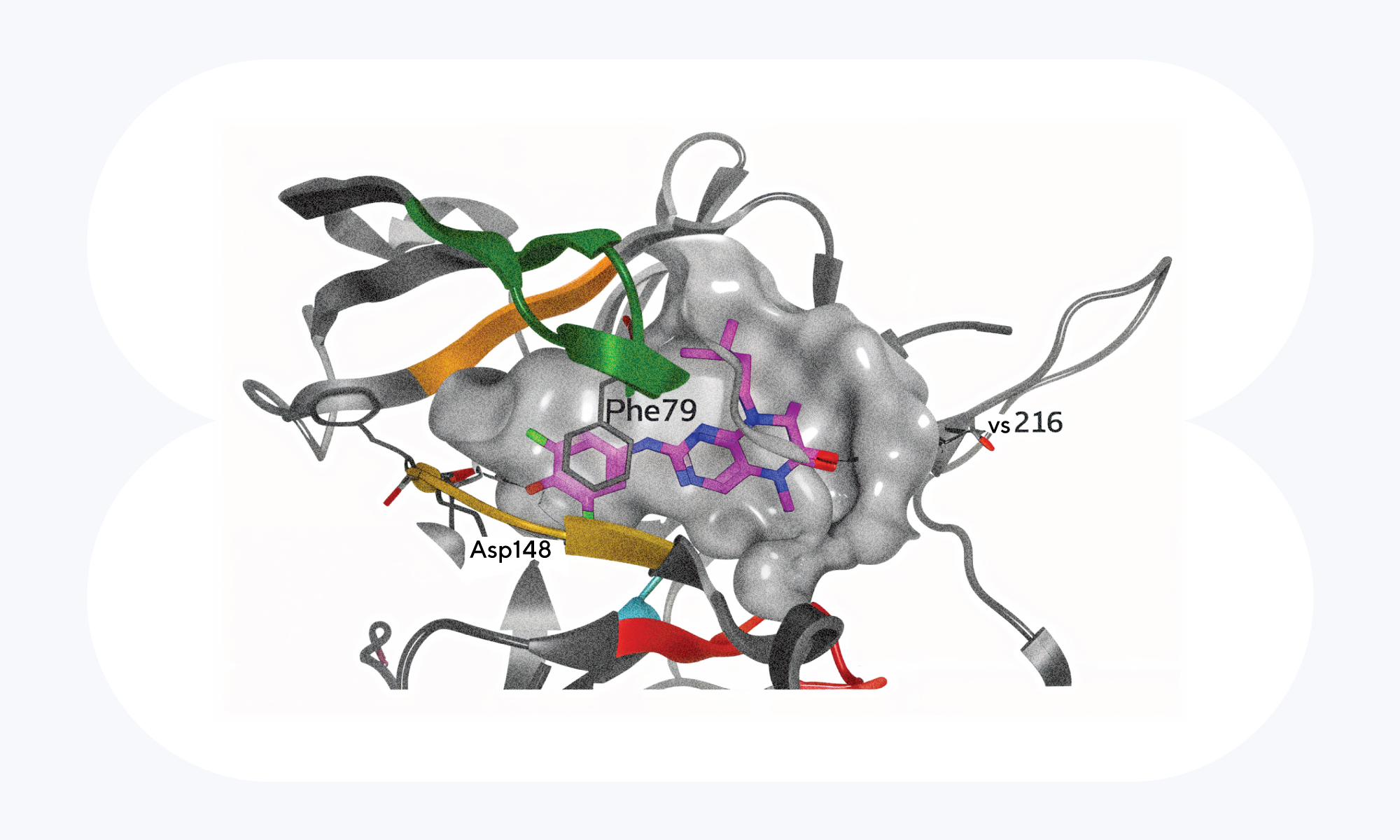
PMD-026 — высокоселективный ингибитор, который связывается c рибосомальными протеинкиназами 1 и 2. Этот препарат находится на второй фазе клинических исследований против рака молочной железы, ассоциированным с RSC2, — и, возможно, будет эффективен не только против сóлидных опухолей, но и при терапии лейкемии, ассоциированной с RSC1. Источник: Phoenix Molecular Designs
Ингибирование SKP2 поддерживает противоопухолевую эффективность
Белок SKP2 считается онкогеном — его сверхэкспрессия связана с последующим развитием различных типов рака. Недавно удалось показать, что ингибирование SKP2 значительно повышает противоопухолевую эффективность блокады иммунных чекпоинтов. Также «выключение» этого белка активировало сигнальный путь cGAS/STING — один из ключевых медиаторов воспаления — и запускало секрецию провоспалительных хемокинов. Все эти выводы показывают: SKP2 можно использовать в качестве перспективной мишени для поддержки противоопухолевой иммунотерапии. — SKP2 inhibition activates tumor cell-intrinsic immunity by inducing DNA replication stress and genomic instability.
Белок SKP2 — перспективная мишень для лечения рака и для борьбы с лекарственной резистентностью. Источник: Википедия