Научный дайджест #22: Наносим по опухоли двойной удар
В мире клеток всё взаимосвязано — их окружение и внутренние сигналы определяют судьбу каждой клетки. Опухолевые клетки не исключение: их рост и выживание во многом зависят от сложных биохимических процессов и взаимодействий с микросредой. Одним из ключевых игроков в этом процессе является рецептор эпидермального фактора роста (EGFR), который стимулирует пролиферацию клеток, а также фермент карбоангидраза, помогающий опухоли адаптироваться к кислородному дефициту. Недавно исследователи предложили инновационный подход к иммунотерапии злокачественных новообразований — разработали новые соединения на основе тиадиазол-сульфонамидов, способные одновременно блокировать оба этих «механизма выживания» опухоли. Как именно это работает и какие перспективы открывает для борьбы с раком — читайте в нашем новом научном дайджесте.
Белок с онкогенными свойствами может стать новой мишенью в лечении гепатоцеллюлярной карциномы
Белок SF3B4 (splicing factor 3b subunit 4) необходим для сборки сплайсосомы и точного сплайсинга, а также играет важную роль в развитии злокачественных новообразований. Если точнее — гепатоцеллюлярной карциномы: ранее уже была показана роль SF3B4 в качестве раннего маркера и драйвера опухолевого процесса. Механизм участия SF3B4 в опухолевом процессе связан с его влиянием на сплайсинг и экспрессию генов-супрессоров опухолей. Однако точный механизм, за счет которого SF3B4 провоцирует рост опухоли, остается неясным. Исследователи из Китая решили разобраться в этой проблеме и, используя модель гепатоцеллюлярной карциномы, изучили молекулярные механизмы взаимодействия SF3B4 с другими факторами. Выяснилось, что SF3B4 связывается и регулирует другой белок, BUB1, в результате чего запускаются деления и пролиферации опухолевых клеток. Эти результаты подсвечивают важную роль SF3B4 как потенциальной мишени для лечения гепатоцеллюлярной карциномы. — Pan-cancer oncogenic properties and therapeutic potential of SF3B4.
Белок SF3B4 не только участвует в сплайсинге пре-мРНК, но и играет ключевую роль в регуляции альтернативного сплайсинга генов, влияя на процессы клеточного цикла и метастазирования раковых клеток. Например, нарушение функции SF3B4 может приводить к неправильному сплайсингу опухолевых супрессоров, что способствует развитию и прогрессии различных видов злокачественных новообразований — в том числе гепатоцеллюлярной карциномы, лечение которой и стало темой описанного исследования.
Как усилить ответ на опухоль с помощью иммунной и антиангиогенной терапии
Опухоли умеют эффективно «прятаться» от иммунной системы. Чтобы помочь клеткам организма в борьбе со злокачественными новообразованиями, применяют иммунную и антиангиогенную терапию. Эти методы лечения позволяют снять «тормоза» с иммунной системы и буквально перекрывают опухоли «дыхание». Так, в недавнем исследовании ученые решили изучить эффекты от комбинированного действия ингибиторов иммунных контрольных точек и антиангиогенных препаратов — конкретно атезолизумаба и бевацизумаба — совместно с перепрограммированием макрофагов при PD-L1-негативном немелкоклеточном раке легкого. Применение такой совместной терапии показало неплохие результаты: медиану времени до прогрессирования заболевания в 8,5 месяцев, что на 3,4 месяца больше, чем при монотерапии. Таким образом, комбинирование стратегий открывает новые перспективы для повышения эффективности терапии различных видов рака. — Enhancing antitumor immunity: the role of immune checkpoint inhibitors, anti-angiogenic therapy, and macrophage reprogramming.
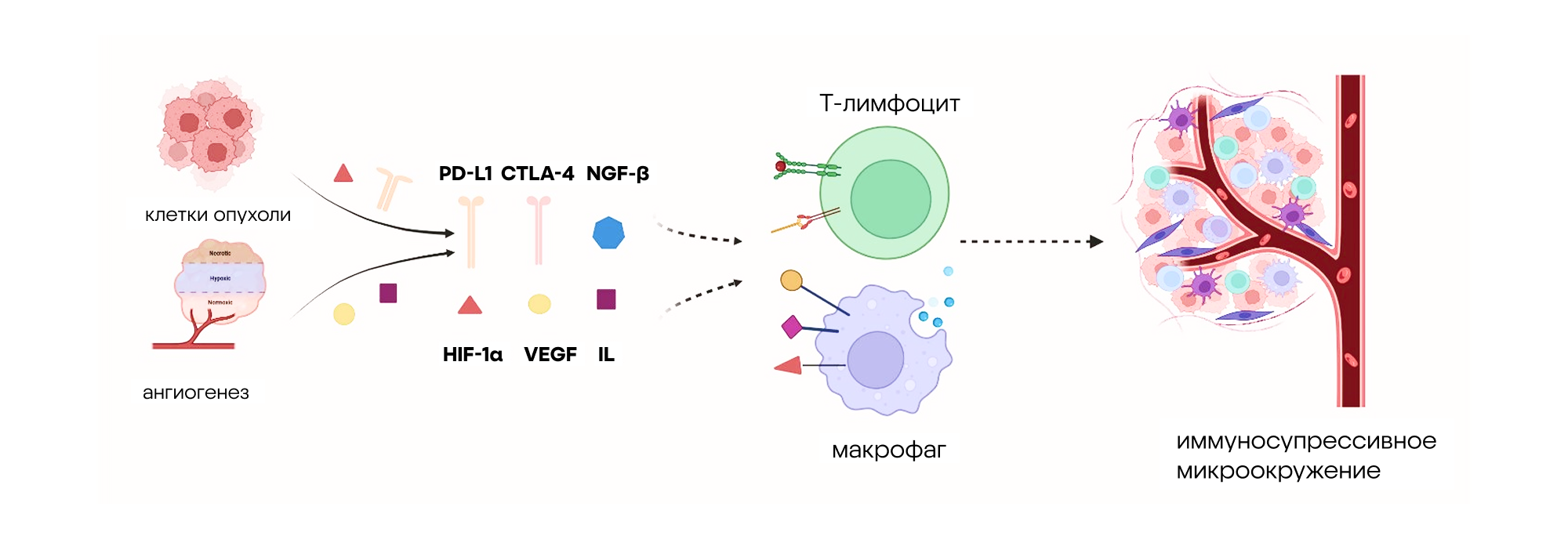
Антигенпрезентирующие клетки демонстрируют на своей поверхности антигены, полученные из патогенов или злокачественных клеток, облегчая распознавание Т-лимфоцитами. После этого Т-клетки активируются и дифференцируются в эффекторные клетки, включая CAR-T-клетки, которые целенаправленно нацеливаются на опухолевые антигены. Костимулирующие молекулы, такие как CD80/86, GL50, 4-1BBL и ICOS, еще больше усиливают этот процесс активации. Впоследствии эффекторные Т-лимфоциты мигрируют к клеткам опухоли, где CAR-T-клетки взаимодействуют с антигенами и высвобождают цитотоксические молекулы, что приводит к апоптозу — целенаправленной гибели опухолевых клеток. Источник: адаптировано из Frontiers
Почему эндогенные ретровирусы помогают лучше понять прогноз лечения глиобластомы
Человеческие эндогенные ретровирусы (HERVs, human endogenous retroviruses) — это фрагменты вирусной ДНК, которые встраиваются в геном человека в процессе эволюции. В последние годы они привлекают внимание исследователей как потенциальные факторы, влияющие на развитие и течение различных опухолей, включая глиобластому — агрессивную форму рака мозга. В недавней работе ученые из США изучили связь между экспрессией и активностью HERVs и риском возникновения глиобластомы, а также роль этих ретровирусов в прогнозировании исхода заболевания. Выяснилось, что определенные типы HERVs могут способствовать опухолевому росту и влиять на иммунный ответ организма, что отражается на агрессивности опухоли и выживаемости пациентов. Эти результаты подсвечивают важную роль HERVs как перспективных биомаркеров для ранней диагностики и прогноза глиобластомы, а также как потенциальных мишеней для разработки новых терапевтических стратегий. — Human endogenous retroviruses (HERVs) associated with glioblastoma risk and prognosis.
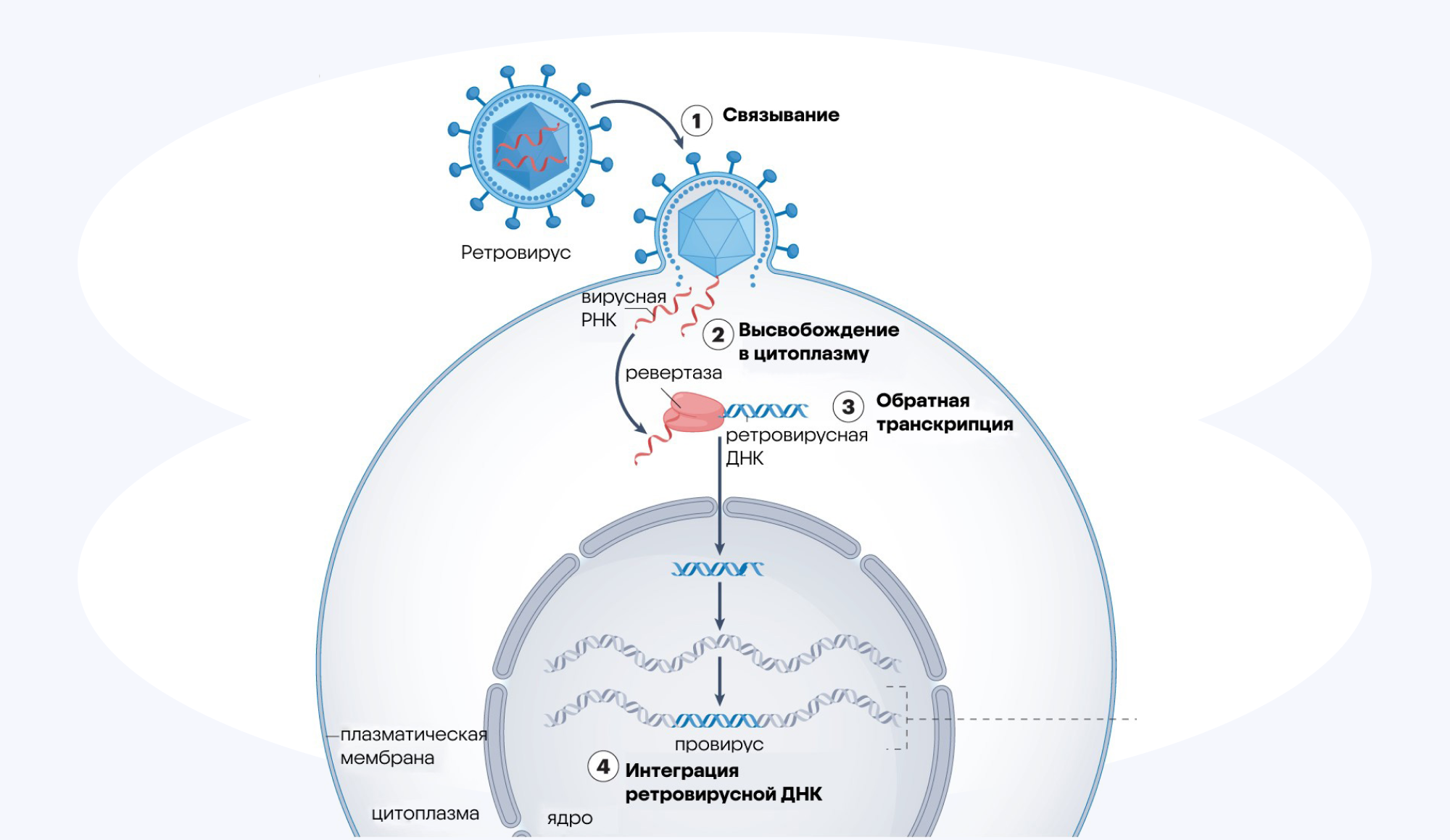
Сначала вирусная частица связывается с конкретными рецепторами на поверхности клетки-хозяина. Это обеспечивает специфичность заражения и определяет, какие клетки могут быть инфицированы. Затем происходит слияние вирусной оболочки с мембраной клетки-хозяина, что позволяет вирусному содержимому — РНК и ферментам — попасть в цитоплазму клетки. После этого вирусный фермент — обратная транскриптаза — синтезирует комплементарную ДНК (кДНК) на матрице вирусной РНК. В результате образуется двухцепочечная провирусная ДНК, которая становится основой для интеграции в геном клетки. Эта провирусная ДНК транспортируется в ядро клетки, где с помощью вирусного фермента интегразы происходит встраивание провируса в ДНК хозяина. Интегрированная провирусная ДНК становится частью генома клетки и может транскрибироваться, обеспечивая синтез новых вирусных частиц. Источник: адаптировано из Nature Molecular Cell Biology
Какие перспективы противоопухолевой терапии открывает управление клеточным циклом
Одну из ключевых функций в регуляции клеточного цикла, особенно в процессе митоза, выполняет серин/треониновая протеинкиназа Polo-like kinase 1 (PLK1). Активность этого фермента строго контролируется на структурном уровне, что обеспечивает точное выполнение множества процессов: созревание центросом, формирование митотического веретена, разделение хромосом и завершение деления клетки. Однако PLK1 часто становится объектом исследований не только с целью изучения базовой биологии клеточного цикла, но и для разработки новых противораковых препаратов. Дело в том, что фермент PLK1 часто гиперактивен в опухолевых клетках и способствует их неконтролируемому росту. Чтобы лучше разобраться в молекулярных механизмах регулирования PLK1, ученые из США изучили, как фосфорилирование, взаимодействие с другими белками и изменения конформации PLK1 влияют на функции фермента. В частности, исследователи выявили ключевые участки белка, ответственные за переключение между активным и неактивным состоянием, а также механизмы, обеспечивающие его точную локализацию в клетке в нужное время. В результате удалось сделать чуть более понятными фундаментальные механизмы контроля клеточного цикла и, что имеет более практическое значение, — обнаружить потенциальные способы разработки селективных ингибиторов, способных эффективно блокировать активность фермента PLK1, а значит, замедлять прогрессирование злокачественных новообразований. — Structural regulation of PLK1 activity: implications for cell cycle function and drug discovery.
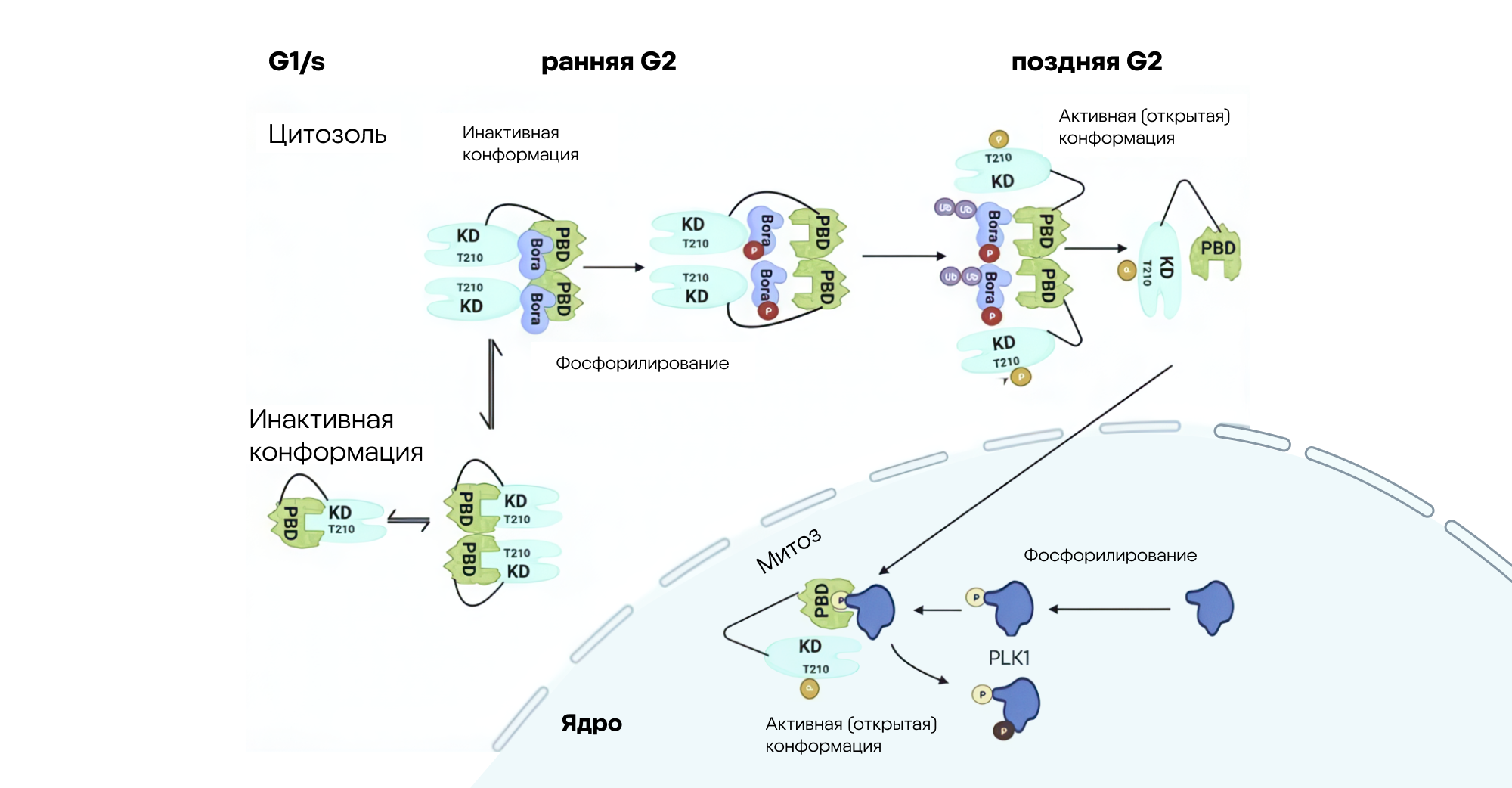
Фермент PLK1 принимает инактивную закрытую и автоингибированную конформацию в фазах G1 и S клеточного цикла соответственно. Неактивное состояние фермента сохраняется до поздней фазы G2, когда за счет деградации других субъединиц и фосфорилирования образуется открытая конформация PLK1, которая является каталитически активной и способна связываться с субстратами. Источник: адаптировано из Cancer Gene Therapy
Двойной ингибитор EGFR и карбоангидразы IX продемонстрировал высокую эффективность при лечении рака груди
Рецептор эпидермального фактора роста (EGFR) — трансмембранный белок с тирозинкиназной активностью, который находится на поверхности клеток. Он служит своеобразной «антенной» для внеклеточных сигнальных молекул — эпидермальных факторов роста. После связывания с лигандом EGFR активируется, образует димеры и запускает внутри клетки каскады биохимических реакций, регулирующих рост, деление, выживание и дифференцировку клеток. EGFR играет важную роль в патогенезе и прогрессии опухоли. Но функции этого белка отнюдь не всегда идут на пользу клеткам: в случае повышенной экспрессии или мутации EGFR приводят к избыточной активации сигнальных путей, таких как RAS-RAF-MAPK и PI3K-AKT. Это стимулирует неконтролируемую пролиферацию опухолевых клеток, подавляет апоптоз и способствует метастазированию. Вот почему EGFR считается важной мишенью для таргетной терапии при солидных опухолях.
Недавно ученые из Египта синтезировали новые соединения на основе тиадиазол-сульфонамидов, обладающие двойной активностью. Конкретно, эти соединения ингибируют как рецептор эпидермального фактора роста (EGFR), так и фермент карбоангидразу. Оба этих белка играют важную роль в развитии и прогрессии различных видов рака: EGFR, как мы уже обсудили выше, участвует в регуляции клеточного роста и деления, а карбоангидраза способствует адаптации опухолевых клеток к кислородному дефициту и поддержанию кислотно-щелочного баланса.
Исследователи провели химический синтез серии новых соединений, после чего оценили их биологическую активность in vitro против клеток рака молочной железы. Полученные тиадиазол-сульфонамиды продемонстрировали высокую эффективность в подавлении активности EGFR и карбоангидразы, а также значительное ингибирование роста раковых клеток в лабораторных условиях. Двойное ингибирование этих мишеней открывает перспективы для разработки новых противоопухолевых препаратов с улучшенной эффективностью и возможным снижением побочных эффектов. — Development of new anticancer thiadiazole-sulfonamides as dual EGFR/carbonic anhydrase inhibitors.
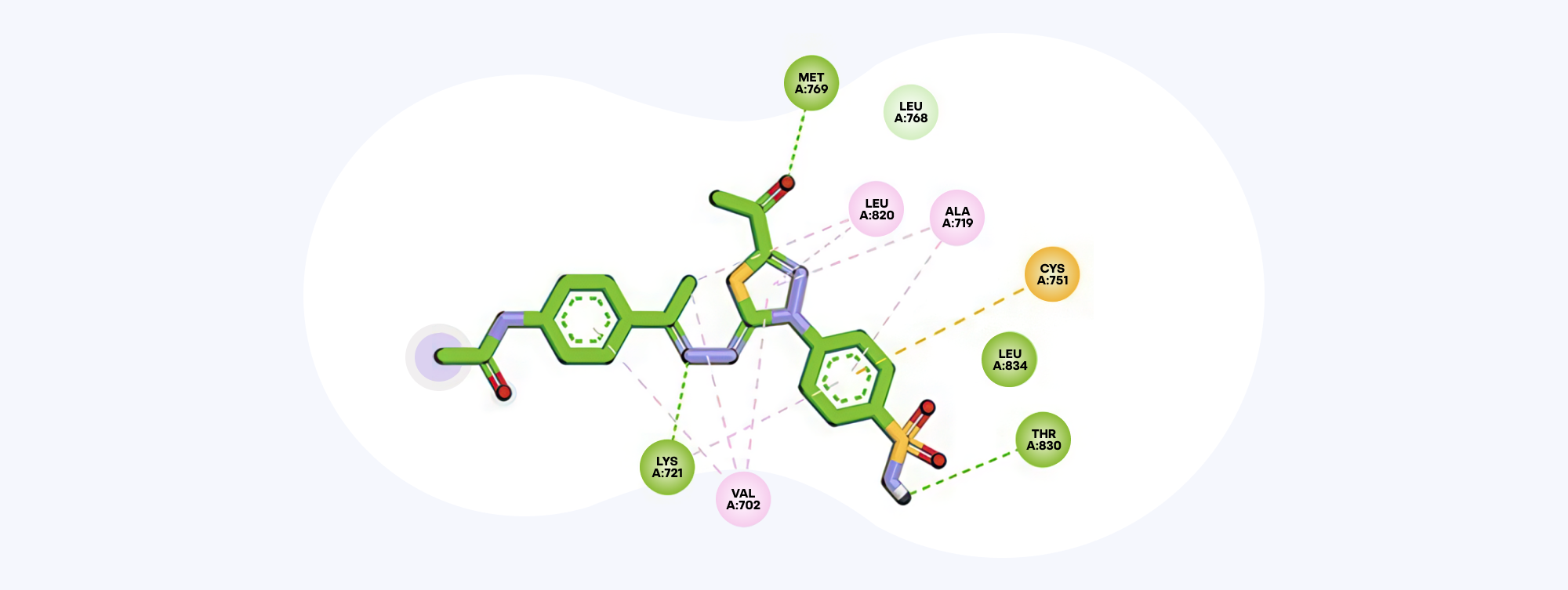
Так выглядит структура двойного ингибитора рецептора эпидермального фактора роста (EGFR) и карбоангидразы IX (CA-IX) с селективной противораковой активностью. Это соединение вызывает апоптоз опухолевых клеток, что подтверждается активацией каспаз 8 и 9, а также задержкой клеточного цикла в фазе G1. Компьютерное моделирование подтвердило стабильное связывание с мишенями и благоприятный профиль безопасности. Источник: Future Medicinal Chemistry
Найдены два новых потенциальных ингибитора для терапии глиобластомы
Мультиформная глиобластома (GBM) — быстрорастущая и агрессивная опухоль мозга, которая способна возникать de novo в мозге или развиваться из другого типа опухоли — астроцитомы низкой степени злокачественности. Терапия этого вида глиобластомы осложняется ее локализацией в иммунопривилегированном органе, высокими показателями резистентности к цитостатическому соединению темозоломиду и обширной инфильтрацией злокачественных клеток в паренхиму. В новом исследовании ученые из Мексики представили два новых потенциальных соединения для терапии глиобластомы — ими стали производные тетрагидрохинолина. Эти соединения нацелены на два важных белка: GPER (G-протеин-связанный эстрогеновый рецептор), участвующий в регуляции роста опухолевых клеток, и Bcl-2 — ключевой антиапоптотический белок, способствующий выживанию раковых клеток. Авторы провели доклинические исследования, в том числе оценку цитотоксичности, влияние на апоптоз и клеточный цикл, а также молекулярное моделирование взаимодействия с мишенями. Полученные данные показали, что оба соединения эффективно подавляют рост глиобластомных клеток, стимулируют программируемую клеточную смерть и изменяют экспрессию белков, регулирующих выживание и пролиферацию. Эти результаты демонстрируют перспективность тетрагидрохинолиновых производных как двойных ингибиторов GPER и Bcl-2 и открывают новые возможности для разработки эффективных противоглиобластомных препаратов. — Preclinical approach of two novel tetrahydroquinoline derivatives targeting GPER and Bcl-2 for anti-glioblastoma therapy.
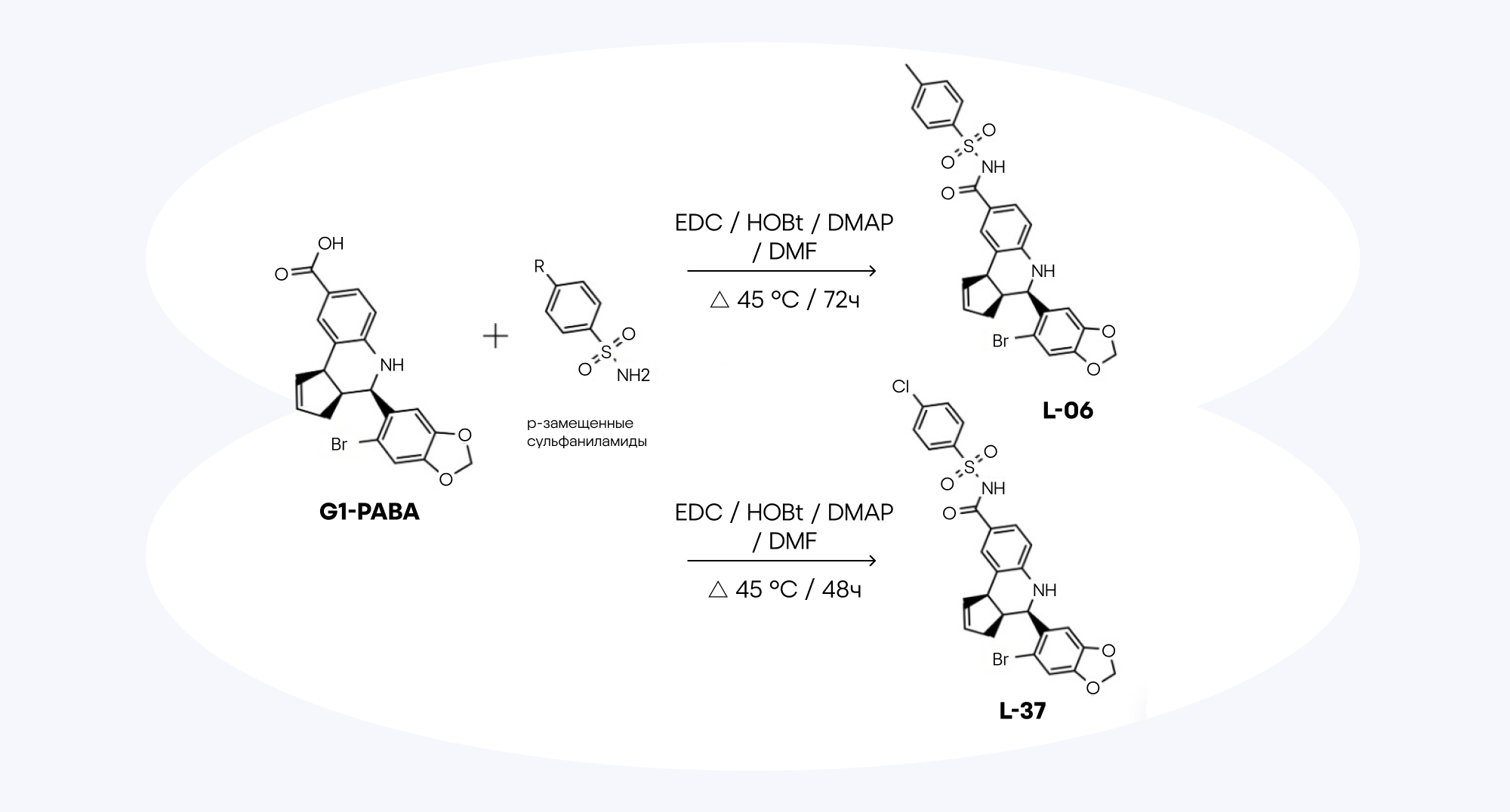
Соединения L-06 и L-37 — перспективные кандидаты на роль двойных ингибиторов GPER и Bcl-2 с потенциалом для разработки эффективной и безопасной терапии глиобластомы. На рисунке представлена схема и условия синтеза этих соединений. L-06 содержит p-толуолсульфонамидную группу, а L-37 — 4-хлорбензолсульфонамидную. Оба соединения эффективно подавляют рост глиобластомных клеток (линии LN-18 и U373), однако L-37 проявляет большую активность: вероятно, это связано с присутствием атома хлора, который улучшает взаимодействие с мишенью Bcl-2. Источник: Nature Scientific Reports