
Научный дайджест #26: митохондрии замечены в плохих делах
Недавно выяснилось, что полезные и нужные «энергетические станции» клетки в плохих руках становятся «двигателем зла». Оказывается, при передаче митохондрий от опухолевых клеток к окружающим их фибробластам происходит превращение их в опухоль-ассоциированные клетки. Этот неожиданный способ межклеточного обмена формирует благоприятную среду для прогрессирования опухоли. О том, как это работает и что с этим делать, а также о других открытиях в молекулярной онкологии, читайте в новом выпуске дайджеста!
Клеточный «тормоз» для защиты от агрессивной лимфомы
Лимфома — одна из самых агрессивных форм злокачественных заболеваний крови, при которой лимфоциты начинают бесконтрольно делиться и вытеснять здоровые клетки крови. Часто это заболевание сопряжено со сверхэкспрессией онкогена Myc, из-за чего нарушается контроль клеточного роста и обмена веществ, поэтому ученые активно ищут уязвимые «точки» для воздействия на эту неуловимую болезнь. И кажется, что одну из возможных мишеней удалось найти исследователям из Австралии — ею оказался комплекс белков GATOR1. Эта система представляет собой естественный «тормоз» клеточного роста, регулирующий ключевой путь mTORC1. Потеря компонентов GATOR1 приводит к гиперактивации сигнального пути, ускоряя рост опухолей и усиливая агрессивность заболевания.
Открытие GATOR1 как критического опухолевого супрессора не только углубляет понимание биологии Myc-опухолей, но и предлагает перспективы для терапии: лимфомы с «выключенным» GATOR1 оказываются очень чувствительны к уже существующим ингибиторам mTORC1. Это открывает путь к новым точечным методам лечения, которые могут повысить эффективность и снизить побочные действия у пациентов с лимфомой. — Genome-wide in vivo CRISPR screens identify GATOR1 complex as a tumor suppressor in Myc-driven lymphoma.
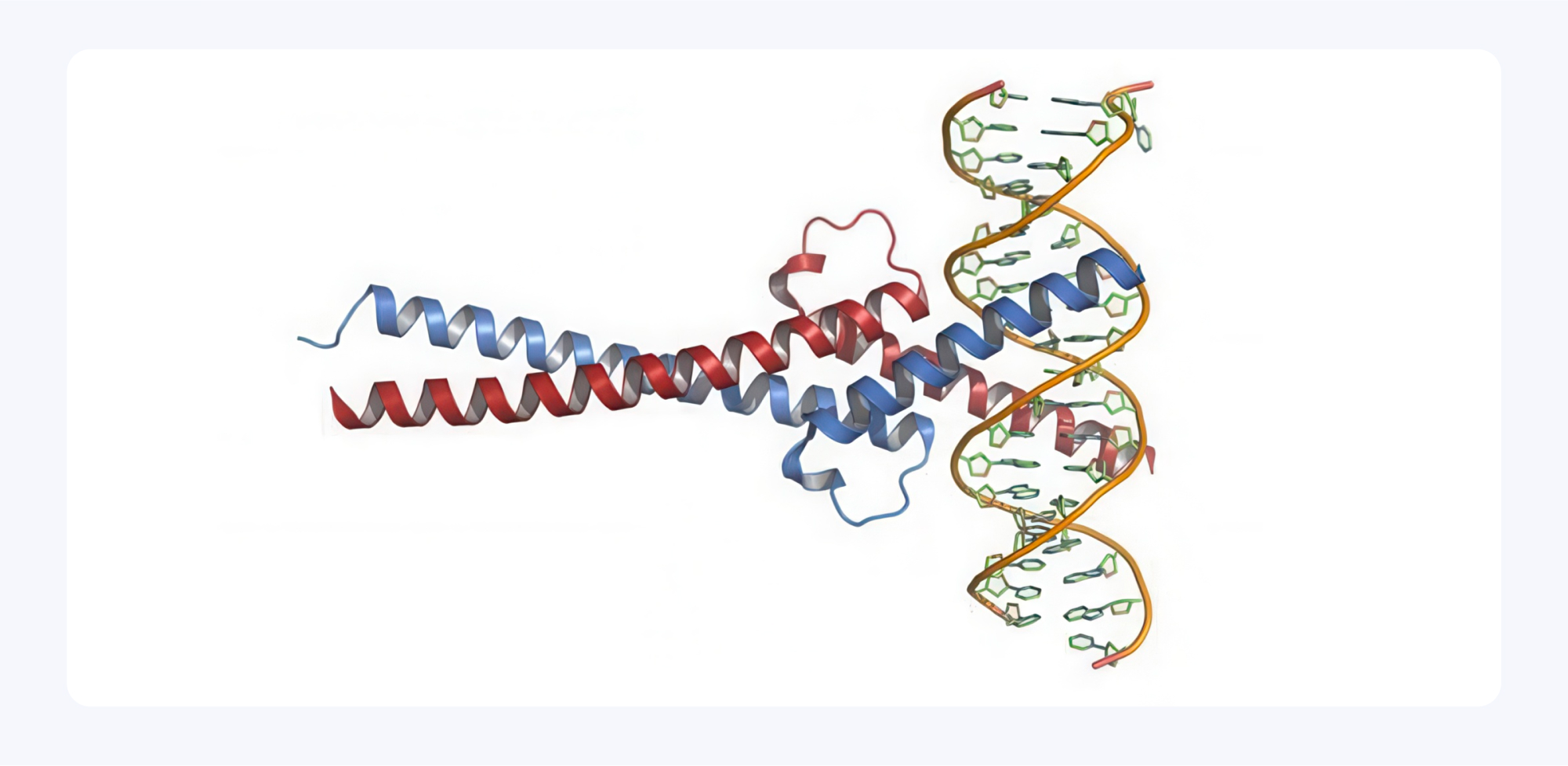
Схема взаимодействия Myc с ДНК. Источник: Википедия
Инновационный подход к лечению рака печени
Одним из наиболее агрессивных и трудноизлечимых онкологических заболеваний считается рак печени — этот вид злокачественного новообразования отличается высокой резистентностью к существующим методам терапии. В поисках новых эффективных мишеней ученые сосредоточились на ферменте ATФ-цитратлиазе (ACLY), который участвует в метаболизме липидов и важных биосинтетических процессах опухолевых клеток. Фишка этого открытия в том, что при поражении печени опухолевые клетки активно используют для своего роста жиры. Если же выборочно «выключить» в печени АТФ-цитратлиазу — один из ключевых ферментов жирового обмена, можно остановить прогрессирование заболевания: по крайней мере на мышиных моделях ингибирование ACLY в гепатоцитах и опухолях уменьшило опухолевые поражения более чем на 70%.
Также в исследовании удалось показать, что подавление активности ACLY не только тормозит рост опухолевых клеток печени, но и стимулирует иммунную систему организма для борьбы со злокачественным новообразованием. Этот двойной эффект стал возможен за счет изменения метаболического профиля клеток и активации противоопухолевых иммунных реакций, что открывает новый путь к созданию комбинированных видов терапии, направленных сразу на несколько аспектов болезни. — ACLY inhibition promotes tumour immunity and suppresses liver cancer.
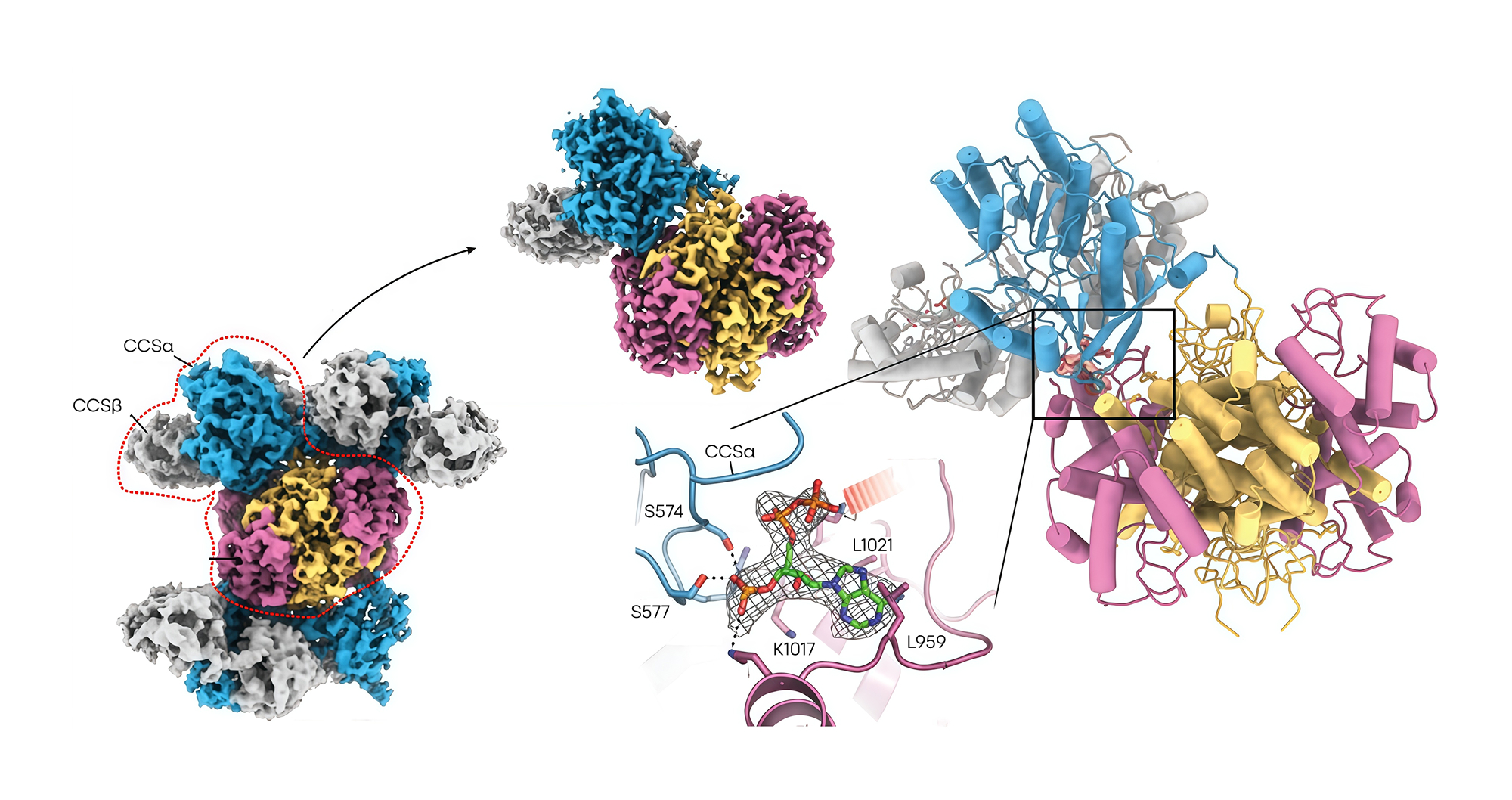
Схема фермента ACLY (слева) и соединения EVT0185 (в центре), которое способно ингибировать фермент ACLY и тем самым уменьшать опухолевые поражения печени. Источник: Nature
«Стволовая» модель для поиска путей лечения агрессивной лейкемии у детей
Одну из форм злокачественных заболеваний крови у детей — острый мегакариобластный лейкоз (AMKL) — вызывает химерный белок CBFA2T3::GLIS2. Эта редкая и крайне агрессивная разновидность рака крови, для которой до сих пор не существует эффективных методов лечения. Болезнь сопровождается нарушением нормального развития кроветворных стволовых клеток, приводящим к быстрому размножению злокачественных предшественников мегакариоцитов.
В новом исследовании ученые создали модель на основе человеческих стволовых клеток, в которой изучили, как белок CBFA2T3::GLIS2 задает две альтернативные судьбы клеток при запуске лейкемии. Анализ показал, что эта онкогенная белковая конструкция нарушает транскрипционное управление и ключевые сигнальные пути, вызывая нарушение регуляции и отклонение развития клеток в сторону опухолевых. Модель воспроизводит особенности болезни у пациентов и позволяет выявлять потенциальные мишени для терапии. Это исследование открывает перспективы для разработки целенаправленных лекарственных средств и улучшения прогноза у детей с тяжелыми формами лейкоза. — A stem cell differentiation model reveals two alternative fates in CBFA2T3::GLIS2-driven acute megakaryoblastic leukemia initiation.
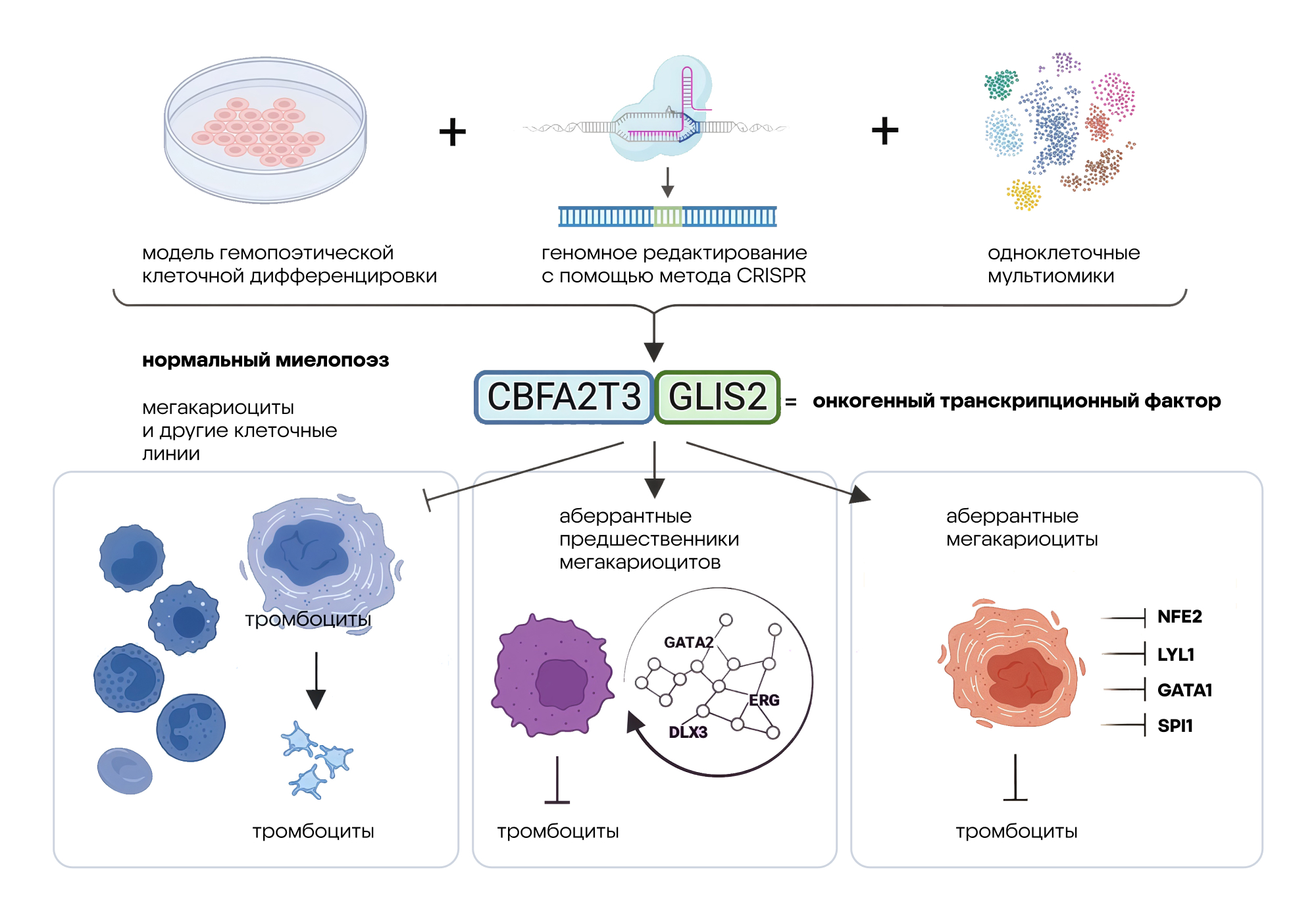
Схема исследования, в котором разработали модель заболевания с использованием генетически модифицированных индуцированных плюрипотентных стволовых клеток человека. Источник: Nature Communications Biology
Новый взгляд на лечение рака пищевода
Плоскоклеточный рак пищевода остается одной из наиболее агрессивных форм онкологических заболеваний, для которой пока что ограничены возможности терапии. Поэтому исследователи стараются раскрыть механизмы иммунных процессов в опухолевом микроокружении, чтобы улучшить эффективность лечения. Вот и в недавно опубликованной статье решили сфокусироваться на этом заболевании, обратившись к изучению третичных лимфоидных структур (tertiary lymphoid structures, TLS). Эти образования формируются в тканях опухоли и состоят из иммунных клеток, включая и T- и B-лимфоциты. Исследователи обнаружили, что ключевым механизмом активации B-клеток в TLS пищевода служит конкурентное связывание белков CD40 и STING с адаптерным белком TRAF2, что приводит к активации транскрипционного фактора IRF4. Эта цепочка событий стимулирует иммунный ответ, направленный против опухолевых клеток.
Новое исследование позволяет глубже понять, как развивается противоопухолевая иммунная реакция в новообразованиях пищевода, и подчеркивает потенциал TLS как целевой структуры для иммунотерапии. Механизмы, выявленные в работе, могут стать основой для новых стратегий усиления иммунного ответа, повышения эффективности существующих методов лечения и персонализированной медицины при раке пищевода. — Characterization of tertiary lymphoid structure identifies competitive binding of CD40 and STING with TRAF2 driving IRF4-mediated B cell activation in esophageal squamous cell carcinoma.
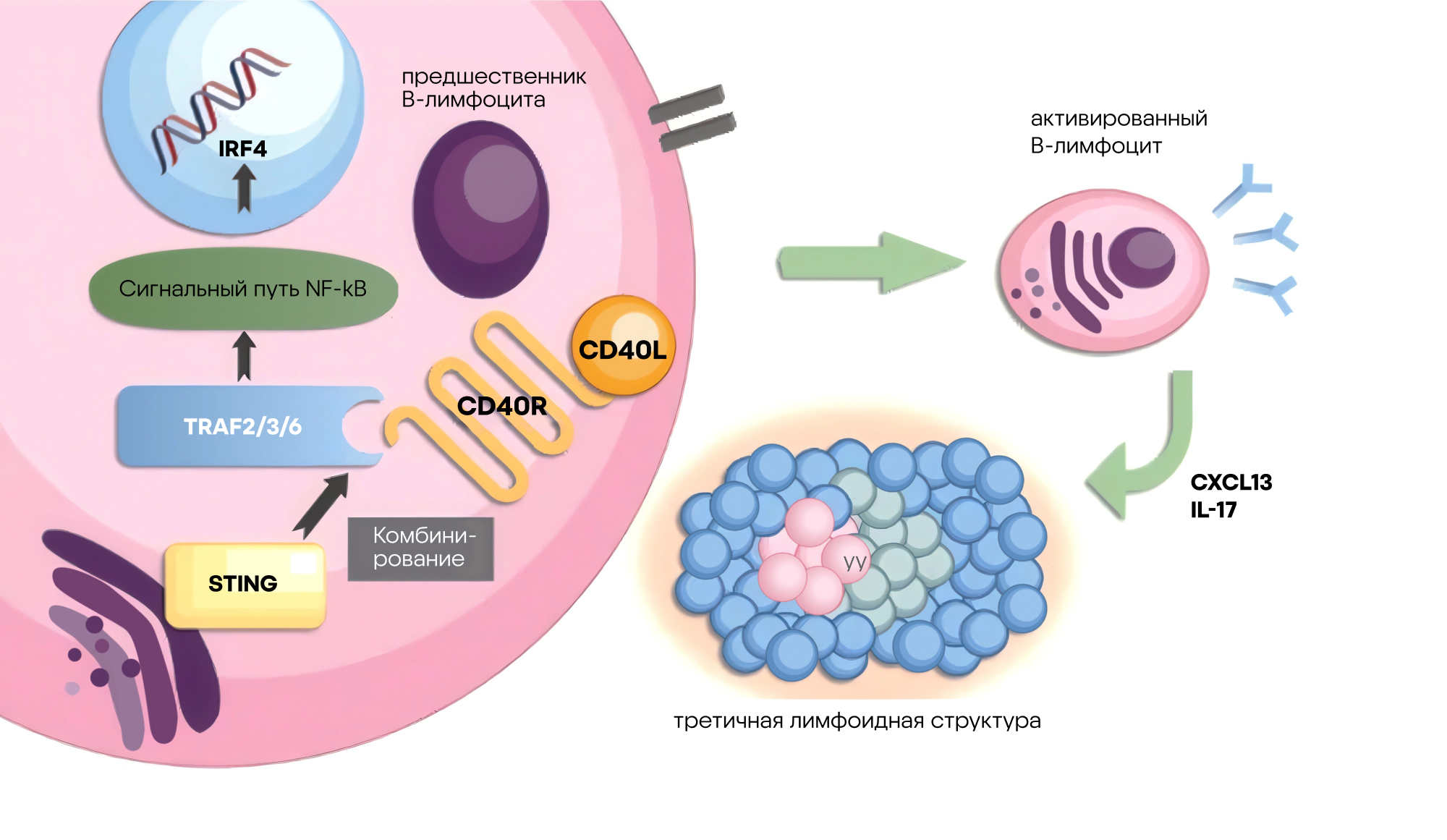
Механизм активации B-лимфоцитов при плоскоклеточном раке пищевода. Источник: Cancer Gene Therapy
Ключ к контролю над раком печени
При гепатоцеллюлярной карциноме — злокачественном поражении печени — зачастую происходят изменения иммунной среды в опухоли. Свою долю осложнений в эту болезнь вносят взаимодействия опухолевых клеток с иммунными клетками, в частности с макрофагами, которые могут приобретать противоопухолевые или, наоборот, поддерживающие опухоль состояния.
В недавнем исследовании ученые выявили комплекс белков NRF2 и SOX4, которые регулируют активность фермента PSPH в клетках гепатоцеллюлярной карциномы. PSPH, в свою очередь, способствует формированию макрофагов типа M2 — подтипа иммунных клеток, способствующих росту опухоли и подавлению иммунного ответа. Авторы показали, что именно через этот механизм комплекс NRF2-SOX4 влияет на микросреду опухоли, усиливая ее прогрессирование. Это открытие подсвечивает потенциальную мишень для терапии рака печени. Вмешательство в работу комплекса NRF2-SOX4 или регуляцию PSPH способно помочь не только замедлить развитие опухоли, но и изменить иммунный ответ, делая лечение более эффективным за счет активации противоопухолевых механизмов организма. — NRF2-SOX4 complex regulates PSPH in hepatocellular carcinoma and modulates M2 macrophage differentiation.
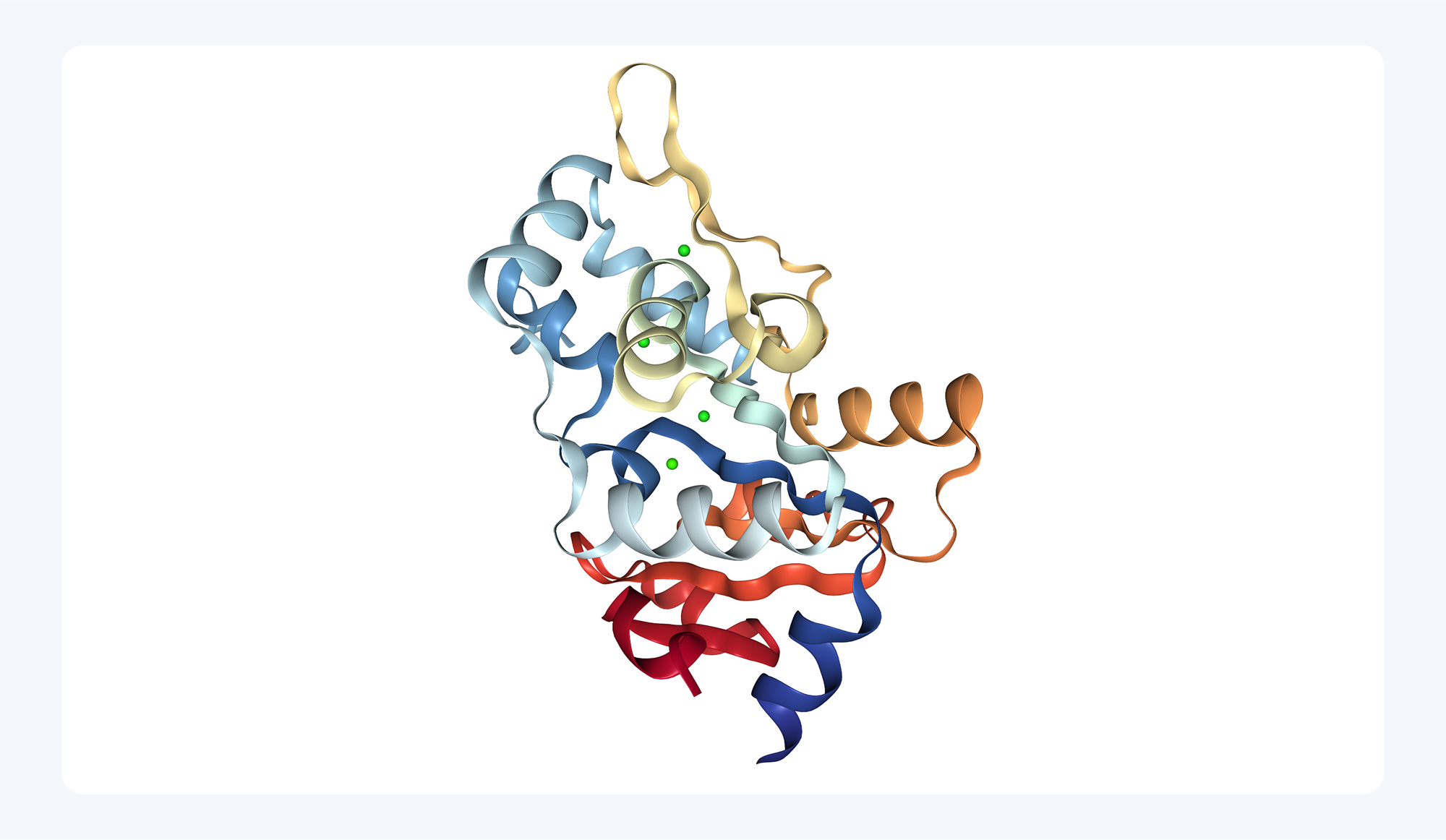
Структура фермента PSPH, который опосредованно участвует в подавлении иммунного ответа при гепатоцеллюлярной карциноме. Источник: Википедия
«Порочный» способ передачи митохондрий
В развитии и прогрессировании злокачественных новообразований важную роль играет не только сам канцероген, запустивший «порочный процесс», но и окружающая его микросреда. Именно она во многом поддерживает рост и выживание опухоли. Одними из ключевых компонентов этой микросреды являются опухоль-ассоциированные фибробласты — клетки, способные влиять на агрессивность опухоли и ее устойчивость к терапии. В недавней работе исследователи решили сосредоточиться на механизмах взаимодействия опухолевых клеток с такими фибробластами, чтобы выявить новые пути их взаимного влияния.
Главным объектом нового исследования стал белок MIRO2, ответственный за передачу митохондрий от опухолевых клеток к фибробластам. Митохондрии — это «энергетические станции» клетки, и их передача изменяет метаболический статус фибробластов, стимулируя их дифференцироваться в опухоль-ассоциированные фибробласты с проопухолевой активностью. Этот механизм запускает сложную цепь событий, способствующую формированию среды, благоприятной для прогрессии опухоли и ее устойчивости к лечению.
Открытие роли MIRO2 в митохондриальной передаче проливает свет на фундаментальные взаимосвязи в опухолевом микроокружении, открывая перспективы для разработки новых терапевтических стратегий. Блокирование этого пути может стать способом ослабить поддержку опухоли со стороны микроокружения, повысить чувствительность новообразований к существующим методам лечения и тем самым улучшить прогноз у пациентов с агрессивными формами рака. — MIRO2-mediated mitochondrial transfer from cancer cells induces cancer-associated fibroblast differentiation.
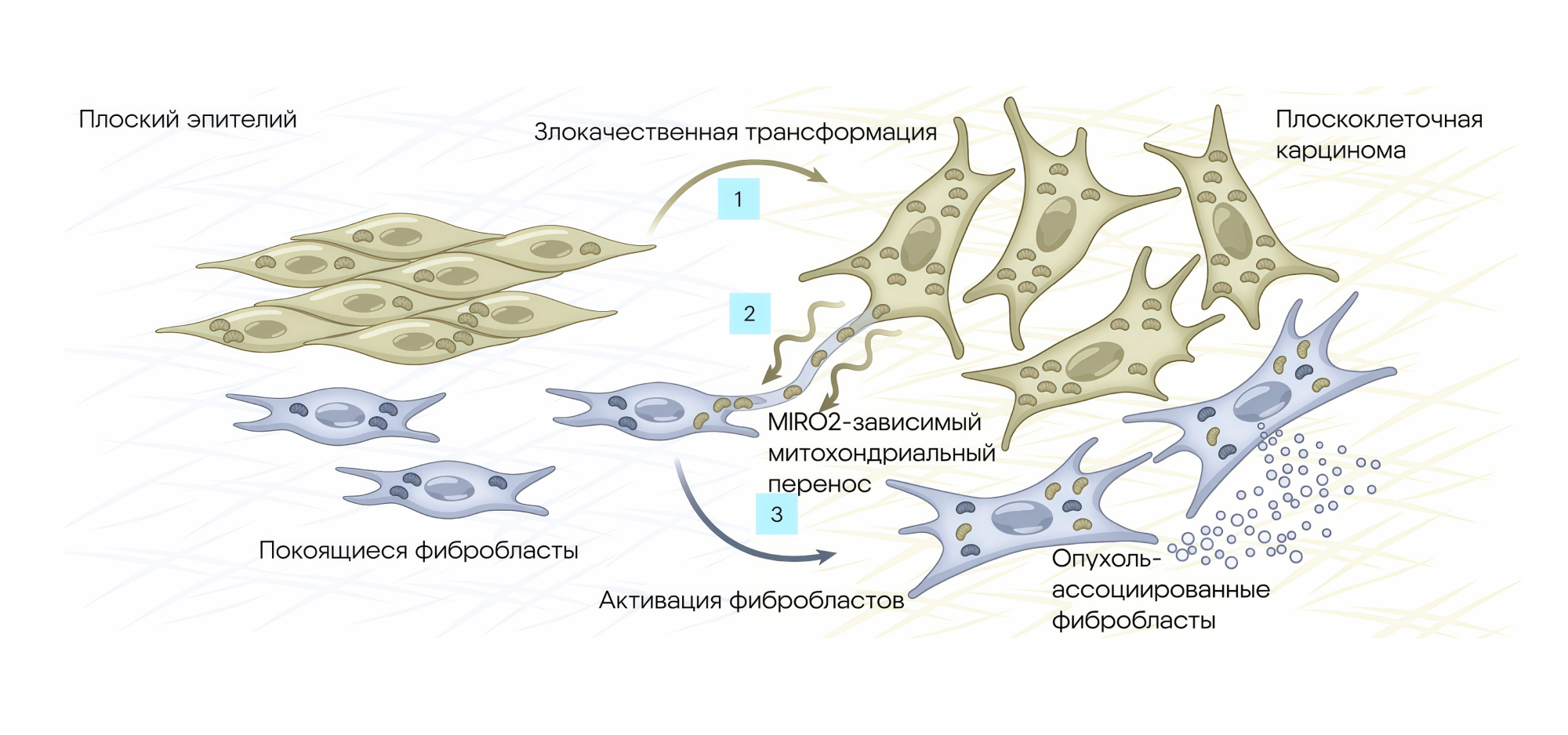
Схема трансформации нормальных клеток в злокачественные под влиянием переноса митохондрий. Источник: Nature Cancer