
Научный дайджест #24: как обойти защиту опухоли пищевода
Опухолевые клетки плоскоклеточного рака пищевода умеют эффективно уклоняться от действия лекарств, создавая сложные механизмы сопротивления. Недавно исследователям удалось нащупать молекулярный «переключатель», который поддерживает выживание и рост опухоли даже при использовании терапевтических препаратов. Блокирование этого уязвимого звена дает надежду на разработку комбинированных видов лечения, способных преодолеть лекарственную устойчивость и улучшить прогноз пациентов с этим агрессивным видом рака. Об этом исследовании, а также о других достижениях в молекулярной онкологии читайте в новом дайджесте!
Как преодолеть резистентность при лечении рака пищевода
Плоскоклеточный рак пищевода — один из наиболее сложных для лечения видов злокачественных новообразований. Сложность терапии во много связана с частыми случаями устойчивости опухоли к современным таргетным препаратам, в частности к ингибиторам рецептора эпидермального фактора роста (EGFR). Новое исследование, опубликованное в British Journal of Cancer, раскрывает молекулярные механизмы этой резистентности и подсвечивает ключевую роль сигнального пути AKT/mTOR в поддержании жизнеспособности опухолевых клеток даже при блокаде EGFR. Биологи из Великобритании с помощью комплексных молекулярно-биологических методов выявили, что именно активация AKT/mTOR становится своеобразным «узлом» для обхода действия EGFR-ингибиторов, позволяя опухоли выживать и прогрессировать, несмотря на терапию.
Эксперименты на клеточных моделях и анализ образцов тканей пациентов показали, что комбинированное воздействие на EGFR и AKT/mTOR приводит к подавлению роста опухоли и преодолению мультимодальной лекарственной устойчивости. Это открытие не только уточняет карту молекулярных взаимодействий в клетках рака пищевода, но и формирует новую стратегию терапии — использование ингибиторов AKT/mTOR в сочетании с EGFR-таргетными препаратами. Такой подход может значительно повысить эффективность лечения и дать шанс пациентам с резистентными формами заболевания, для которых ранее не существовало действенных видов терапии. — AKT/mTOR as a targetable hub to overcome multimodal resistance to EGFR inhibitors in oesophageal squamous cell carcinoma.
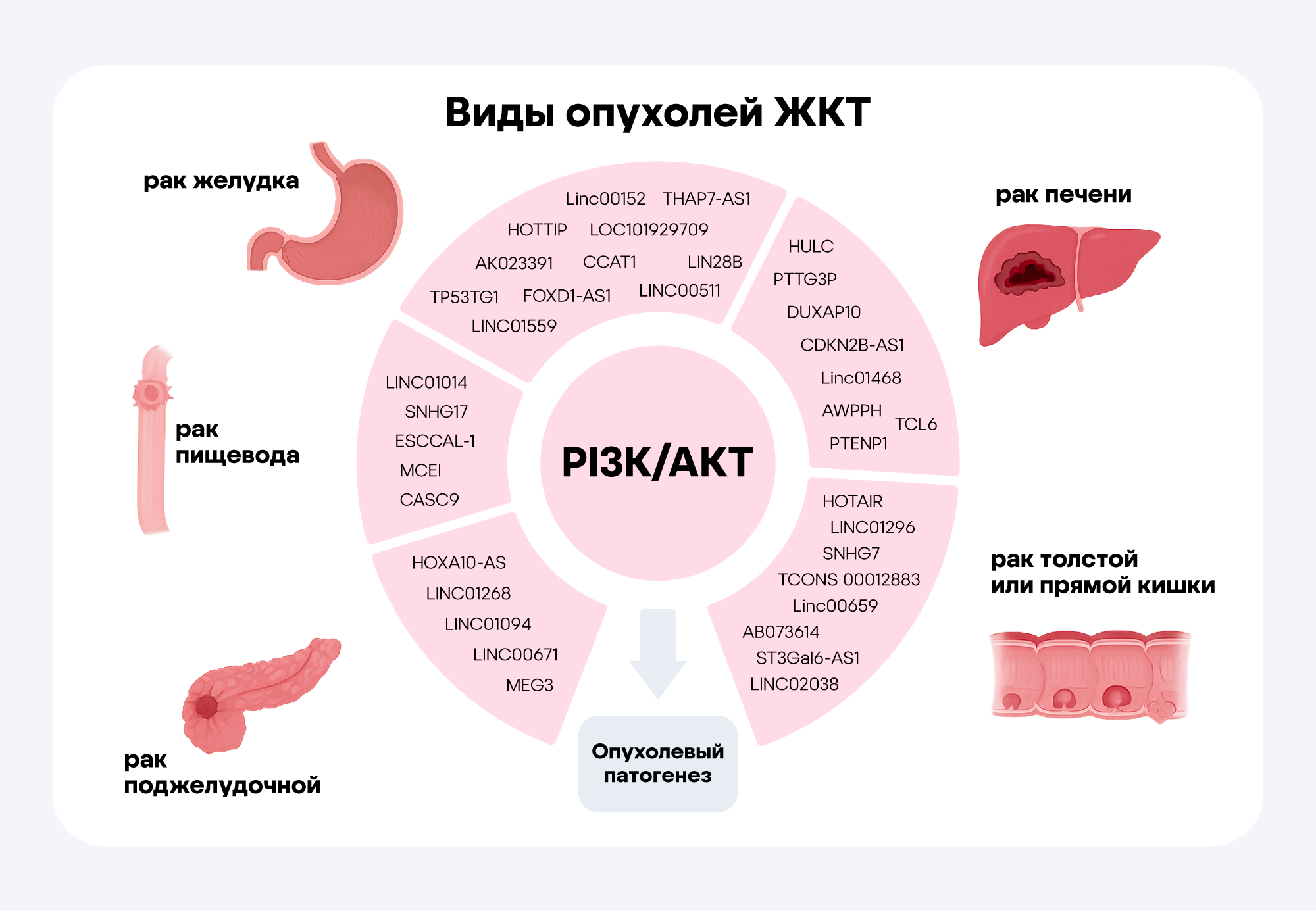
Активация PI3K/Akt/mTOR-сигнального пути часто наблюдается при различных видах злокачественных новообразований, включая опухоли ЖКТ. Мутации и усиленная активность компонентов этого каскада приводят к неконтролируемому росту опухолевых клеток, устойчивости к апоптозу и развитию лекарственной резистентности, что затрудняет лечение. Именно поэтому PI3K, AKT и mTOR считаются перспективными мишенями для таргетной терапии онкологических заболеваний. Источник: адаптировано из ResearchGate
Как управлять регуляцией макрофагов в случае злокачественных новообразований
Хемосенсорные рецепторы — молекулярные регуляторы, которые способны обнаруживать липиды и управлять функциями макрофагов в микроокружении опухоли. Ученые из Италии с помощью современных методов молекулярной биологии на клеточных моделях выявили, что эти рецепторы влияют на поведение иммунных клеток, способствуя либо подавлению, либо активации противоопухолевого ответа.
Обнаружение роли хемосенсорных рецепторов как ключевых регуляторов макрофагов открывает новые перспективы для разработки иммунотерапевтических стратегий в онкологии. Таргетирование этих рецепторов может позволить перенаправить иммунные клетки на эффективное уничтожение опухолевых клеток, что особенно важно в тех случаях, когда традиционные методы лечения оказываются недостаточно результативными. Получается, новое исследование предлагает инновационный подход к модуляции иммунного ответа в опухоли и закладывает основу для создания новых препаратов с высоким терапевтическим потенциалом. — Chemosensor receptors are lipid-detecting regulators of macrophage function in cancer.
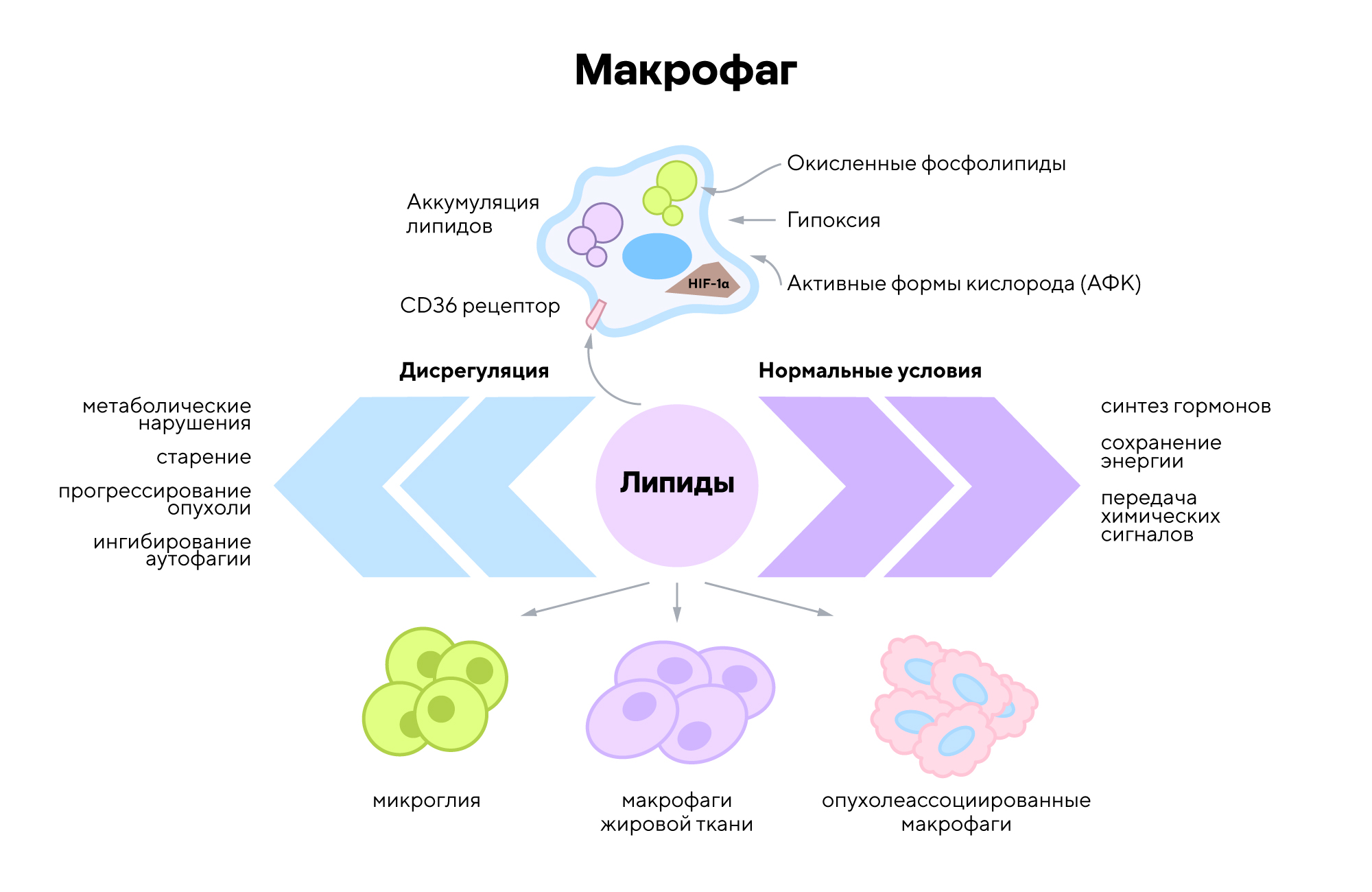
Липиды способны влиять на функциональное состояние макрофагов, способствуя развитию и прогрессии злокачественных новообразований через поддержку опухолевого роста, подавление иммунитета и формирование устойчивости к лечению. Источник: адаптировано из MDPI
Какая новая мишень способна помочь в лечении аденокарциномы легкого
Аденокарцинома легкого — один из самых распространенных и агрессивных видов злокачественных новообразований легких. Недавно в журнале Cancer Gene Therapy опубликовали результаты исследования, которое раскрывает важную роль гена SLC34A2 в подавлении опухолевого роста и прогрессии при этом виде рака. Ученые выяснили, что белок NaPi-IIb, кодируемый SLC34A2 и экспрессируемый в альвеолярных эпителиальных клетках II типа (AT2), значительно снижен в опухолевых тканях по сравнению с нормальными. Молекулярный анализ показал, что SLC34A2 активирует цепочку сигнальных молекул LRRK2, TTF-1 и SELENBP1, что приводит к подавлению ключевых онкогенных путей MEK/ERK и PI3K/AKT/mTOR, ответственных за рост и метастазирование раковых клеток.
Этот механизм представляет собой новый взгляд на молекулярные процессы, лежащие в основе злокачественной трансформации AT2-клеток в аденокарциному легкого. Открытие этого сигнального пути не только расширяет понимание биологии опухоли, но и открывает перспективы для разработки таргетных терапевтических стратегий, направленных на восстановление функции SLC34A2 или модуляцию связанных с ней сигнальных путей. Такой подход может стать основой для создания новых лекарственных средств, способных эффективно замедлять прогрессирование рака легкого и улучшать прогноз пациентов. — SLC34A2 inhibits tumorigenesis and progression via upregulating LRRK2/TTF-1/SELENBP1 axis in lung adenocarcinoma.
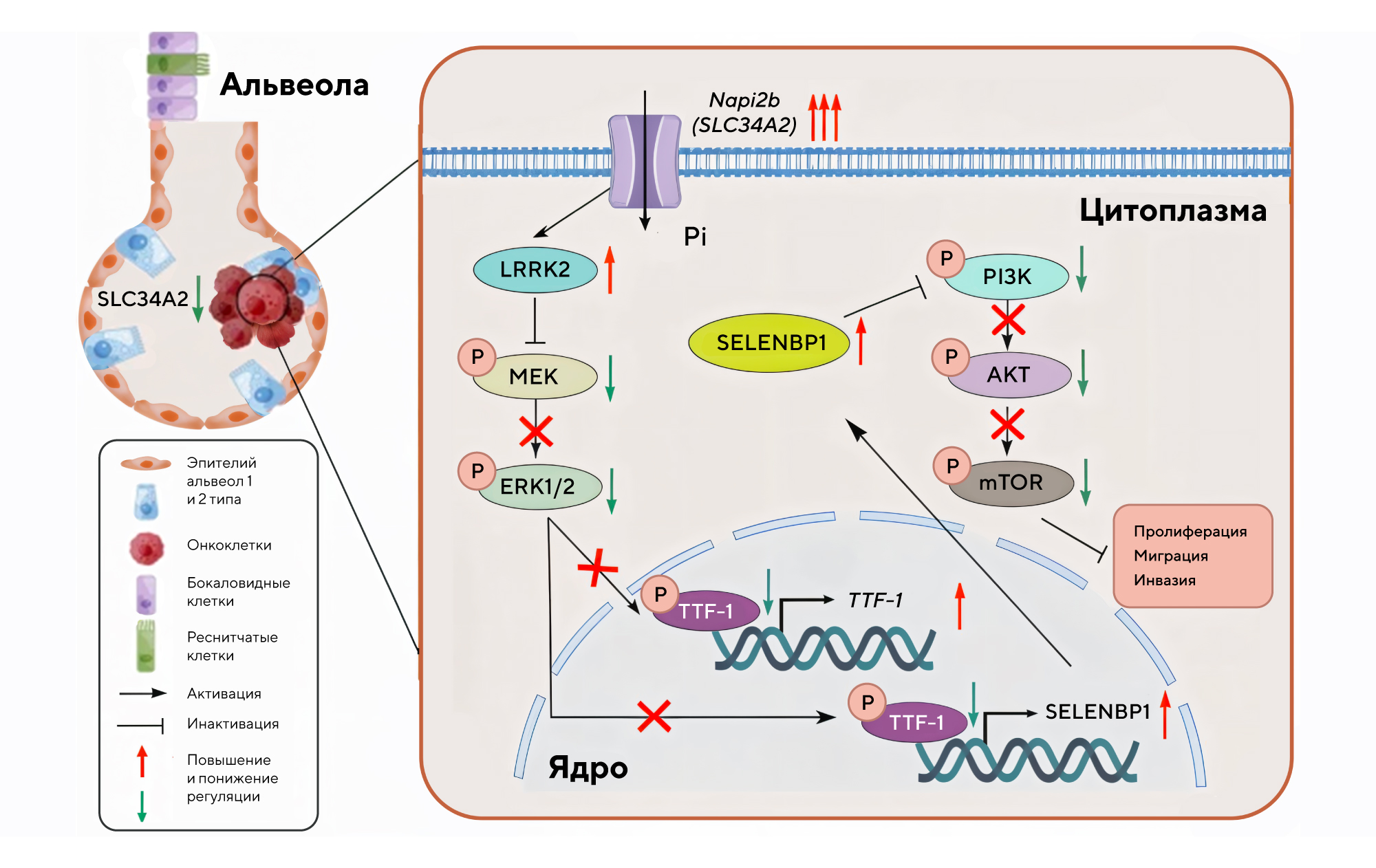
Сверхэкспрессия гена SLC34A2 может ингибировать активацию сигнального пути MEK/ERK, а затем подавлять экспрессию p-TTF-1(Ser327), который опосредованно повышает экспрессию SELENBP1 за счет регулирования транскрипционной активности TTF-1. Источник: адаптировано из Cancer Gene Therapy
Что позволит улучшить терапию при раке молочной железы: новый взгляд на взаимодействие T-лимфоцитов и макрофагов
Рак молочной железы с положительным гормональным статусом и отсутствием рецептора HER2 (HR+HER2−) часто лечат ингибиторами CDK4/CDK6, однако у многих пациентов развивается резистентность к этим препаратам. В недавнем исследовании выявили ключевую роль IL-17A-секретирующих γδ T-лимфоцитов в формировании этой устойчивости. Используя современные методы молекулярной биологии, ученые показали, что эти специфические иммунные клетки взаимодействуют с CX3CR1+ макрофагами, создавая микросреду, способствующую выживанию опухолевых клеток, несмотря на терапию.
Это открытие подчеркивает важность сложных межклеточных коммуникаций в опухолевом микроокружении и открывает новые перспективы для разработки комбинированных терапий. Блокирование сигнальных путей, связанных с IL-17A и CX3CR1+ макрофагами, может повысить эффективность CDK4/CDK6-ингибиторов и преодолеть терапевтическую резистентность. Таким образом, результаты исследования расширяют понимание механизмов устойчивости к лечению, а также предлагают потенциальные мишени для создания новых лекарств, способных улучшить прогноз пациентов с HR+HER2− раком молочной железы. — IL-17A-secreting γδ T cells promote resistance to CDK4/CDK6 inhibitors in HR+HER2− breast cancer via CX3CR1+ macrophages.
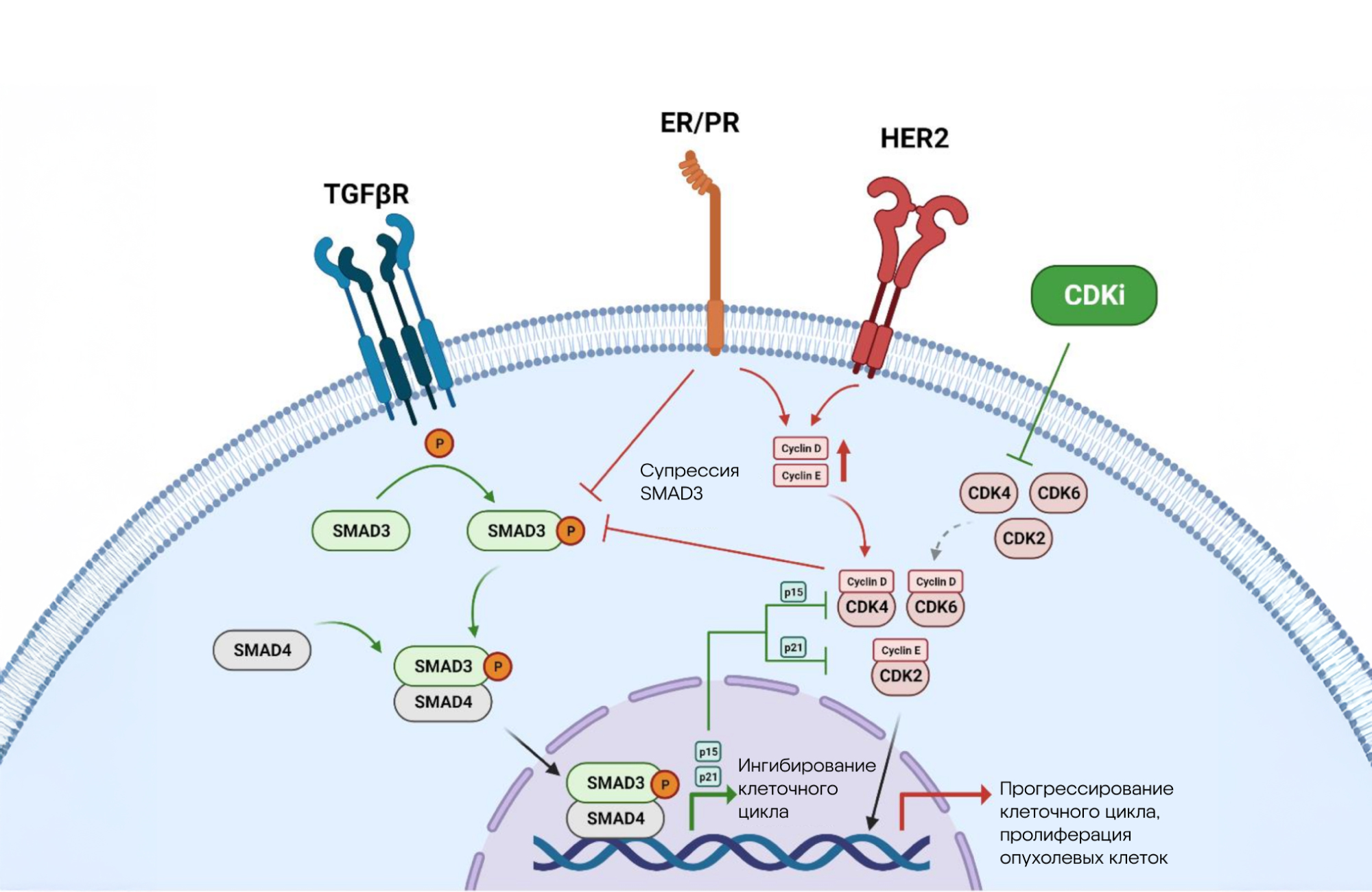
Взаимосвязи сигнальных путей онкогенной активации CDK и TGFβ. Источник: адаптировано из MDPI
Как «предсказать» стратегию лечения ревматоидного артрита
Ревматоидный артрит — хроническое аутоиммунное заболевание, при котором иммунная система атакует собственные ткани суставов, вызывая их воспаление и разрушение. Несмотря на существование эффективных биологических препаратов, около 40% пациентов не отвечают на лечение. При этом точные и надежные биомаркеры для выбора терапии долгое время не были известны. В недавнем исследовании STRAP ученые провели глубокий молекулярный анализ синовиальных биопсий — образцов ткани из воспаленных суставов — у пациентов с ревматоидным артритом, чтобы выявить генетические «подписи», предсказывающие ответ на три широко используемых для лечения этой болезни препарата: этанерцепт, тоцилизумаб и ритуксимаб. Эти лекарства имеют разные механизмы действия: они блокируют фактор некроза опухоли (TNF), интерлейкин 6 и В-лимфоциты соответственно. В исследовании удалось сравнить, как молекулярный профиль синовиальных образцов влияет на эффективность каждого из препаратов.
Для анализа применили секвенирование РНК и методы машинного обучения, которые помогли выделить наборы генов, ассоциированные с хорошим ответом на конкретный препарат. Такой подход позволил создать предиктивные модели с точностью до 85%, что подтверждено на независимых когортах пациентов. Сравнение этанерцепта, тоцилизумаба и ритуксимаба было важно, поскольку эти препараты нацелены на разные иммунные пути, а понимание молекулярных особенностей поврежденных суставов помогает подобрать наиболее эффективное лечение для каждого пациента. Открытие имеет большой терапевтический потенциал — оно приближает персонализированную медицину в ревматологии, позволяя заранее прогнозировать, какой биологический препарат будет наиболее результативным, и избегать неоправданных побочных эффектов и затрат на неэффективную терапию. — Deep molecular profiling of synovial biopsies in the STRAP trial identifies signatures predictive of treatment response to biologic therapies in rheumatoid arthritis.
Этанерцепт, тоцилизумаб и ритуксимаб — три различных биологических препарата с разными механизмами действия, которые применяются для лечения ревматоидного артрита. Этанерцепт является ингибитором фактора некроза опухоли (ФНО), который блокирует его связывание с рецепторами на поверхности клеток и тем самым снижает воспаление. Тоцилизумаб — моноклональное антитело, направленное против рецептора интерлейкина 6 (IL-6R) и подавляющее провоспалительные сигналы, связанные с IL-6. Ритуксимаб — моноклональное антитело, нацеленное на антиген CD20 на В-лимфоцитах, которое вызывает их уничтожение и снижает аутоиммунную активность. Сравнение этих трех препаратов в исследовании STRAP позволило выявить молекулярные подписи в синовиальной ткани, которые предсказывают, какой именно биологический препарат будет наиболее эффективен для конкретного пациента. Источник: адаптировано из Nature Reviews Rheumatology