
Научный дайджест #21: Как «общаются» клетки опухоли
Окружение определяет наше существование — этой фразой можно описать и клеточные взаимодействия. Все клетки организма не существуют сами по себе, а во многом зависят от создаваемой ими тканевой среды. Так, специализированные клетки дифференцируются из стволовых клеток-предшественниц: попадая в конкретную микросреду, клетка словно подстраивается под свое окружение. К сожалению, это же справедливо и для случаев злокачественных новообразований: состав микроокружения опухоли может влиять на процессы онкогенеза, способствуя образованию все новых опухолевых клеток. Но процессами, связанными со способностью опухоли к генерации все новых опухолевых колоний, можно попытаться управлять — по крайней мере это отчасти получилось сделать исследователям из Южной Кореи. О том, что у них получилось, а также о других новостях из мира молекулярной онкологии — читайте в новом дайджесте.
Мощный ингибитор может улучшить эффективность терапии при раке яичников
Метилирование аденозина в положении N6 (m6A, N6-methyladenosine methylation) под действием фермента деметилазы — довольно стандартный механизм, который снижает время полужизни РНК. Ранее уже были получены сведения о возможном участии деметилазы m6A в прогрессировании опухолей при раке яичников, однако надежных подтверждений того, как это происходит, не было. Чтобы лучше разобраться в этом молекулярном сценарии, ученые из Китая изучили экспрессию гена ALKBH5, кодирующего деметилазу, а также проанализировали уровень m6A у пациенток с раком яичников. Выяснилось, что при такой разновидности злокачественной опухоли повышается экспрессия ALKBH5, что в конечном итоге поддерживает жизнеспособность клеток опухоли. Чтобы лучше понять, как можно заблокировать негативный сценарий злокачественного перерождения клеток яичников, ученые «выключили» ген ALKBH5 с помощью метода CRISPR/Cas9. В результате удалось значительно снизить уровень m6A и ингибировать жизнеспособность, пролиферацию и возможность к миграции у опухолевых клеток. Правда, пока что этот успех удалось воспроизвести только на клеточных моделях рака яичников — что, впрочем, не снижает значимости этой потенциальной мишени для лечения злокачественных новообразований. — ALKBH5-mediated m6A regulates the alternative splicing events of SRSF10 in ovarian cancer.
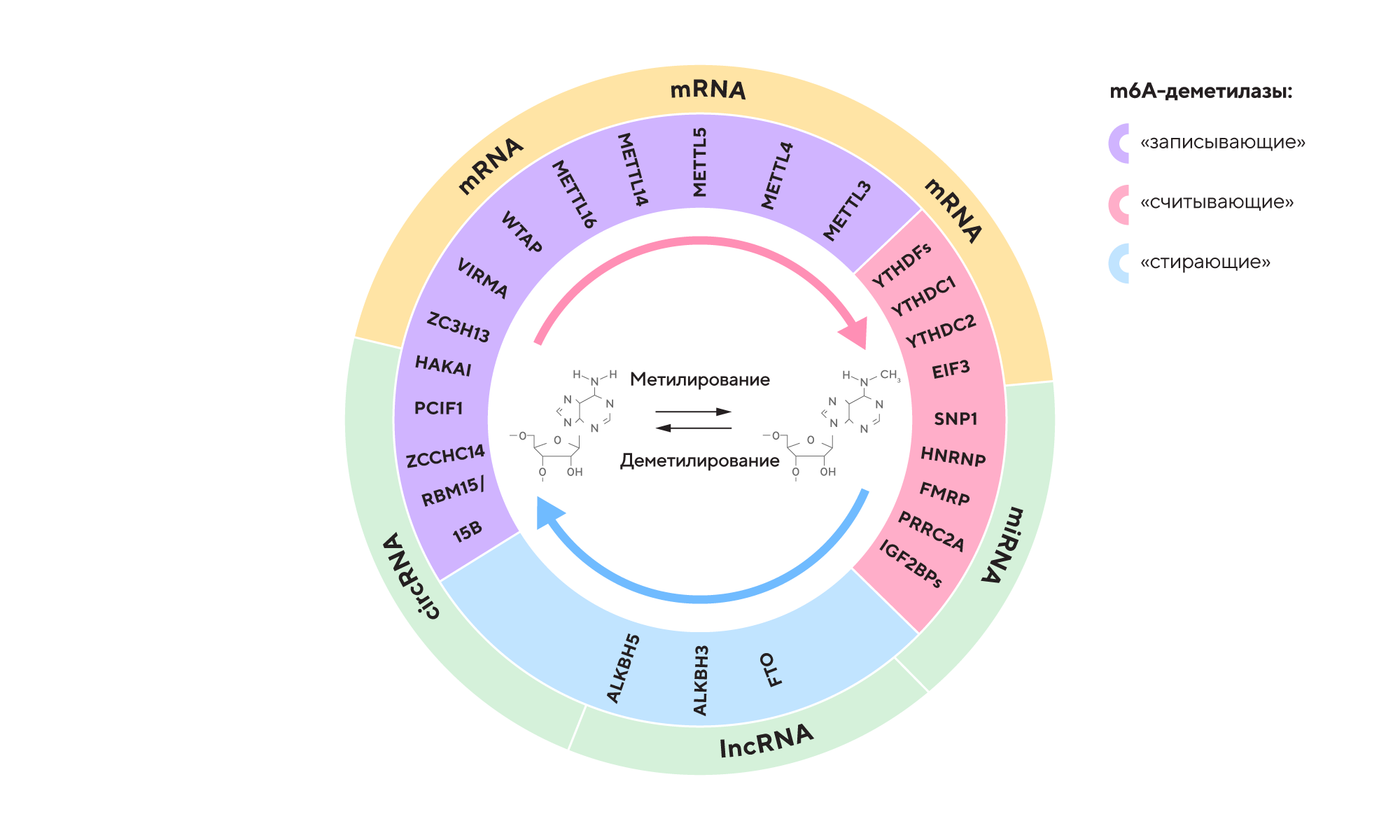
Обратимое метилирование и деметилирование мРНК — модификация N6-метиладенозина (m6A) — регулируются разными ферментами: «записывающими» m6A-метилтрансферазами, «стирающими» m6A-деметилазами и «считывающими» m6A-связывающими белками. Эти регуляторы распознают, добавляют или удаляют сайты, модифицированные m6A, соответствующим образом изменяя биологические процессы. Источник: адаптировано из MDPI
Обнаружен потенциальный онкоген, связанный с раком поджелудочной
Рак поджелудочной железы считается одним из самых агрессивных видов злокачественных новообразований, связанных с низкой выживаемостью и высокой частотой рецидивов. Одно из основных препятствий, усложняющих терапию этого заболевания, — частое развитие резистентности опухоли к действию химиотерапевтических препаратов, в частности к гемцитабину. Устойчивость опухоли связана с несколькими факторами, среди которых — высокая способность опухолевых клеток к пролиферации. Причем непонятно, из-за чего возникает разрастание опухоли. Недавно ученым из Южной Кореи удалось отчасти пролить свет на этот вопрос: они обнаружили, что устойчивые к химиотерапии виды рака поджелудочной ассоциированы с повышенной экспрессией одного из факторов транскрипции — Forkhead Box P1 (FOXP1). Подавление гена FOXP1 снижало экспрессию других генов, связанных со стволовостью опухолевых клеток, а также ингибировало развитие опухолевых колоний. Эти данные подсвечивают важность FOXP1 как потенциальной терапевтической мишени для лечения рака поджелудочной железы. — The FOXP1-ABCG2 axis promotes the proliferation of cancer stem cells and induces chemoresistance in pancreatic cancer.
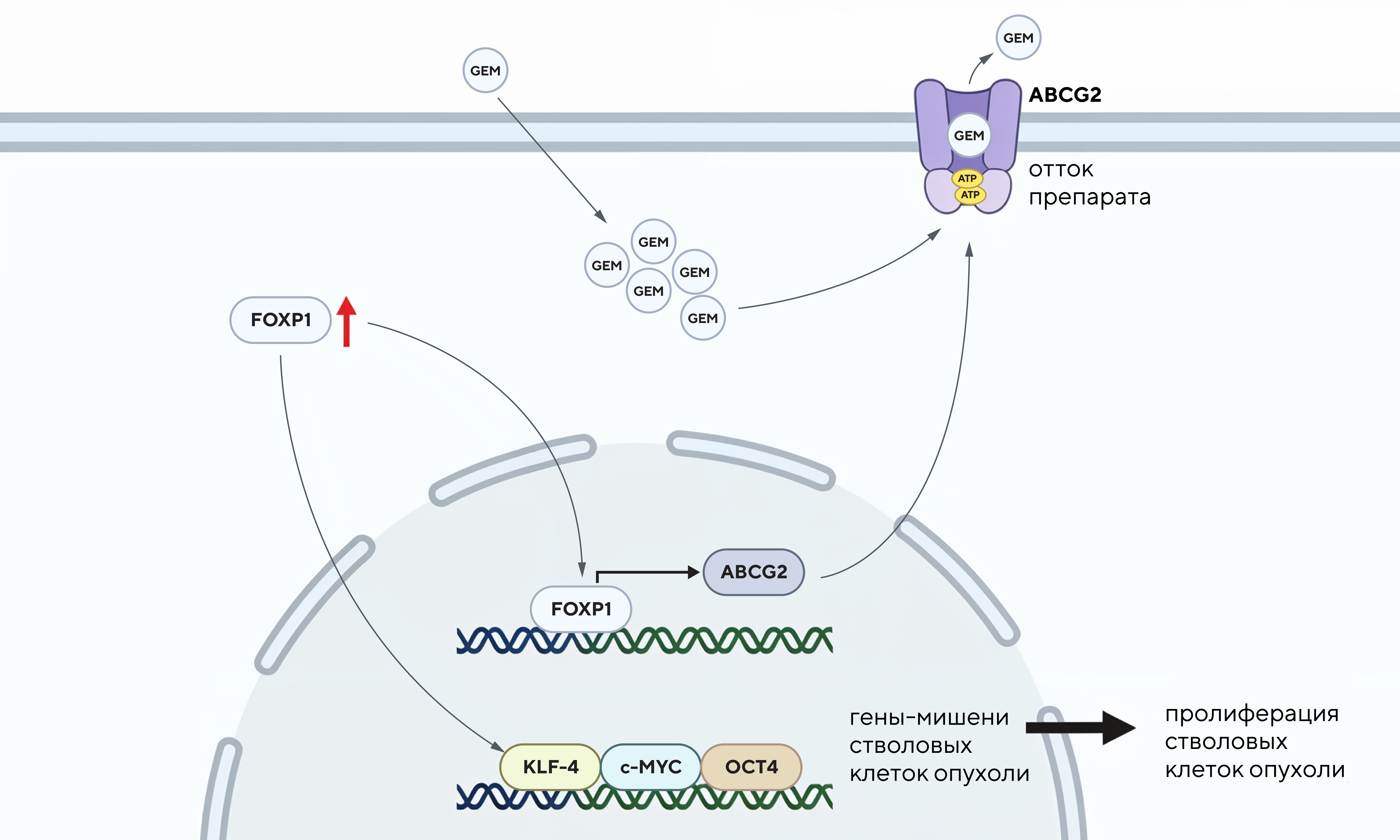
При гемцитабин-устойчивой разновидности рака поджелудочной повышается экспрессия гена FOXP1, что, в свою очередь, способствует пролиферации стволовых клеток и дальнейшему разрастанию опухоли. Но этим дело не заканчивается: также повышенная экспрессия FOXP1 регулирует экспрессию другого гена, ABCG2, кодирующего АТФ-связывающий кассетный белок ABCG2, — и в его присутствии на поверхности мембраны происходит отток гемцитабина. Источник: Nature Cancer Gene Therapy
Идентифицирована потенциальная мишень для терапии рака молочной железы
Высокоагрессивные виды рака молочной железы (РМЖ) имеют не так много терапевтических молекулярных мишеней, поэтому поиск новых молекулярных участников при развитии этого злокачественного новообразования остается очень актуальным. Чтобы лучше разобраться в ключевых механизмах онкогенеза при раке молочной железы, ученые из Японии исследовали способы регуляции транскрипционного фактора NF-κB. Нарушения в регуляции NF-κB могут провоцировать воспалительные и аутоиммунные заболевания, а также участвовать в развитии злокачественных новообразований, в том числе РМЖ. Исследования, проведенные на 35 клеточных линиях рака молочной железы человека, показали важную роль белка Tob из семейства антипролиферативных белков Tob/BTG. Экспрессия гена, кодирующего этот белок, отрицательно коррелирует с активностью NF-κB. Это означает, что белок Tob подавляет активацию NF-κB, а следовательно, снижает вероятность запуска патогенных процессов. Молекулярный сценарий этого взаимодействия между Tob и NF-κB выглядит так: белок Tob ассоциируется с комплексом I рецептора TNF и ингибирует полиубиквитилирование белка RIPK1, что предотвращает чрезмерную активацию NF-κB. Полученные результаты могут стать основой для разработки новых препаратов для терапии высокоагрессивных видов рака молочной железы. — Tob negatively regulates NF-κB activation in breast cancer through its association with the TNF receptor complex.
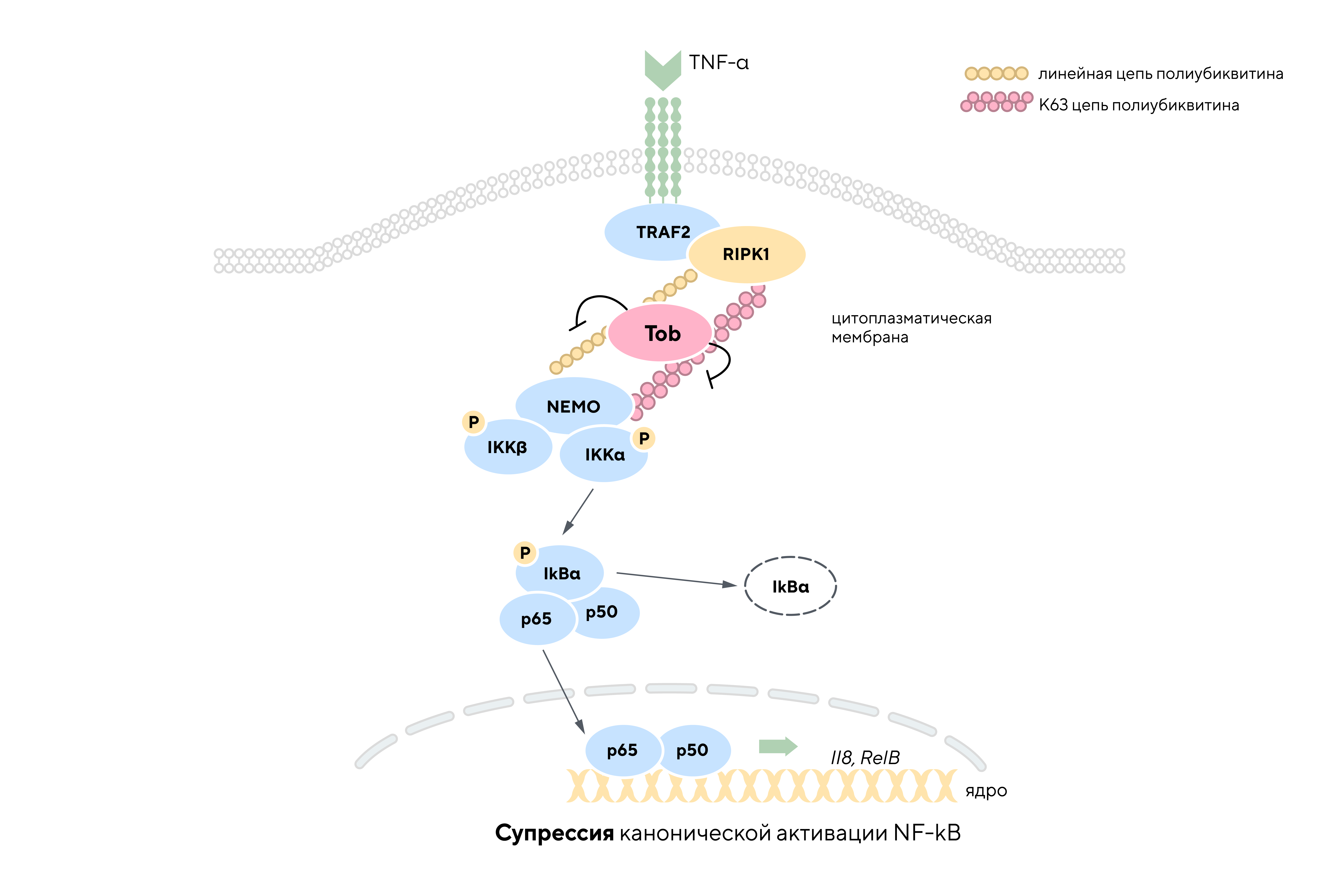
Белок Tob взаимодействует с полиубиквитиновыми цепями, регулируя сигнализацию NF-κB. Это происходит за счет того, что Tob связывается с RIPK1 и NEMO, тем самым ингибируя передачу сигнала TNF-α в клетках рака молочной железы. Источник: Nature Cancer Gene Therapy
Потенциальный молекулярный механизм ингибирования способен помочь в лечении рака поджелудочной
Важную роль в процессе регуляции белков играют посттрансляционные модификации, способные во многом определять белковые функции. Одна из таких модификаций — O-GlcNAc (от O-linked β-N-acetylglucosamine), которая может происходить при сворачивании большой субъединицы фермента рибонуклеотидредуктазы M1 (RRM1) в позиции 734 и влиять на трансформацию клеток поджелудочной железы. Чтобы лучше разобраться, как это молекулярное превращение влияет на развитие и прогрессирование злокачественного новообразования, ученые из Тайваня изучили клеточные линии с мутацией PANC-1 — в таких клетках поджелудочной были минимизированы посттрансляционные модификации O-GlcNAc. Выяснилось, что в случае мутации происходит повышенное повреждение ДНК, а также задержка роста опухолевых клеток. Более того, снижение уровня модификации O-GlcNA увеличивает чувствительность опухолевых клеток поджелудочной железы к гемцитабину — и это открывает перспективы для улучшения терапии при этом виде злокачественного заболевания. — RRM1 O-GlcNAcylation inhibition suppresses pancreatic cancer via TK1-mediated replication stress.
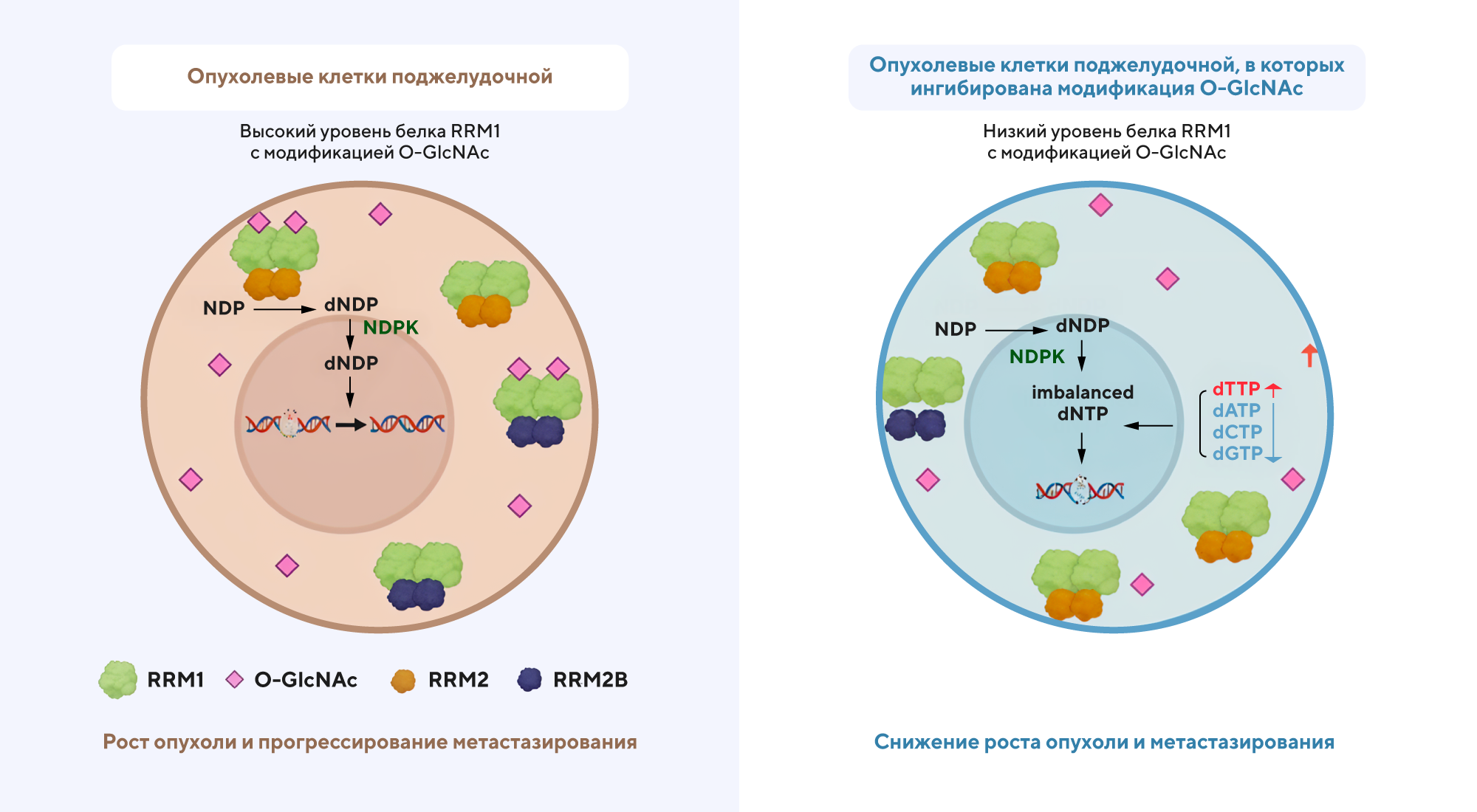
Посттрансляционная модификация O-GlcNAс в белке RRM1 в позиции T734 играет ключевую роль в развитии злокачественной разновидности рака поджелудочной железы. Источник: Nature Cancer Gene Therapy
Обнаружена перспективная мишень для терапии рака головы и шеи
Большинство видов злокачественных новообразований головы и шеи представляют собой плоскоклеточные карциномы. Эта разновидность онкологического заболевания опасна высоким риском развития рецидивов среди пациентов, которые получают химиотерапию препаратами на основе платины. Чтобы разрабатывать новые способы борьбы с этим видом рака, важно хорошее понимание молекулярной основы химиорезистентности. И кажется, что в этом вопросе есть просвет — по крайней мере, если судить по результатам недавнего исследования ученых из Греции. Выяснилось, что при плоскоклеточном раке головы и шеи в ряде устойчивых к терапии опухолей сверхэкспрессируется ген HRAS дикого типа (wtHRASov) — и это способствует эксцизионной репарации нуклеотидов в опухолевых клетках. Если же ингибировать HRAS в опухолях, значительно снижается уровень репарации — и уже благодаря такому эффекту опухолевые клетки повторно становятся чувствительными к химиотерапии препаратами на основе платины. — Regulation of nucleotide excision repair by wild-type HRAS signaling in head and neck cancer.
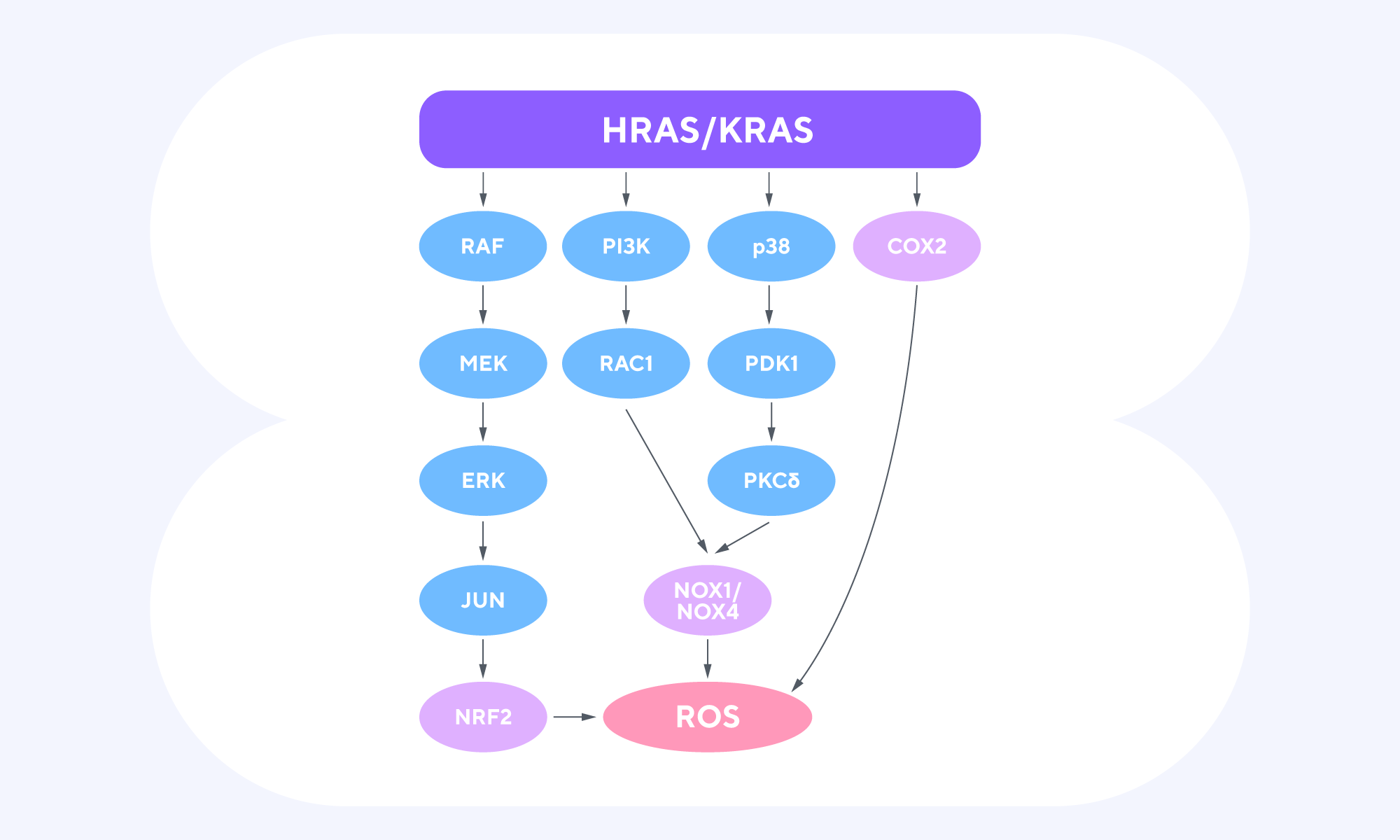
Онкогены HRAS и CRAS вовлечены во многие сигнальные пути, способствуя процессам канцерогенеза. Источник: Frontiersin