
Дайджест #4. Не такой простой кишечный микробиом, митохондриальная ДНК и снова мыши
Одно из исследований, о котором расскажем в новом дайджесте, — исследование микробиома. Эта тема часто возникает среди новостей в ведущих научных журналах, и порой кажется, что состав микроорганизмов в кишечнике человека определяет чуть ли не большую часть аспектов здоровья. В этот раз новостью стала связь между составом кишечного микробиома и фебрильной нейтропенией — осложнением, которое развивается после трансплантации гемопоэтических стволовых клеток. О том, как это происходит и можно ли на это повлиять, читайте в новом дайджесте.
Онкология
Новый ингибитор для улучшения лечения резистентной меланомы
Несмотря на разработку новых иммунных чекпоинтов, лечение рака у пациентов не всегда оказывается успешным. Один из возможных вариантов улучшения ответа на терапию — повышение чувствительности резистентных опухолей, чтобы воздействовать на них лекарственными препаратами. В новом исследовании удалось идентифицировать один из возможных агентов — Mi-2β, который участвует в регуляции иммунного противоопухолевого ответа при меланоме. Анализ ATAC-seq показал: эффектор Mi-2β контролирует доступность генов, стимулируемых IFN-γ, что в конечном счете снижает ответ на терапию с использованием иммунных чекпоинтов. Пока что эксперименты проводили только на мышах in vivo, и результаты продемонстрировали взаимосвязь между потерей Mi-2β и улучшением иммунного ответа. Также исследователям удалось разработать ингибитор Z36-MP5, который снижает активность Mi-2β и индуцирует ответ на ингибиторы иммунных чекпоинтов. Новый ингибитор потенциально способен повысить чувствительность меланом, устойчивых к иммунотерапии, для более эффективного лечения. — Mi-2β promotes immune evasion in melanoma by activating EZH2 methylation.
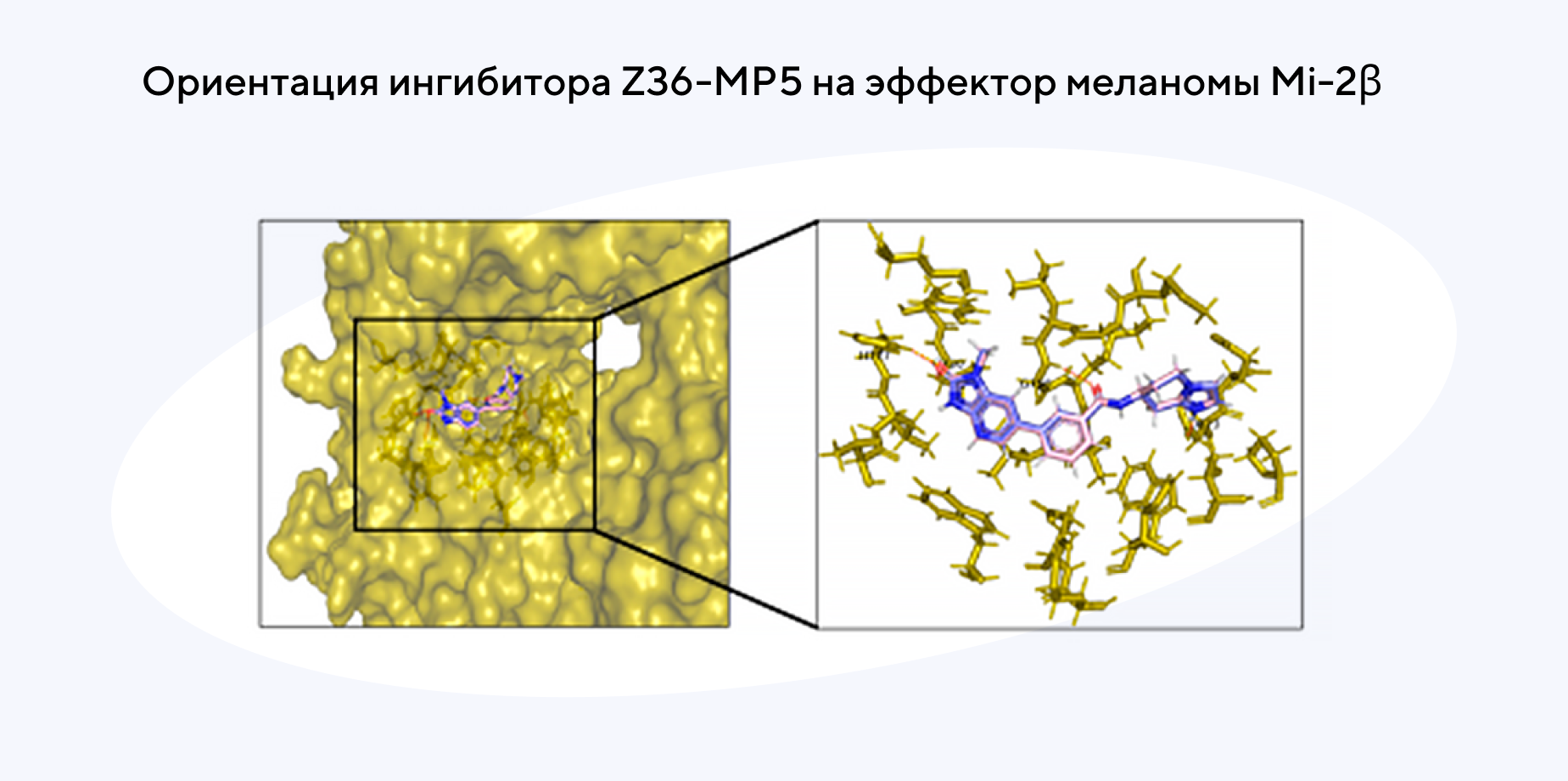
Источник: адаптировано из Nature Communications
Роль кишечного микробиома в развитии фебрильной нейтропении
Микробиом кишечника у детей с онкологией, которых готовят к трансплантации гемопоэтических стволовых клеток, играет важную роль в фебрильной нейтропении. Так, при нарушении естественного микробиома изменяется состав микроорганизмов, в числе которых могут оказаться патогены и бактерии, несущие гены устойчивости к антибиотикам. В новом исследовании более детально изучили влияние кишечного микробиома у 18 детей, которые перенесли трансплантацию гемопоэтических стволовых клеток, — в их числе были и 12 пациентов с развившейся фебрильной нейтропенией. Состав микробиома исследовали во время трех периодов: до трансплантации стволовых клеток, через неделю и через четыре недели после трансплантации. В результате уже через неделю обнаружилось значительное снижение разнообразия микробиологической популяции и появление девяти генов устойчивости к антибиотикам. Это подтверждает гипотезу о важной роли кишечного микробиома: чем разнообразнее и устойчивее его состав после трансплантации гемопоэтических стволовых клеток, тем лучше исход фебрильной нейтропении. — Gut diversity and the resistome as biomarkers of febrile neutropenia outcome in paediatric oncology patients undergoing hematopoietic stem cell transplantation.
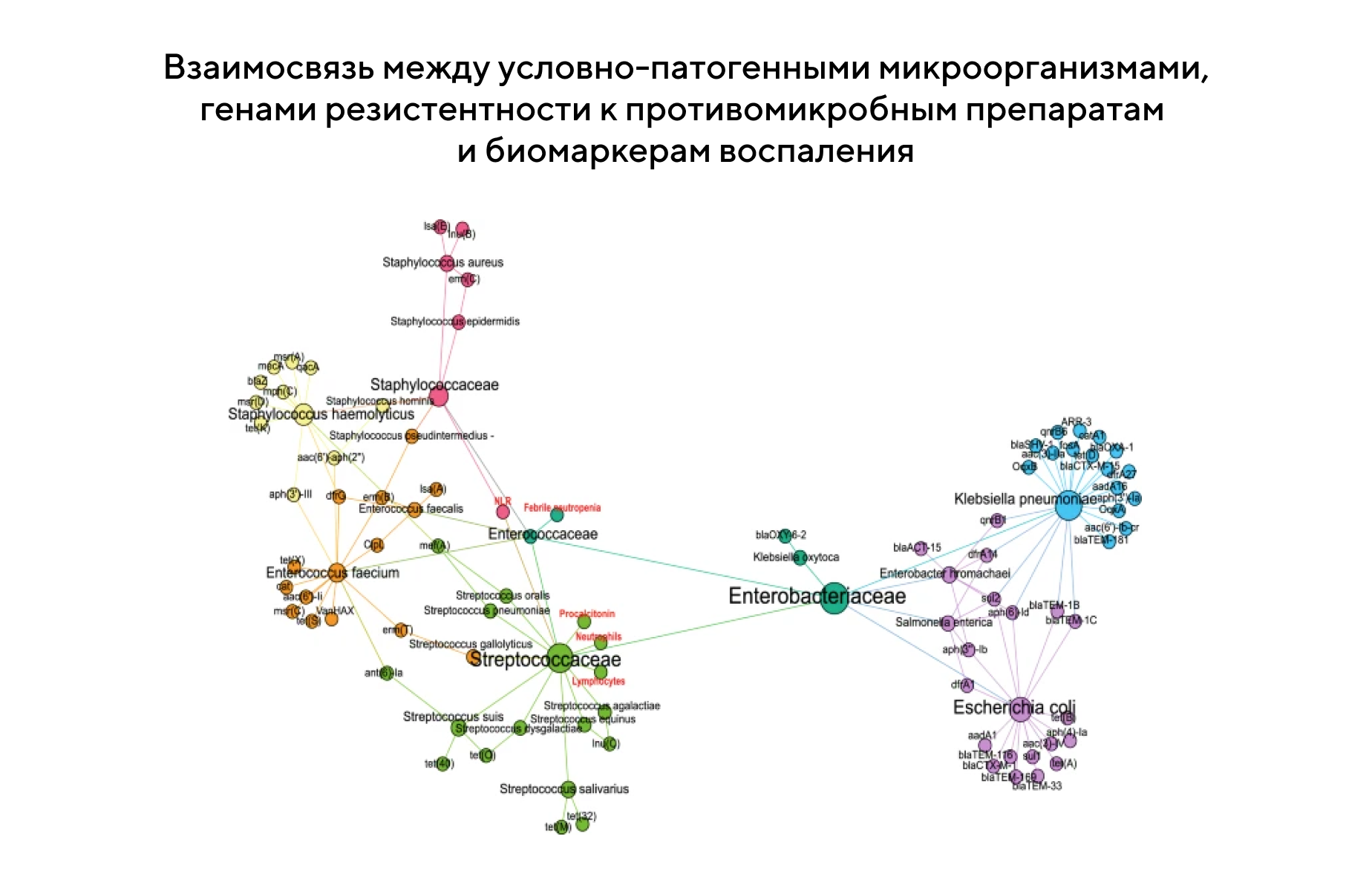
Источник: адаптировано из Nature Scientific Reports
Обнаружен новый маркер нейробластомы
Нейробластома — один из наиболее распространенных видов злокачественных опухолей, на которую приходится 15% всех случаев смерти от рака у детей. За последние годы был достигнут значительный прогресс в понимании развития нейробластомы, однако пятилетняя выживаемость пациентов все еще остается достаточно низкой — около 50%. Это подталкивает исследователей к дальнейшему изучению нейробластомы, особенно в части поиска потенциальных терапевтических мишеней.
Наиболее часто плохой прогноз нейробластомы связан с повышенной амплификацией онкогена MYCN и сверхэкспрессией белка N-Myc. Увеличение количества этого белка может приводить к онкогенезу, что делает N-Myc привлекательной мишенью для лечения нейробластомы, особенно в связи с его быстрой протеасомной деградацией и недолговечностью.
В новом исследовании обнаружили один из возможных маркеров нейробластомы — онкопротеин AF1q, роль которого уже была доказана при прогрессировании лейкемии и солидных опухолей. Выяснилось, что выключение белка AF1q в клетках нейробластомы вызывает протеасомную деградацию N-Myc, активирует р53 и блокирует развитие клеточного цикла, что в конечном счете приводит к запрограммированной гибели клеток. Более того, подавление AF1q ослабляет онкогенность опухоли in vivo, что подчеркивает потенциальную важность этого белка в терапии нейробластомы. — AF1q is a universal marker of neuroblastoma that sustains N-Myc expression and drives tumorigenesis.
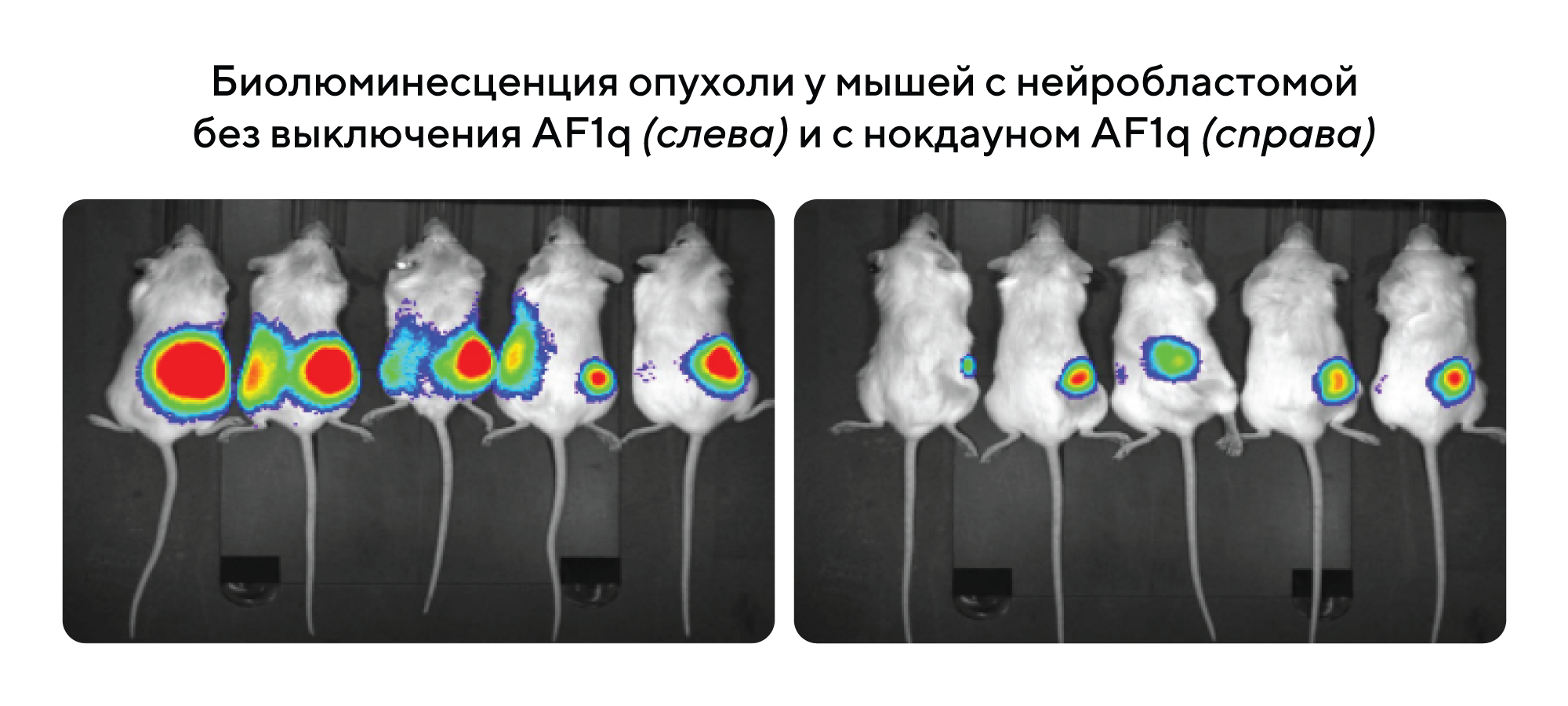
Источник: адаптировано из Springer Nature Research Communities
Аутоиммунные заболевания
Генетический контроль иммунного ответа при диабете 1-го типа
При сахарном диабете 1-го типа разрушаются β-клетки поджелудочной железы, из-за чего нарушается синтез инсулина. Многие пациенты с сахарным диабетом вынуждены постоянно принимать инсулин для компенсации его дефицита в организме. Усилия многих научных групп направлены на потенциальное предотвращение разрушения β-клеток, чтобы если не полностью остановить этот патологический процесс, то хотя бы отсрочить гибель клеток. В новом обзоре сообщается об адаптивном механизме защиты β-клеток, который способен контролировать врожденный иммунный ответ в начале развития сахарного диабета 1-го типа. Так, уровень метилтрансферазы m6A (METTL3) в β -клетках резко повышается в самом начале развития диабета, но затем так же быстро снижается по мере прогрессирования заболевания. Эксперименты на моделях мышей с сахарным диабетом показали: увеличение длительности экспрессии METTL3 с помощью методов генной терапии in vivo задерживает разрушение β-клеток и замедляет развитие диабета. Это делает METTL3 потенциальной мишенью для лечения пациентов с сахарным диабетом 1-го типа. — Redox regulation of m6A methyltransferase METTL3 in β-cells controls the innate immune response in type 1 diabetes.
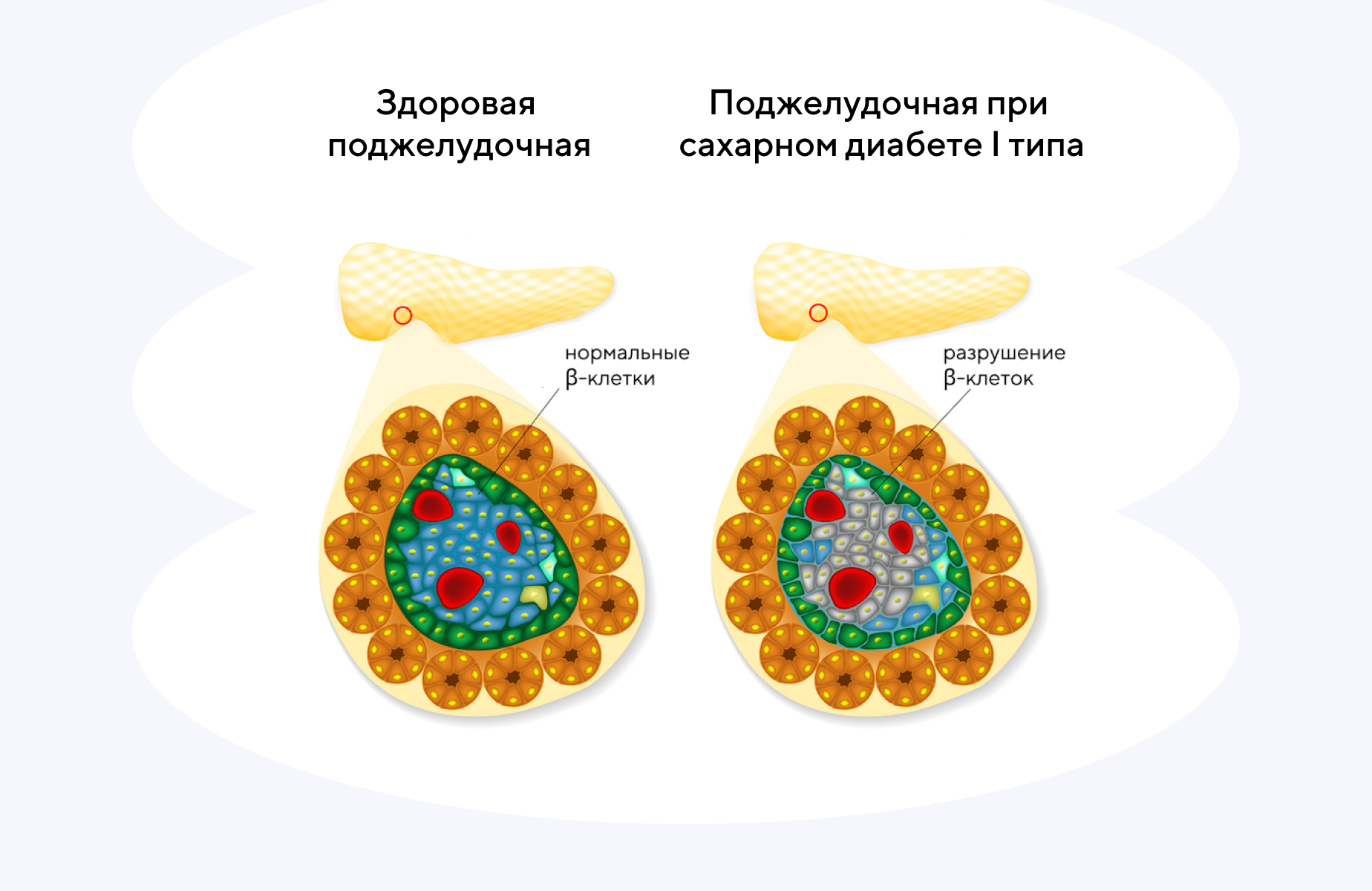
Источник: адаптировано из Live Science
Взаимосвязь между HLA-DRB1 и стратегией развития ревматоидного артрита
Один из самых сильных генетических факторов риска ревматоидного артрита — HLA-DRB1. Аллели HLA-DRB1, которые кодируют изменения аминокислотной последовательности в положениях 11, 71 и 74, связаны с риском развития ревматоидного артрита. В новом исследовании проанализировали взаимосвязь между конкретным локусом HLA-DRB1 и реакцией пациентов с ревматоидным артритом на лечение абатацептом или ингибиторами TNF. Так, у пациентов с общим эпитопом HLA-DRB1 наблюдался благоприятный ответ на абатацепт и обратно ассоциированный ответ на ингибиторы TNF. Также была обнаружена связь между присутствием аминокислоты валина в положении 11 и положительным ответом на абатацепт. Эти результаты подтверждают гипотезу о том, что ответ на лечение ревматоидного артрита зависит от локуса HLA-DRB1 — и это позволяет выбирать наиболее оптимальную терапию для конкретного пациента. — Association of HLA-DRB1 locus with treatment response to abatacept or TNF inhibitors in patients with seropositive rheumatoid arthritis.
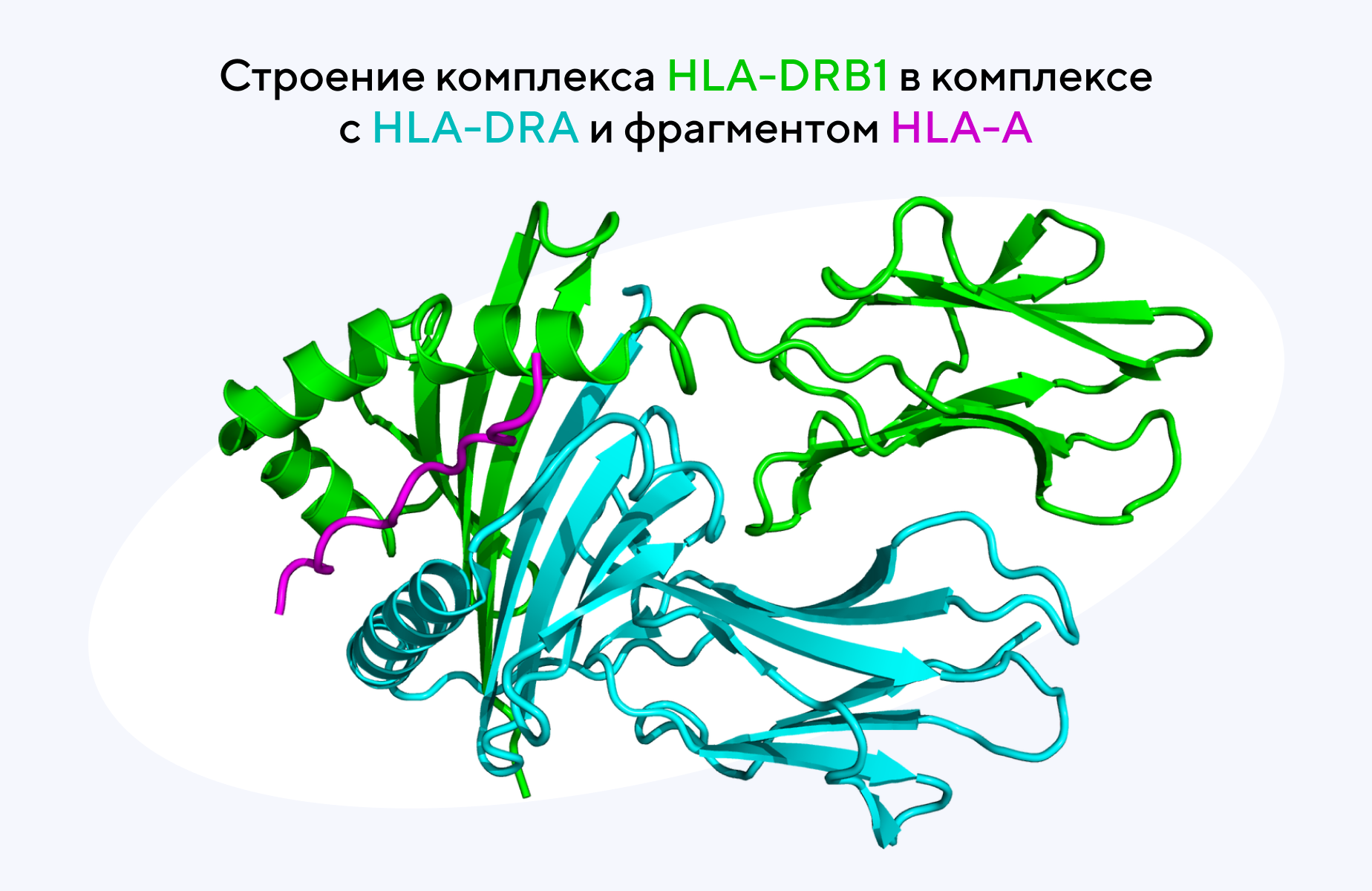
Источник: адаптировано из Wikipedia
Митохондриальная ДНК как маркер рассеянного склероза
В недавнем обзоре митохондриальная ДНК (мтДНК) была идентифицирована как потенциальный маркер рассеянного склероза и его дальнейшего лечения. Всего в исследовании участвовали 48 пациентов с рассеянным склерозом, которым трансплантировали гемопоэтические стволовые клетки, а также 32 здоровых добровольца. Выяснилось, что уровень мтДНК у пациентов с рассеянным склерозом до начала лечения был выше, чем у здоровых людей из контрольной группы. Однако после терапии стволовыми клетками уровень мтДНК выравнивался и в дальнейшем существенно не отличался от количества мтДНК у здоровых людей. Этот результат подтверждает важную роль мтДНК в ранней диагностике рассеянного склероза. — Mitochondrial DNA marks multiple sclerosis.
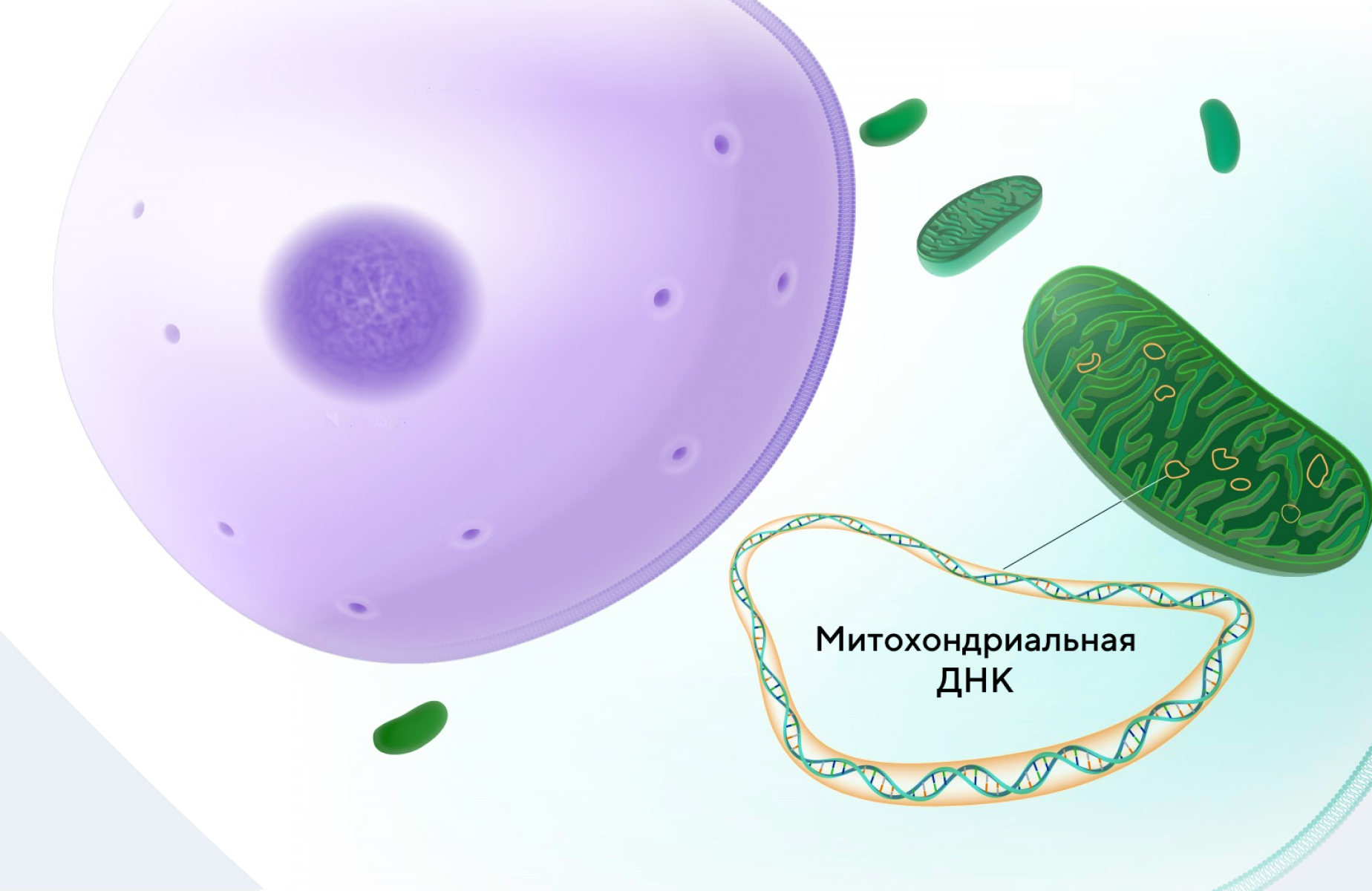
Источник: адаптировано из NIH
Генная терапия
Гуманизированные мышиные модели для AAV-терапии
Клинические исследования в случае генной терапии, связанной с аденоассоциированным вирусом (AAV), ограничены из-за недостаточной разработки экспериментальных животных моделей. В новом обзоре исследователи описывают мышиную модель, которая не содержит химерных трансгенов человека. Гуманизированную мышиную модель удалось получить с помощью трансдукции AAV и использовать для изучения заболеваний человека. В данном эксперименте она применялась для исследования рака печени в доклинических испытаниях. — A humanized mouse model for adeno-associated viral gene therapy.

Источник: адаптировано из Nature Communications