
Научный дайджест #27: расширяем потенциал действия БЦЖ
Оказывается, вакцина БЦЖ, хорошо известная в странах СНГ и вводимая почти всем, способна помочь в борьбе с одной из сложных форм колоректального рака. Конечно, пока что нет большой выборки, которая позволила бы однозначно подтвердить эффективность этого способа терапии. Однако результаты недавнего исследования открывают новую перспективу для этого давно проверенного препарата в терапии рака кишечника. Подробнее об этой теме, а также о других открытиях в молекулярной онкологии читайте в новом выпуске дайджеста!
Как восстановить работу GPCR с помощью малых молекул
Генные мутации, приводящие к изменению аминокислот в белках, могут существенно нарушать их работу и вызывать множество заболеваний. Особенно уязвимы к мутациям рецепторы, сопряженные с G-белками (GPCR), — важные молекулярные «антенны» клеток, которые отвечают за передачу сигналов и во многом влияют на регуляцию организма. Многие наследственные болезни связаны с дефектами таких рецепторов, когда мутации приводят к их неправильной сборке и потере функции.
Недавнее исследование ученых из Центра геномных исследований Барселоны показало, что одна малая молекула-стабилизатор способна «починить» почти все разновидности мутаций разных типов GPCR. Связывание этой молекулы с целевым белком помогает белкам правильно сворачиваться и доставляться к мембране клетки, где они выполняют свои функции. Терапевтическую важность этого исследования сложно переоценить: для пациентов с редкими наследственными заболеваниями, вызванными разными мутациями GPCR, теперь может быть разработан один общий препарат — универсальный «фармацевтический швейцарский нож». — A small molecule stabilizer rescues the surface expression of nearly all missense variants in a GPCR.
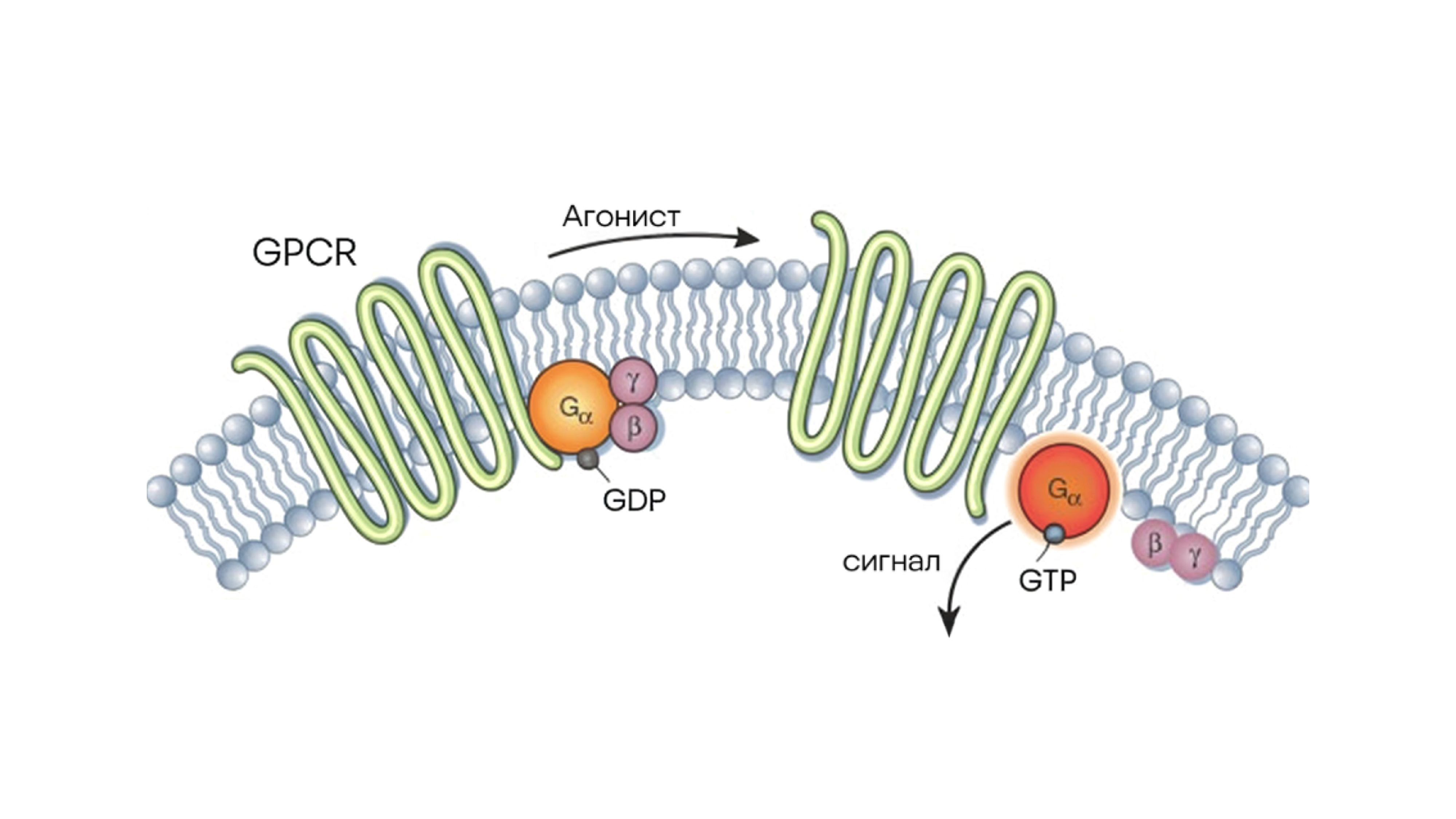
Схема активации субъединицы альфа в составе рецептора, сопряженного с G-белком. В случае воздействия на GPCR лиганда (агонист) состояние рецептора изменяется. Источник: адаптировано из Nature
БЦЖ против колоректального рака
Колоректальный рак с микросателлитной стабильностью (MSS, microsatellite-stable colorectal cancer) — одна из часто встречающихся форм рака кишечника, который обычно плохо поддается лечению. Потенциальным способом терапии против этого злокачественного новообразования может стать знаменитая вакцина БЦЖ, изначально разработанная против туберкулеза.
В недавнем исследовании удалось показать, что введение БЦЖ в MSS-модели колоректального рака способствует проникновению цитотоксичных CD8+ T-лимфоцитов в опухоль. Механизм действия связан с подавлением гена ARID1A, важного регулятора, который влияет на устойчивость опухоли к иммунному контролю. Подавление ARID1A улучшает иммунный ответ, приводя к замедлению роста опухоли. Благодаря такой иммунной активации предложенная стратегия обещает расширить возможности борьбы с устойчивыми формами колоректального рака. — Bacillus Calmette-Guerin induces CD8+ T cell infiltration and suppresses tumor progression in microsatellite stable colorectal cancer by downregulating ARID1A.
Бацилла Кальметта — Герена под микроскопом (увеличение: 1000). Источник: «Википедия»
Найден ключевой белок, который ускоряет рост колоректального рака
Еще одно исследование, посвященное молекулярным механизмам развития колоректального рака. В центре внимания оказался белок HMGB1, который играет роль в регуляции различных клеточных и воспалительных процессов. Однако его точное воздействие на пути, способствующие развитию колоректального рака, не были до конца понятными.
Недавно выяснилось, что HMGB1 подавляет активность фермента DDX3 — геликазы, задействованной в обмене РНК. Это, в свою очередь, приводит к активации сигнального пути MAPK, который играет важную роль в стимулировании клеточного деления и выживании клеток. Подавление DDX3 белком HMGB1 запускает целый каскад химических реакций, которые усиливают рост опухолевых клеток и способствуют их агрессивному поведению. Эксперименты на клеточных и животных моделях подтвердили, что блокирование этого взаимодействия замедляет прогрессию колоректального рака. Возможно, эта работа откроет перспективы создания точечных терапевтических стратегий, которые позволят более эффективно сдерживать развитие этого злокачественного новообразования. — HMGB1 downregulates DDX3 to activate the MAPK pathway, promoting the progression of colorectal cancer.
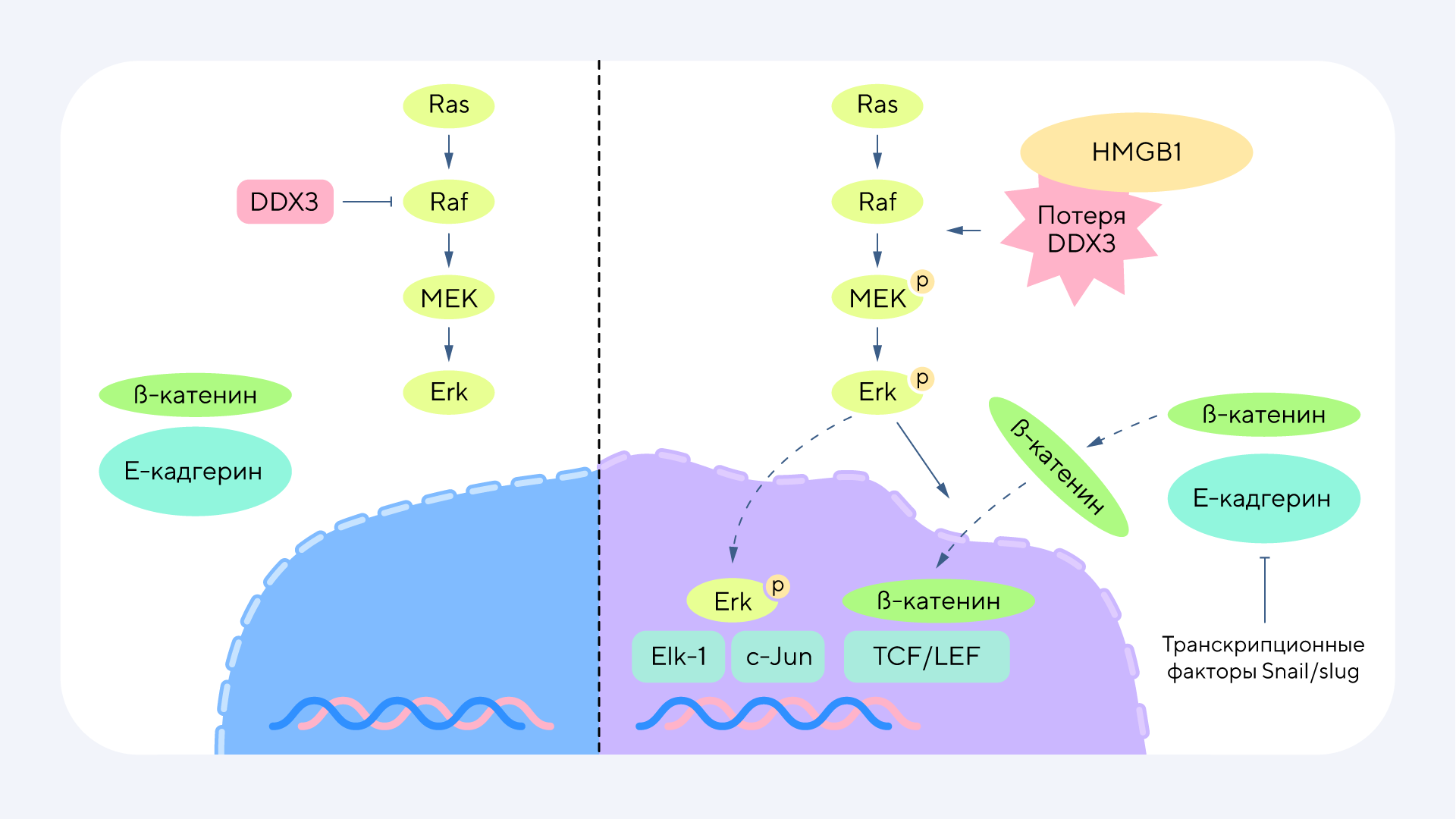
Молекулярная схема исследования. В результате анализа удалось выявить снижение фосфорилирования Erk1/2, c-Jun и Elk1, а также снижение экспрессии β-катенина и транскрипционного фактора Snail одновременно с повышением экспрессии E-кадгерина. Дополнительные результаты подтвердили взаимодействие HMGB1 и DDX3. Это свидетельствует о том, что белок HMGB1 является онкогеном в случае колоректального рака. Источник: Cancer Gene Therapy
Как «запустить» аутофагию для терапии злокачественных заболеваний
ГМ-КСФ, или гранулоцитарно-макрофагальный колониестимулирующий фактор, играет неоднозначную роль в раковых процессах, одновременно стимулируя как опухолевые, так и противоопухолевые иммунные клетки. Чтобы лучше разобраться в механизмах работы этого фактора, ученые сосредоточились на онколитическом аденовирусе, кодирующем ГМ-КСФ. Этот аденовирус способен индуцировать аутофагию — процесс, при котором клетка «перерабатывает» собственные компоненты, способствуя уничтожению опухолевых клеток.
Во время эксперимента были разработаны два варианта вируса с разной экспрессией ГМ-КСФ: один с промотором CMV (oAd-CMV-GM-CSF), другой — с эндогенным вирусным E3 промотором (oAd-GM-CSF). Выяснилось, что oAd-CMV-GM-CSF вызывает более высокий уровень аутофагии, активируя сигнальный путь JAK2/STAT2. В результате усиливается апоптоз опухолевых клеток, а также ускоряется репликация вируса и повышается количество активных вирусных потомков. При использовании ингибиторов аутофагии и JAK2 эта эффективность значительно снижалась, что подтверждает ключевую роль аутофагии в терапевтическом эффекте на опухолевые клетки. Это открывает новые перспективы для разработки эффективных онколитических вирусов, способных не только напрямую уничтожать опухоли, но и стимулировать иммунитет. — A novel GM-CSF-encoding oncolytic adenovirus induces profound autophagy and promotes viral replication to enhance anti-tumor efficacy.
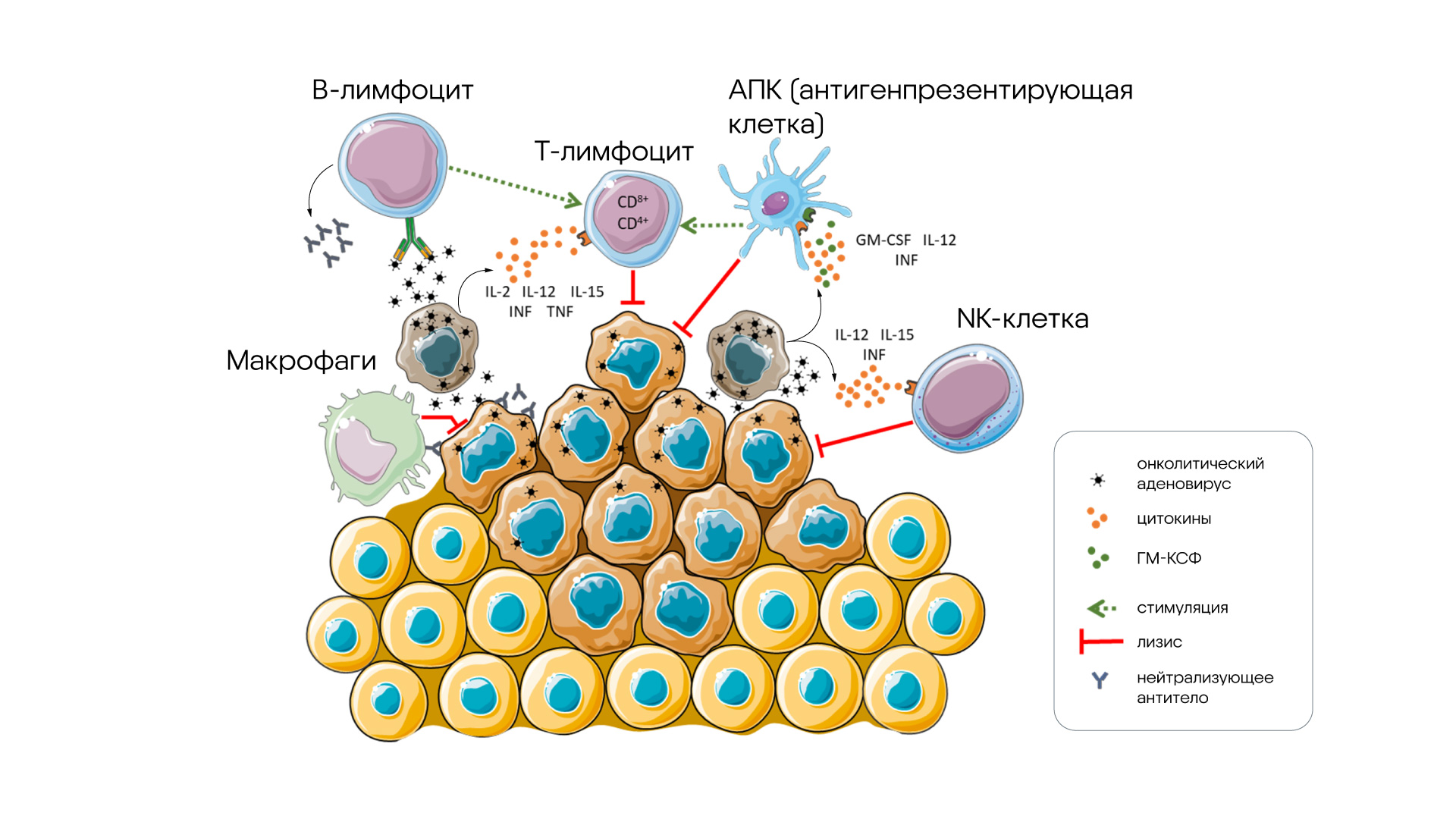
Схема активации иммунной системы онколитическим аденовирусом. Источник: MDPI
Как длинные некодирующие РНК влияют на развитие рака легкого
Исследования последних лет показали, что свой вклад в развитие и прогрессирование немелкоклеточного рака легкого (НМРЛ) вносят длинные некодирующие РНК. Ученые из Египта решили сфокусироваться на изучении роли этих молекул в патогенезе НМРЛ. Выяснилось, что длинные некодирующие РНК взаимодействуют с основными сигнальными системами клетки, такими как EGFR, PI3K/AKT/mTOR, JAK/STAT и p53. Причем некодирующие РНК могут выступать как в роли онкогенных, так и подавляющих опухоли агентов: в зависимости от своей роли, они могут как способствовать опухолевому росту, метастазированию и лекарственной устойчивости, так и воздействовать на микроокружение опухоли, регулируя апоптоз, пролиферацию и миграцию клеток.
Авторы работы выделяют несколько перспективных терапевтических подходов, включая использование антисмысловых олигонуклеотидов, РНК-интерференции и методов редактирования генов с помощью метода CRISPR/Cas9 для точечного контроля над длинными некодирующими РНК и коррекции нарушенных процессов в опухолевых клетках. Возможно, в будущем терапевтические подходы, нацеленные на эти молекулы, помогут преодолеть лекарственную устойчивость и замедлить прогрессирование немелкоклеточного рака легкого. — Long non-coding RNAs and signaling networks in non-small cell lung cancer: mechanistic insights into tumor pathogenesis.
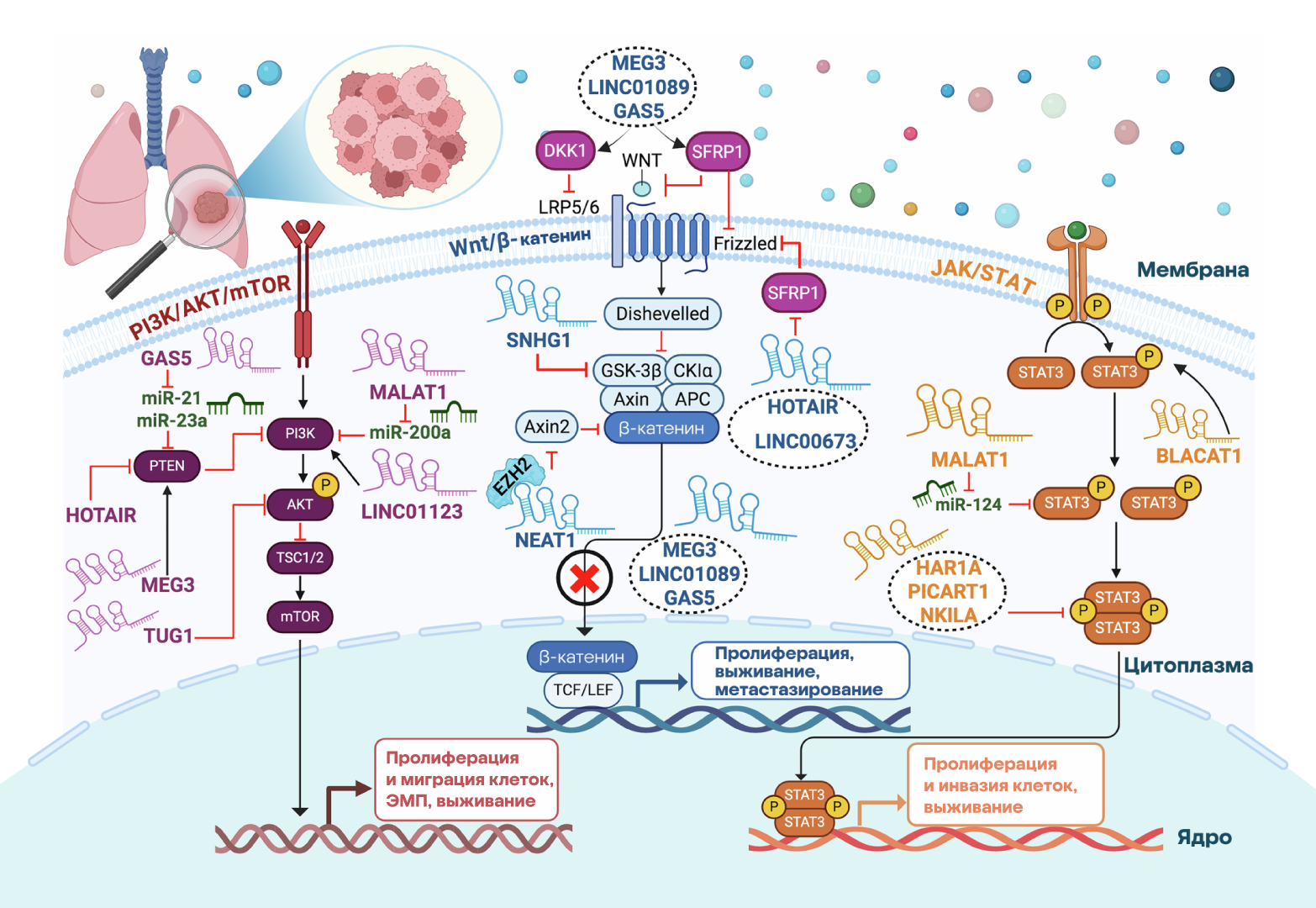
Схема молекулярных механизмов и сигнальных путей влияния длинных некодирующих РНК на основные онкогенные каскады при НМРЛ, которые изучали в исследовании. Источник: Cancer Gene Therapy
NK-клетки для борьбы с немелкоклеточным раком легкого
Еще одно исследование, посвященное терапии немелкоклеточного рака легкого (НМРЛ). В этот раз ученые сосредоточились на естественных киллерах (NK) — клетках иммунной системы, способных распознавать и уничтожать опухолевые клетки. Основная задача биологов состояла в усилении их противоопухолевой активности за счет интеграции рецептора с антигенной специфичностью к белку ROBO1 — этот белок связан с ростом опухоли. Одновременно с этим производили генетическую «перенастройку» локуса PD-1, который обычно ограничивает иммунный ответ.
В ходе исследования удалось разработать NK-клетки с гуманизированным химерным рецептором антигена (CAR) на белке ROBO1, встроенным в геномный локус PD-1. Это одновременно блокирует тормозящий сигнал PD-1 и активирует уничтожение опухолевых клеток. Предложенный двойной подход обеспечил своеобразный синергетический эффект — усиленное выделение противоопухолевых цитокинов и повышение способности клеток убивать раковые клетки in vitro и в моделях НМРЛ. Такая интеграция рецептора позволила успешно преодолеть подавление иммунных клеток, из-за чего в ряде случаев снижается эффективность клеточной терапии. — Integration of humanized ROBO1 CAR in PD-1 locus in natural killer cells delivers synergistic tumor-killing effect against non-small cell lung cancer.
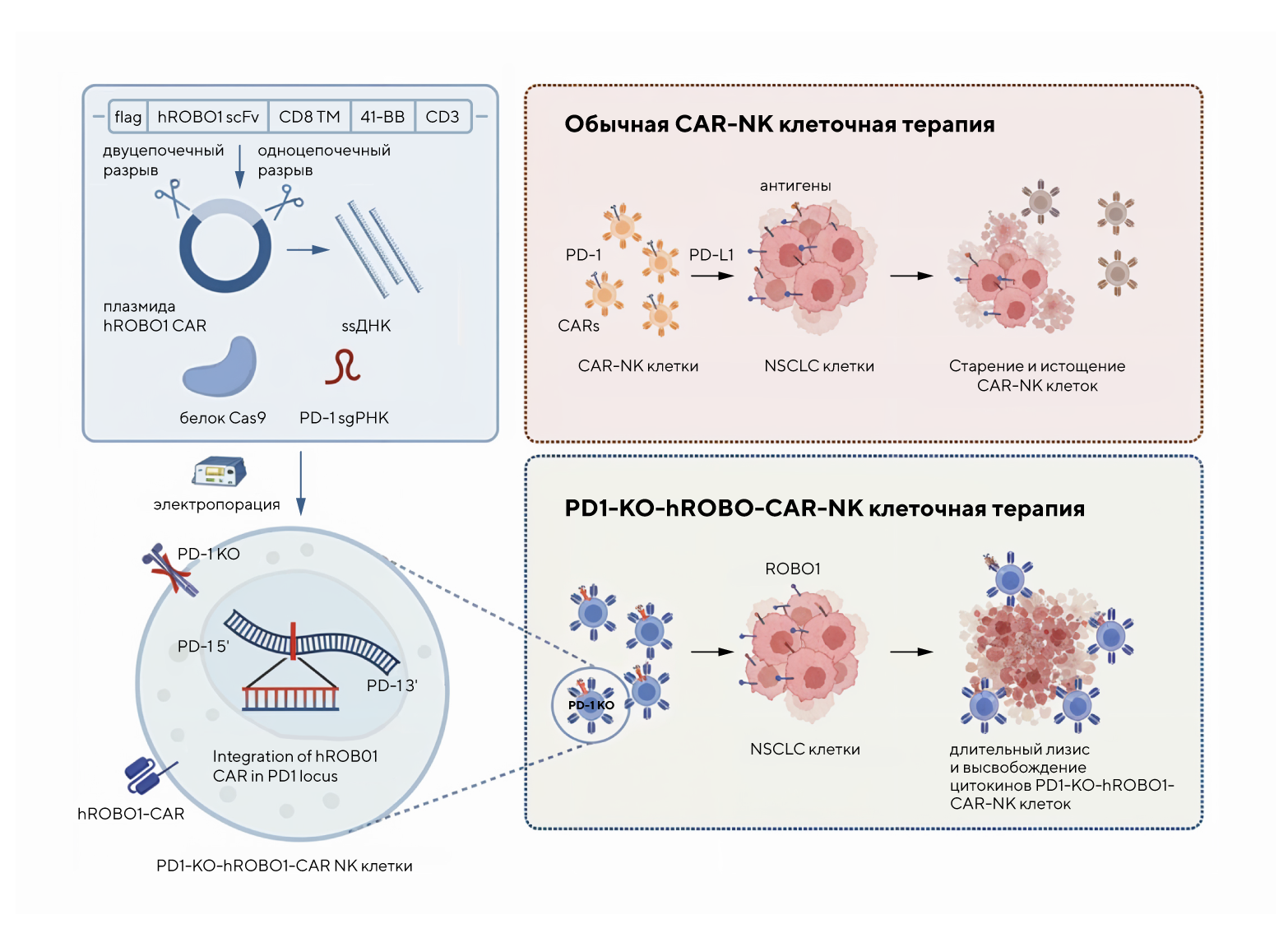
Схема интеграции гуманизированного CAR-рецептора ROBO1 в локус PD-1 естественных клеток-киллеров. Источник: Cancer Gene Therapy
Почему Biogen завершает разработки, основанные на AAV-векторах
Генная терапия с использованием аденоассоциированных вирусов (AAV) долгое время рассматривалась как перспективный метод лечения редких наследственных заболеваний. В частности, с помощью AAV можно обеспечить доставку необходимых генов в клетки пациента. Однако высокие затраты, ограничения повторных дозировок и возникающие риски безопасности сдерживали широкое применение этой технологии. Biogen, одна из ведущих биотехнологических компаний в мире, официально объявила об окончательном прекращении всех своих исследований и разработок на основе AAV, что стало знаковым событием в области генотерапии.
Решение Biogen стало результатом долгосрочного пересмотра приоритетов компании и оценки перспективности различных терапевтических подходов. Несмотря на успехи отдельных препаратов с AAV-векторами, таких как Luxturna и Zolgensma, которые доказали свою эффективность при редких болезнях, Biogen решил сосредоточить усилия на более многообещающих методах лечения с улучшенными показателями безопасности и потенциалом к многоразовому применению. Однако переключение с AAV на другие более гибкие и безопасные технологии открывает новые горизонты для разработки эффективных генетических и клеточных терапий с потенциально лучшими клиническими результатами для пациентов по всему миру. — Biogen officially ends all AAV gene therapy work, prompting team restructure.