
Научный дайджест #23: Как обнаружить «скрытую угрозу»
Опухолевые клетки подчас скрывают свои уязвимые места за масками, которые сложно распознать иммунной системе. В случае рака поджелудочной железы ученые обнаружили особые «криптические» антигены — скрытые белки, которые появляются только в опухолевых клетках и остаются невидимыми для здоровых тканей. Эти уникальные мишени способны активировать Т-лимфоциты, которые призваны распознавать и уничтожать опухолевые клетки. Недавно удалось раскрыть потенциал таких антигенов для разработки более точных и эффективных видов иммунотерапии, открыв тем самым перспективы борьбы с одним из самых агрессивных видов рака. Подробнее об этом и других исследованиях из мира молекулярной онкологии (и не только) читайте в нашем новом дайджесте!
Криптические антигены: новая мишень для иммунотерапии рака поджелудочной железы
Рак поджелудочной железы — одно из самых агрессивных онкологических заболеваний с крайне низкой выживаемостью. Традиционные методы лечения, включая химио- и лучевую терапию, часто оказываются малоэффективными, а иммунотерапия редко применяется из-за слабой иммуногенности опухоли. Однако новое исследование, опубликованное в журнале Science, выявило неожиданную уязвимость опухолевых клеток — криптические антигены, которые могут стать основой для принципиально новых методов лечения.
Для поиска антигенов исследователи применили метод иммунопептидомики, который позволяет анализировать пептиды, представленные на поверхности клеток. Они создали органоиды (3D-модели опухолей) из образцов пациентов и выделили более 1700 криптических пептидов. Затем ученые проверили, могут ли эти пептиды активировать Т-лимфоциты — «киллеров» иммунной системы.
Оказалось, что Т-клетки, запрограммированные на распознавание криптических антигенов, эффективно уничтожали опухолевые органоиды и замедляли рост опухолей у мышей. Например, в экспериментах с грызунами инженерные Т-клетки сокращали количество жизнеспособных раковых клеток, хотя полного уничтожения опухоли достичь не удалось.
Описанный подход принципиально отличается от существующих методов, так как использует скрытые антигены, игнорируемые иммунной системой при естественном ответе. По словам исследователей, клинические испытания могут начаться в ближайшие несколько лет. Но несмотря на то, что до практического применения еще далеко, это открытие меняет представление о возможностях иммунотерапии и дает надежду на прорыв в лечении рака поджелудочной железы — одного из самых смертоносных видов злокачественных новообразований. — Pancreatic cancer-restricted cryptic antigens are targets for T cell recognition.
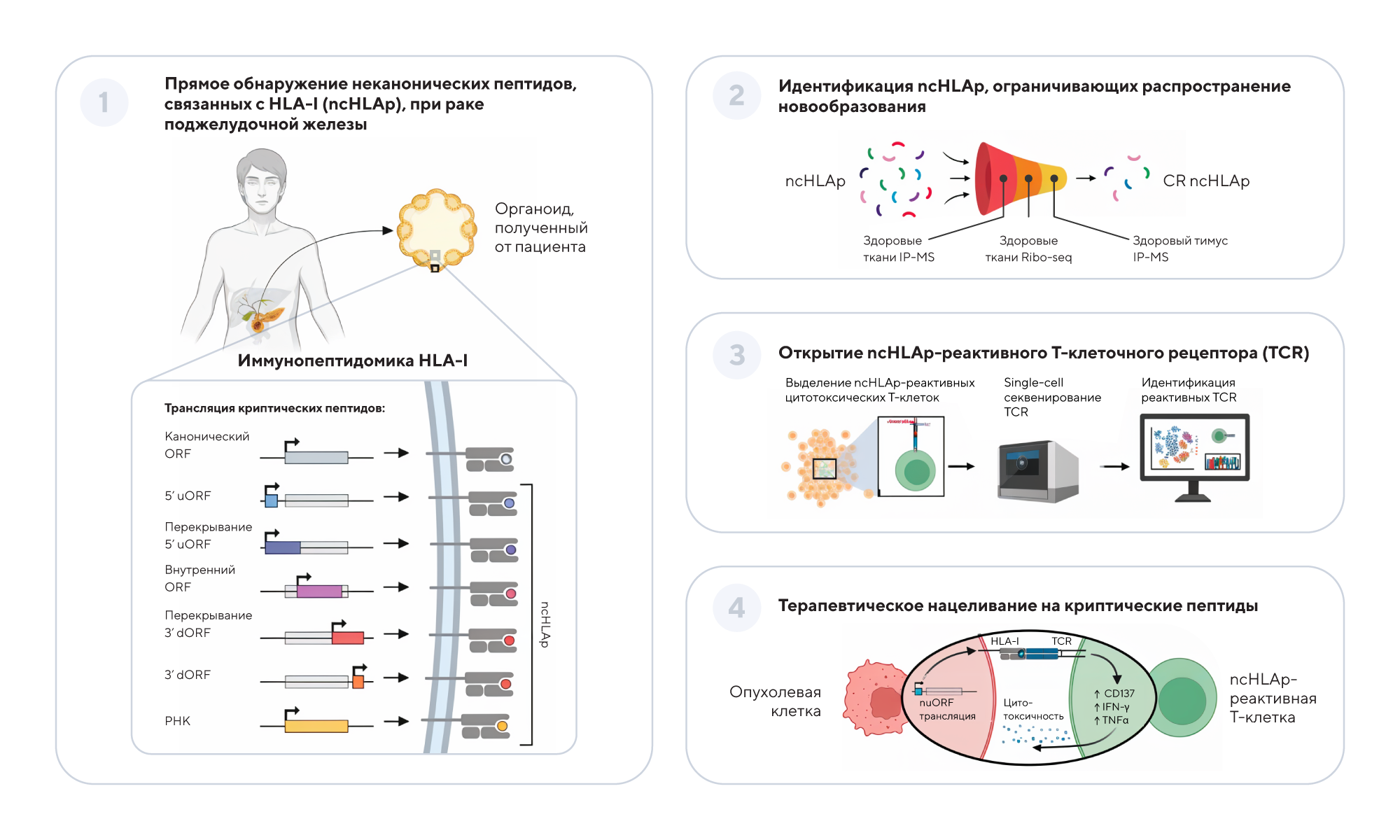
Криптические антигены при раке поджелудочной железы. Аберрантная трансляция некодирующего генома приводит к появлению неканонических (криптических) пептидов, которые могут быть представлены HLA-I при раке поджелудочной железы. Криптические пептиды являются сильно иммуногенными, а родственные Т-клеточные рецепторы (TCR) способны распознавать клетки рака поджелудочной железы, полученные от пациента, как ex vivo, так и in vivo. Источник: адаптировано из Science
Как немутированные антигены становятся новыми мишенями в борьбе с раком
Принято считать, что высокая мутационная нагрузка при меланоме и немелкоклеточном раке легких (НМРЛ) делает мутированные опухолевые антигены (mTSAs) главной мишенью для иммунотерапии. Однако новое исследование, опубликованное в Nature, переворачивает эту парадигму: 99% антигенов в этих опухолях происходят из немутированных геномных последовательностей. Это открытие может существенно изменить подходы к лечению рака.
К такому выводу пришли ученые из Канады, которые провели протеогеномный анализ образцов меланомы и НМРЛ и изучили более 150 000 пептидов, связанных с молекулами MHC I (главного комплекса гистосовместимости). Оказалось, что лишь 1% антигенов был связан с мутациями, тогда как остальные 99% делились на три группы:
- аберрантно экспрессируемые опухолеспецифичные антигены (aeTSAs) — образуются из последовательностей, которые в норме «молчат» в здоровых тканях, но активируются в раке за счет эпигенетических изменений;
- ассоциированные с опухолью антигены (TAAs) — белки, которые сверхэкспрессируются в раковых клетках;
- линейно-специфичные антигены (LSAs) — характерны для клеток-предшественников (например, меланоцитов в меланоме).
Мутированные антигены редко становятся мишенями по нескольким причинам. Во-первых, большинство мутаций локализованы в регионах генома, которые плохо «читаются» системой MHC I. Во-вторых, их РНК-экспрессия часто оказывается слишком низкой для генерации пептидов. В отличие от них, немутированные антигены многочисленны, стабильны и часто являются общими для разных пациентов, что упрощает разработку универсальных видов терапии.
Возможно, это исследование позволит сместить фокус с разработки персонализированных вакцин для мутированных антигенов к более широкому спектру немутированных TSAs. В результате потенциально может повыситься эффективность лечения, особенно для пациентов с низким уровнем мутаций. — Tumor antigens preferentially derive from unmutated genomic sequences in melanoma and non-small cell lung cancer.
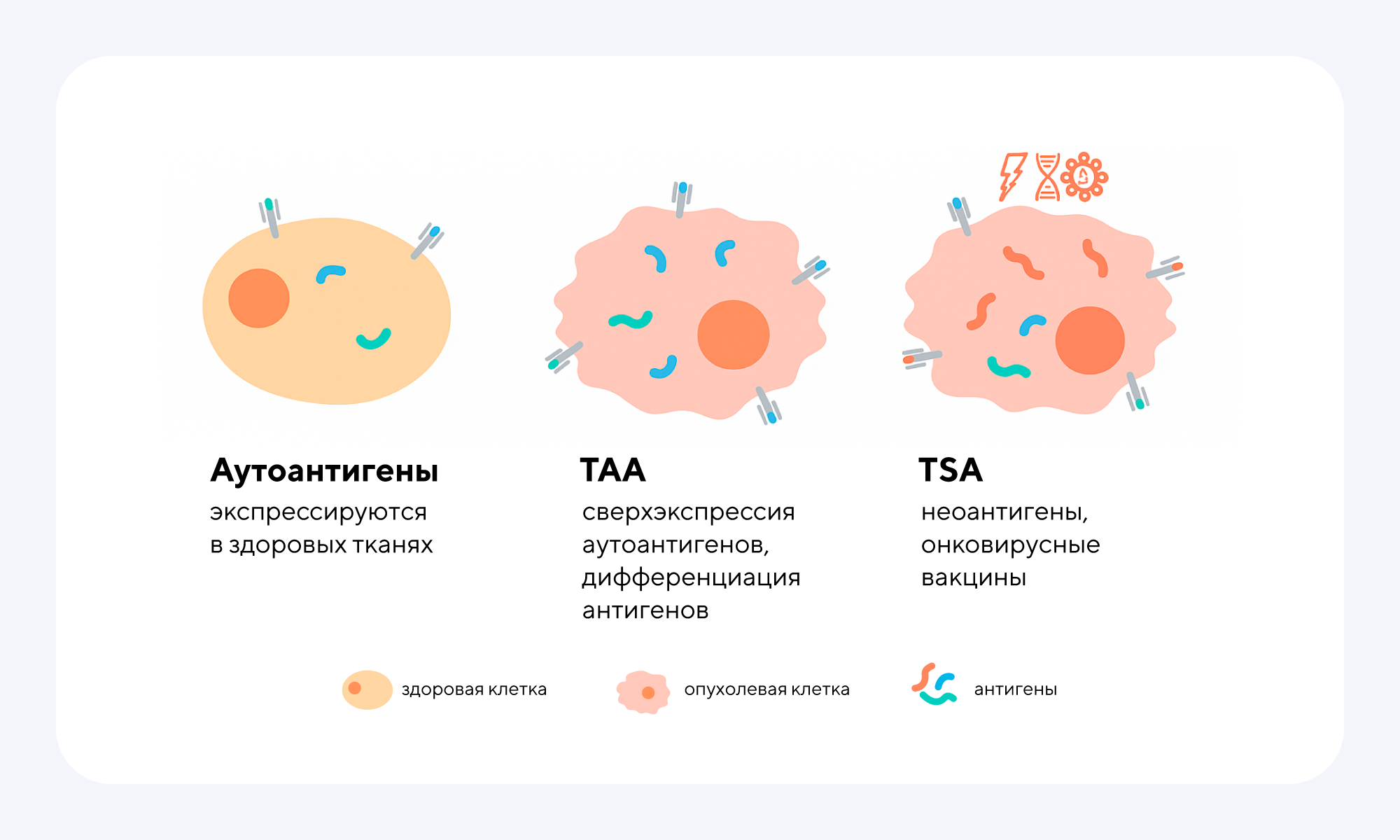
Классификация опухолевых антигенов. Опухолевые антигены обычно можно разделить на опухолеассоциированные антигены (TAA, tumor-associated antigens) и опухолеспецифические антигены (TSA, tumor-specific antigens) на основе паттерна экспрессии родительского гена. TAA — это собственные белки, экспрессируемые в опухолевых клетках; при их злокачественной трансформации может происходить сверхэкспрессия нормальных генов или экспрессия тканеспецифических паттернов генов. TSA — это белки, экспрессируемые опухолевыми клетками, которые могут возникать в результате мутаций (неоантигены), из вирусов, участвующих в онкогенной трансформации (онковирусные антигены), или из экспрессии эндогенных ретровирусов, специфичных для опухоли. Источник: адаптировано из MDPI
Разработан еще один ИИ-инструмент для диагностики в онкологии
Современная онкология требует анализа множества данных: от медицинских изображений и генетической информации до истории болезни и актуальных рекомендаций по лечению. Ученые разработали автономный ИИ-алгоритм на базе GPT-4, который объединяет специализированные инструменты для комплексной оценки пациентов со злокачественными новообразованиями. Этот алгоритм способен самостоятельно выбирать нужные методы анализа — например, выявлять мутации KRAS и BRAF по гистопатологическим снимкам, сегментировать радиологические изображения и искать информацию в медицинских базах данных и научных публикациях. В ходе тестирования на 20 моделях клинических случаев ИИ-алгоритм достиг 91% точности в постановке диагнозов и более 75% в корректном цитировании онкологических руководств, что значительно превосходит возможности GPT-4 без интеграции специализированных инструментов. Такой уровень точности снижает риск ошибок и «галлюцинаций» нейросети — ложных, но убедительных ответов, что особенно важно в медицине. Благодаря способности автономно обрабатывать и синтезировать разнородные данные, ИИ-агент в будущем может стать помощником для врачей в плане принятия персонализированных решений по лечению пациентов с онкологическими заболеваниями. — Development and validation of an autonomous artificial intelligence agent for clinical decision-making in oncology.
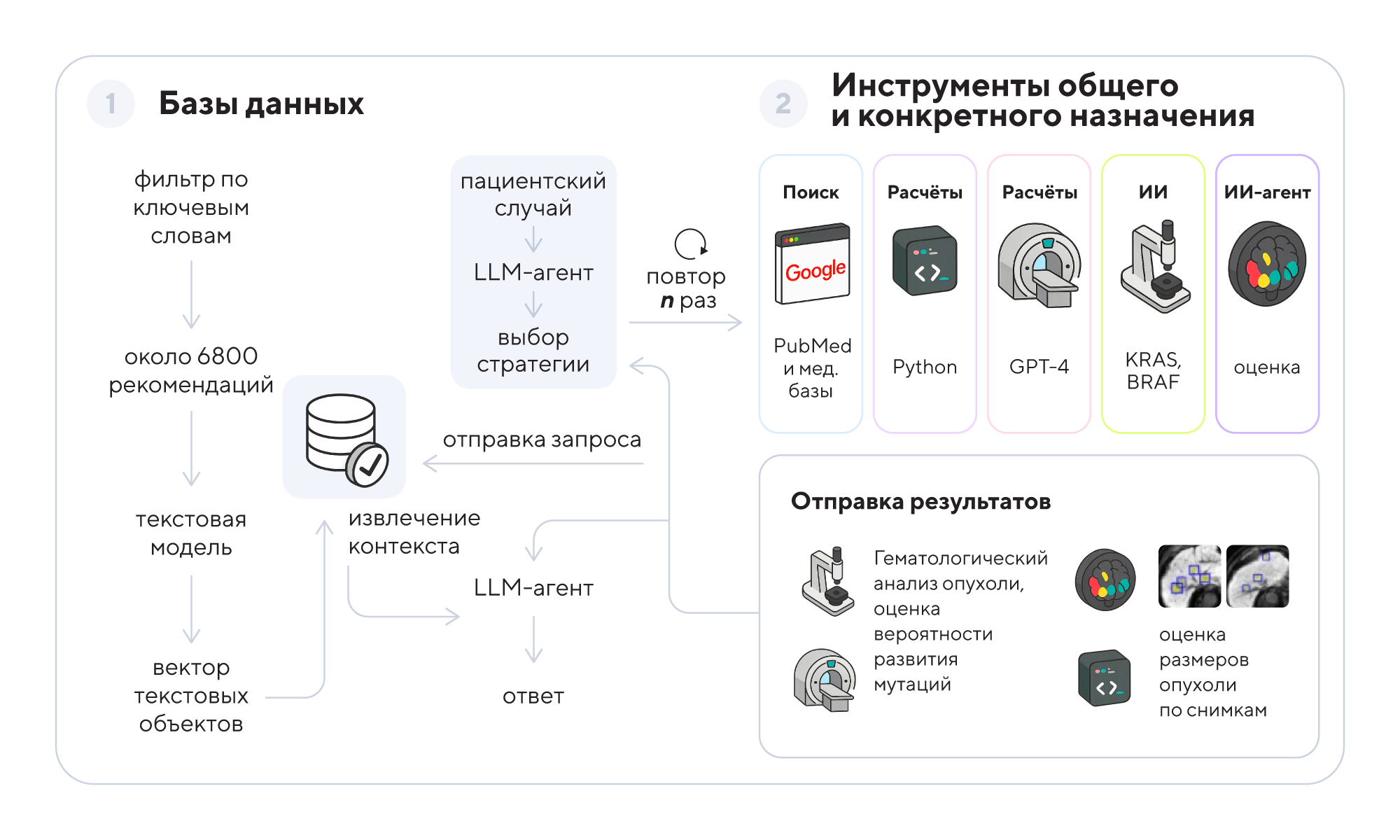
Схема работы ИИ-инструмента для оценки опухолей. ИИ-агент обращается к базам знаний, включая медицинские документы, клинические руководства и инструменты оценки. Дополнительно схема поиска включает специализированные возможности веб-поиска через Google, PubMed и API OncoKB. Возможности ИИ-агента дополнительно расширены за счет интеграции модели, позволяющей оценивать отчеты по результатам КТ и МРТ-сканирования. Источник: адаптировано из Nature Cancer
Обнаружена перспективная мишень для лечения злокачественных новообразований печени
Гепатоцеллюлярная карцинома (ГЦК) — одно из самых распространенных злокачественных новообразований печени. В основе ее развития лежат сложные молекулярные процессы, в том числе нарушение регуляции белков, отвечающих за рост и выживание опухолевых клеток. Одним из таких белков является RIOK1 — киназа, вовлеченная в сборку рибосом и регуляцию синтеза белков, однако роль этого белка в ГЦК до недавнего времени оставалась малоизученной.
Новое исследование ученых из Китая показало, что RIOK1 способствует развитию ГЦК через механизм фазового разделения — процесса, при котором белки и РНК собираются в особые безмембранные структуры, называемые стрессовыми гранулами. Эти гранулы образуются в клетках под воздействием неблагоприятных условий и временно приостанавливают синтез определенных белков. Ученые обнаружили, что RIOK1 накапливается в стрессовых гранулах и ограничивает трансляцию важного опухолевого супрессора PTEN, снижая его уровень в клетках печени. Это ослабляет противоопухолевую защиту и способствует ускоренному росту и выживанию раковых клеток.
Кроме того, RIOK1 оказался связан с устойчивостью опухолей к лекарству донатинибу, что подчеркивает его значение в механизмах лекарственной резистентности. Эксперименты показали, что подавление RIOK1 снижает пролиферацию и выживаемость клеток ГЦК, а также замедляет рост опухолей в моделях на мышах. Таким образом, RIOK1 выступает как новый онкогенный драйвер, активирующий опухолевый рост через регуляцию стрессовых гранул и подавление PTEN. Возможно, это открытие позволит разрабатывать более эффективные и персонализированные методы борьбы с одним из самых агрессивных видов рака печени. — RIOK1 phase separation restricts PTEN translation via stress granules activating tumor growth in hepatocellular carcinoma.

Опухолевые клетки формируют стрессовые гранулы, которые позволяют им адаптироваться к стрессу и выживать. После медикаментозного лечения клетки гепатоцеллюлярной карциномы демонстрируют фазовое разделение, опосредованное киназой RIOK1. Это активирует пентозофосфатный путь, способствуя выживанию клеток. Источник: адаптировано из Nature Cancer
Белок сплайсосомы может оказаться полезным в терапии онкологических заболеваний
SF3B4 — белок, входящий в состав сплайсосомы, клеточной «машины», которая отвечает за правильную обработку РНК и формирование зрелых мРНК. Нарушения в работе сплайсосомных белков всё чаще связывают с развитием различных видов опухолей, однако роль SF3B4 в онкогенезе до сих пор оставалась недостаточно изученной. Новое исследование показало, что SF3B4 обладает универсальными онкогенными свойствами сразу в нескольких типах рака. Ученые обнаружили, что повышенная экспрессия этого белка характерна для различных видов злокачественных новообразований и связана с усилением деления и выживания раковых клеток. SF3B4 способствует активации ключевых сигнальных путей, поддерживающих рост опухоли, а также помогает клеткам избегать естественных механизмов клеточной смерти. В ряде экспериментов было показано, что снижение уровня SF3B4 приводит к замедлению роста опухолей и повышает чувствительность раковых клеток к терапии. Это подсвечивает роль SF3B4 как перспективной мишени для разработки новых противоопухолевых препаратов. — Pan-cancer oncogenic properties and therapeutic potential of SF3B4.
Структура белка SF3B4, необходимого для сборки сплайсосомы и точного сплайсинга. Недавно удалось выяснить, что этот белок играет важную роль в развитии рака. Источник: Википедия
Молекулярный чекпоинт, способный расширить способы терапии колоректального рака
Одним из важных ферментов, который модифицирует молекулы тРНК, добавляя особую химическую метку m1A, — это белок TRMT6. Недавно выяснилось, что модификация m1A, осуществляемая TRMT6, играет роль своеобразного чекпоинта при синтезе гистонов — белков, которые упаковывают и защищают ДНК в клеточном ядре. В частности, в исследовании изучали роль TRMT6 при колоректальном раке. Оказалось, что TRMT6-опосредованная модификация тРНК регулирует производство гистонов, обеспечивая баланс между ростом и стабильностью генома. Нарушение этой модификации приводит к ускоренному росту опухолевых клеток и способствует прогрессированию колоректального рака. Таким образом, TRMT6 выступает как ключевой чекпоинт, контролирующий трансляцию и поддерживающий нормальный клеточный цикл. Получается, что TRMT6 и связанный с ним механизм модификации тРНК могут стать новыми мишенями для разработки противораковых препаратов в случае колоректального рака. — TRMT6-mediated tRNA m1A modification acts as a translational checkpoint of histone synthesis and facilitates colorectal cancer progression.
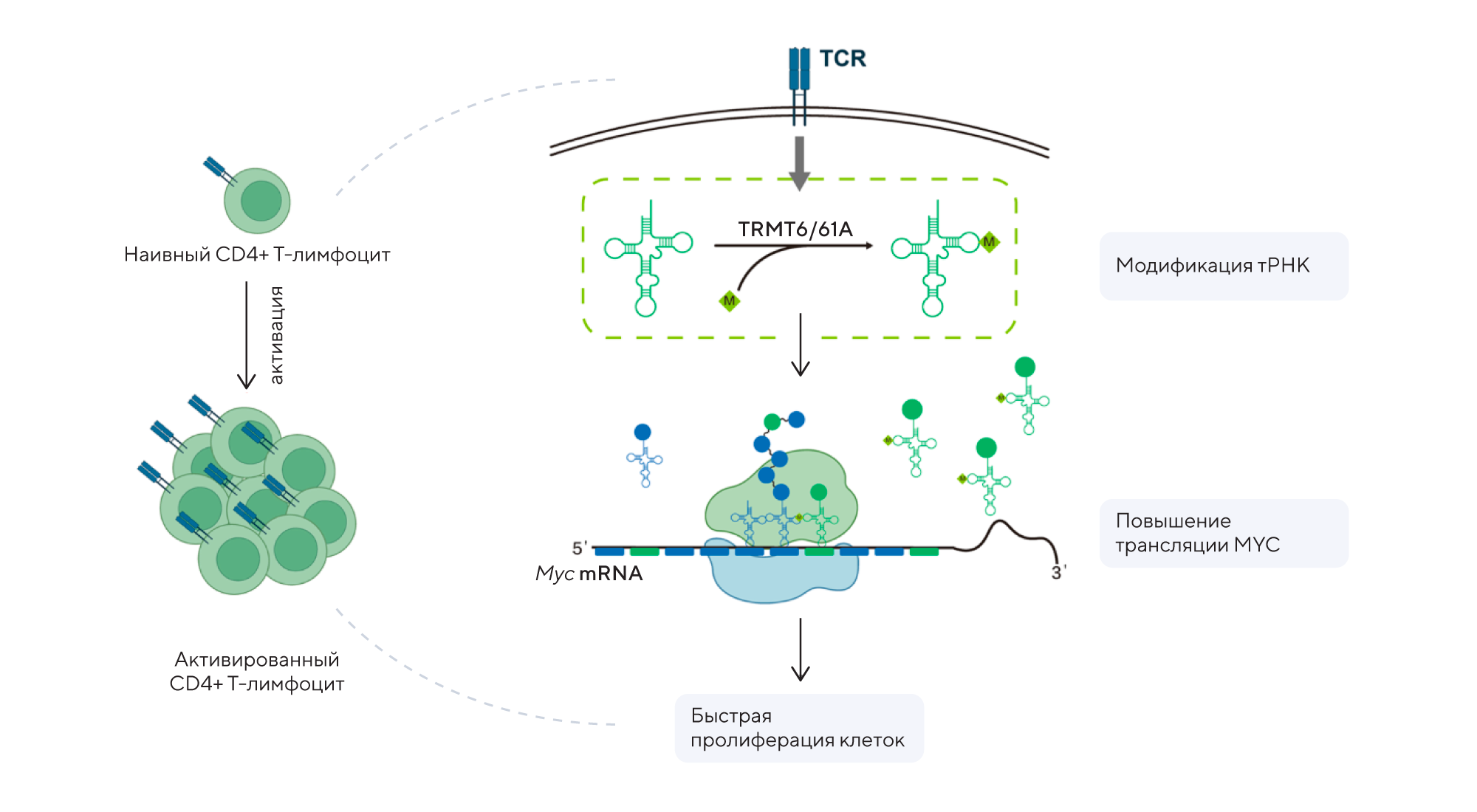
Модификация m1A транспортной РНК может способствовать пролиферации CD4+ Т-клеток за счет повышения эффективности трансляции определенной группы матричных РНК. Источник: адаптировано из Cell Research