
Дайджест #20. Как излучение берет опухоль под прицел
Один из самых известных и давно используемых способов лечения онкологических заболеваний — лучевая терапия. Несмотря на свою длительную историю изучения, которая берет начало аж в 1895 году, у этого способа лечения до сих пор остается мощный минус — при излучении «под прицел» может попадать не только сама опухоль, но и окружающие ее здоровые ткани. Однако у лучевой терапии есть «младший брат» — флеш-терапия (FLASH), основанная на точечном и очень коротком, порядка нескольких миллисекунд, облучении. Благодаря такому режиму введения минимизируется степень повреждения нормальных тканей рядом с опухолью, хотя воздействие на сами опухолевые клетки остается на прежнем уровне. В недавнем исследовании обнаружили не только интересные эффекты флеш-терапии на метаболизм макрофагов, но и предложили комбинацию этого способа воздействия с CAR-T-терапией. Подробнее читайте в новом дайджесте.
Мощный ингибитор может улучшить эффективность терапии при раке яичников
Ингибиторы PARP (poly(ADP-ribose) polymerase) — хорошо зарекомендовавший себя класс лекарственных соединений, которые блокируют ферменты поли(АДФ-рибоза)-полимеразы. В результате нарушается процесс репарации ДНК в опухолевых клетках, приводя к их гибели. Но несмотря на доказанную противоопухолевую эффективность препаратов на основе ингибиторов PARP, приобретенная резистентность к этим соединениям затрудняет лечение рака яичников и других разновидностей злокачественных новообразований. Чтобы лучше разобраться в причинах устойчивости опухолей к этим лекарственным препаратам, ученые из Германии изучили молекулярно-генетическую «кухню» процесса резистентности. С помощью метода CRISPR-Cas9 выяснилось, что резистентности ингибиторов PARP способствуют ДНК-деметилазы JMJD1B/JMJD1C. Для возвращения чувствительности опухолевых клеток к терапии предложили использовать метилстат (methylstat) — мощный ингибитор гистоновых деметилаз. На клеточных моделях удалось показать, что метилстат способствует положительному отбору опухолевых клеток, резистентных к ингибиторам PARP. В результате последующей терапии олапарибом — одним из широко используемых PARP-ингибиторов — повышалась восприимчивость клеток рака яичников к двуцепочечным разрывам ДНК, вызывая их последующую гибель. Это открывает перспективы для разработки препаратов на основе метилстата в качестве поддерживающей терапии. — Methylstat sensitizes ovarian cancer cells to PARP-inhibition by targeting the histone demethylases JMJD1B/C.
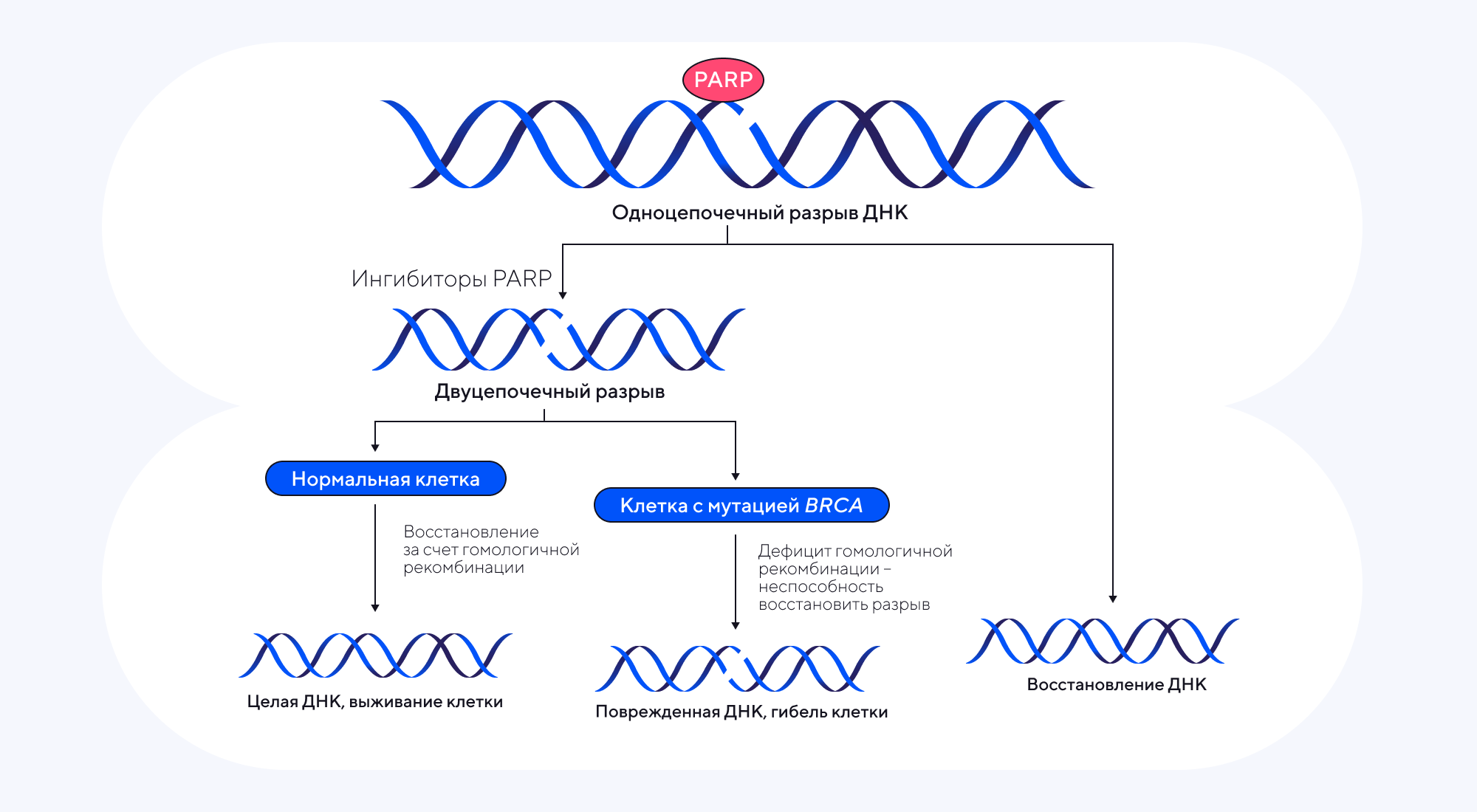
Ингибирование ферментов PARP — терапевтическая стратегия лечения злокачественных новообразований, при которых возникают дефекты репарации ДНК. Это происходит из-за дефицита гомологической рекомбинации в клетках рака яичника, как правило, содержащих мутации в генах BRCA1 или BRCA2. В результате из-за неспособности «зашить» двуцепочечный разрыв ДНК опухолевые клетки погибают. Источник: адаптировано из Nature Reviews Clinical Oncology
Ингибирование CD47 может улучшить прогноз лечения при немелкоклеточном раке легкого
При некоторых видах злокачественных новообразований обнаруживаются аномальные рецепторы эпидермального фактора роста (EGFR) из-за наличия мутации в соответствующем гене. В таких опухолевых клетках активируется сигнальный путь EGFR, что способствует усилению злокачественного перерождения клеток и ухудшению ответа опухоли на терапию, в частности препаратами на основе ингибиторов тирозинкиназы при лечении немелкоклеточного рака легкого (НМРЛ). Чтобы лучше разобраться в механизмах, которые вызывают такую лекарственную устойчивость, ученые из Китая решили изучить молекулярные причины этого процесса. Выяснилось, что иммуносупрессия опухоли опосредована метилированием первичной деметилазы m6A, что, в свою очередь, повышает регуляцию CD47 — одного из ключевых метаболических регуляторов в опухолях. Эти результаты подсвечивают возможность перспективного лечения НМРЛ за счет комбинации иммунных чекпоинтов к EGFR совместно с ингибиторами CD47. — RNA methylation of CD47 mediates tumor immunosuppression in EGFR-TKI resistant NSCLC.
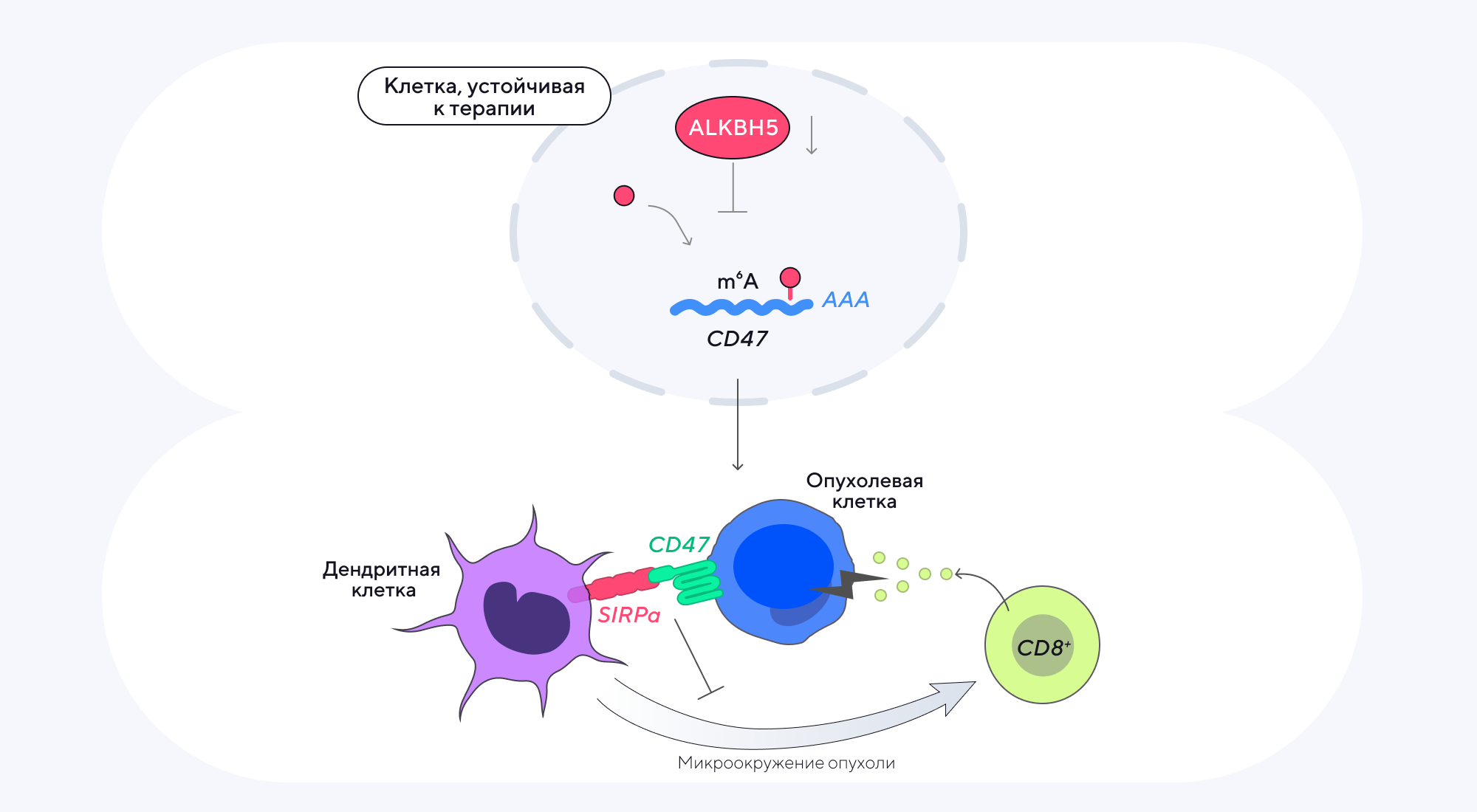
В опухолевых клетках, устойчивых к терапии иммунными чекпоинтами EGFR, происходит ингибирование деметилазы ALKBH5, из-за чего повышается регуляция CD47. Этот белок, который сверхэкспрессируется на поверхности опухолевых клеток, подает сигнал «не ешь меня» для фагоцитов, из-за чего клетки опухоли уклоняются от иммунного надзора. Поэтому блокирование CD47 и его взаимодействия с белком альфа, регулирующим сигнал (SIRPα), на фагоцитах и дендритных клетках считается многообещающей мишенью для терапии злокачественных новообразований, в том числе НМРЛ. Источник: адаптировано из British Journal of Cancer
Обнаружена новая мишень для терапии рака простаты
При раке простаты образуется злокачественная опухоль, для лечения которой в том числе назначают блокаторы выработки андрогенов. Но, несмотря на такую схему терапии, в большинстве случаев рак простаты рецидивирует. Недавно группа исследователей из Китая обнаружила потенциальную онкогенную мишень, способную улучшить прогнозы выживаемости при этом заболевании. Этой мишенью оказался фермент аденозиндезаминаза ADAR1. Выяснилось, что блокирование ADAR1 с помощью малой молекулы флударабина (ZYS-1) резко подавляло рост и метастазирование опухоли простаты и усиливало противоопухолевый ответ при иммунотерапии. Эти результаты подчеркивают потенциал применения не только ZYS-1, но и других ингибиторов ADAR1 для лечения злокачественных новообразований. — Targeting ADAR1 with a small molecule for the treatment of prostate cancer.
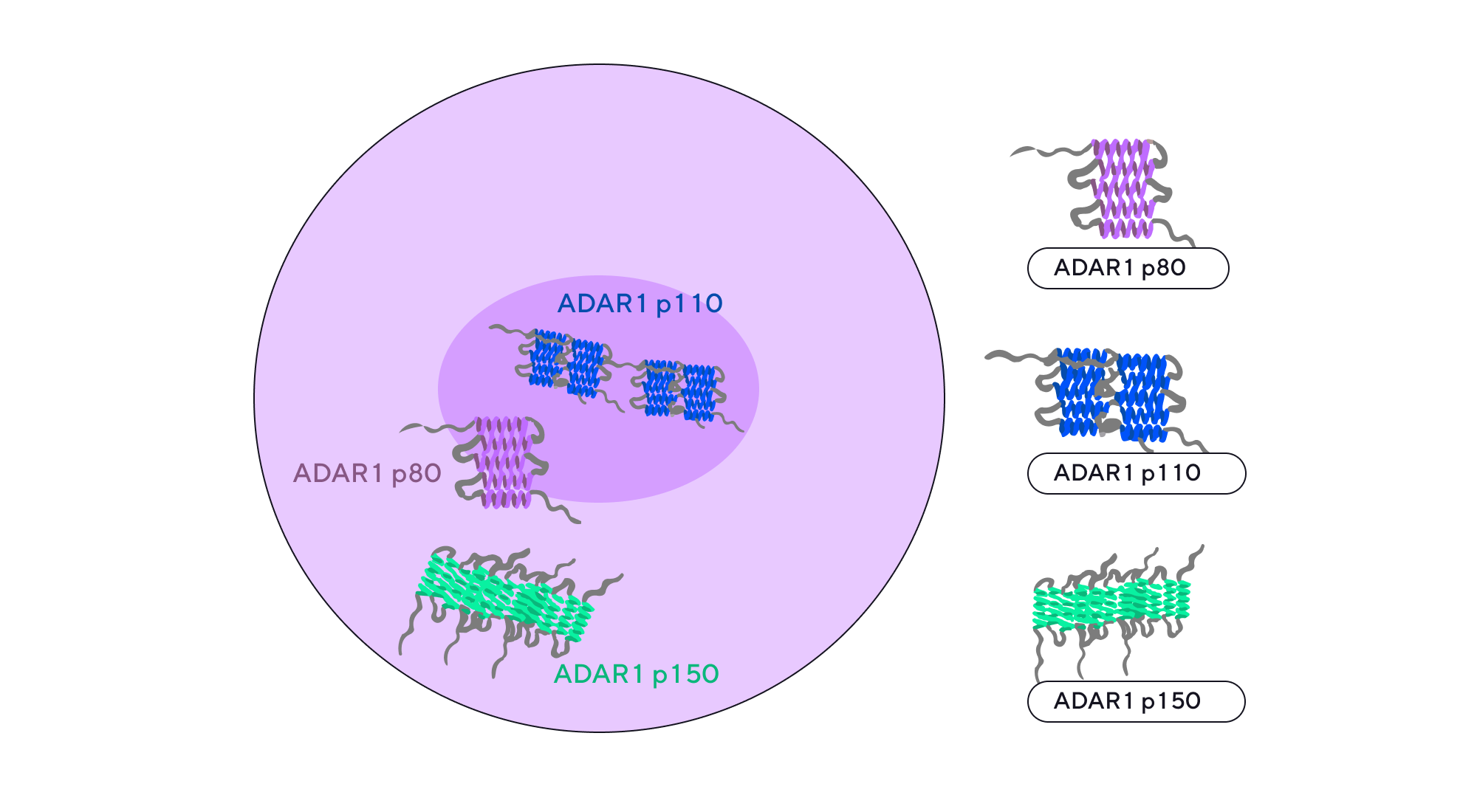
Аденозиндезаминаза ADAR1 — это многофункциональный белок, который регулирует разные процессы в клетке, поэтому обнаруживается и в цитоплазме, и в ядре. Источник: адаптировано из Biomarker Research
Перспективы FLASH-радиотерапии для лечения злокачественных новообразований
Помимо более известной лучевой терапии, для лечения злокачественных новообразований существует и другой метод — FLASH-радиотерапия. Этот способ считается многообещающим для борьбы с солидными опухолями ввиду своей более низкой токсичности в нормальных тканях. Однако то, как именно FLASH-радиотерапия воздействует на очаги новообразований, пока что остается неизвестным. Чтобы оценить потенциал применения этого вида излучения, исследователи из США изучили транскриптомы клеток на мышиной модели медуллобластомы. Выяснилось, что под влиянием FLASH-излучения происходит перестройка липидного метаболизма макрофагов, а именно — блокируется экспрессия генов, кодирующих липидоксидазу, а также ингибируется образование липидов низкой плотности. Более того, FLASH-радиотерапия улучшила инфильтрацию и активацию CAR-Т-лимфоцитов, что сделало медуллобластому более чувствительной к терапии. Это открывает многообещающие перспективы для совместного применения FLASH- и CAR-Т-терапии для лечения солидных опухолей. — FLASH radiation reprograms lipid metabolism and macrophage immunity and sensitizes medulloblastoma to CAR-T cell therapy.
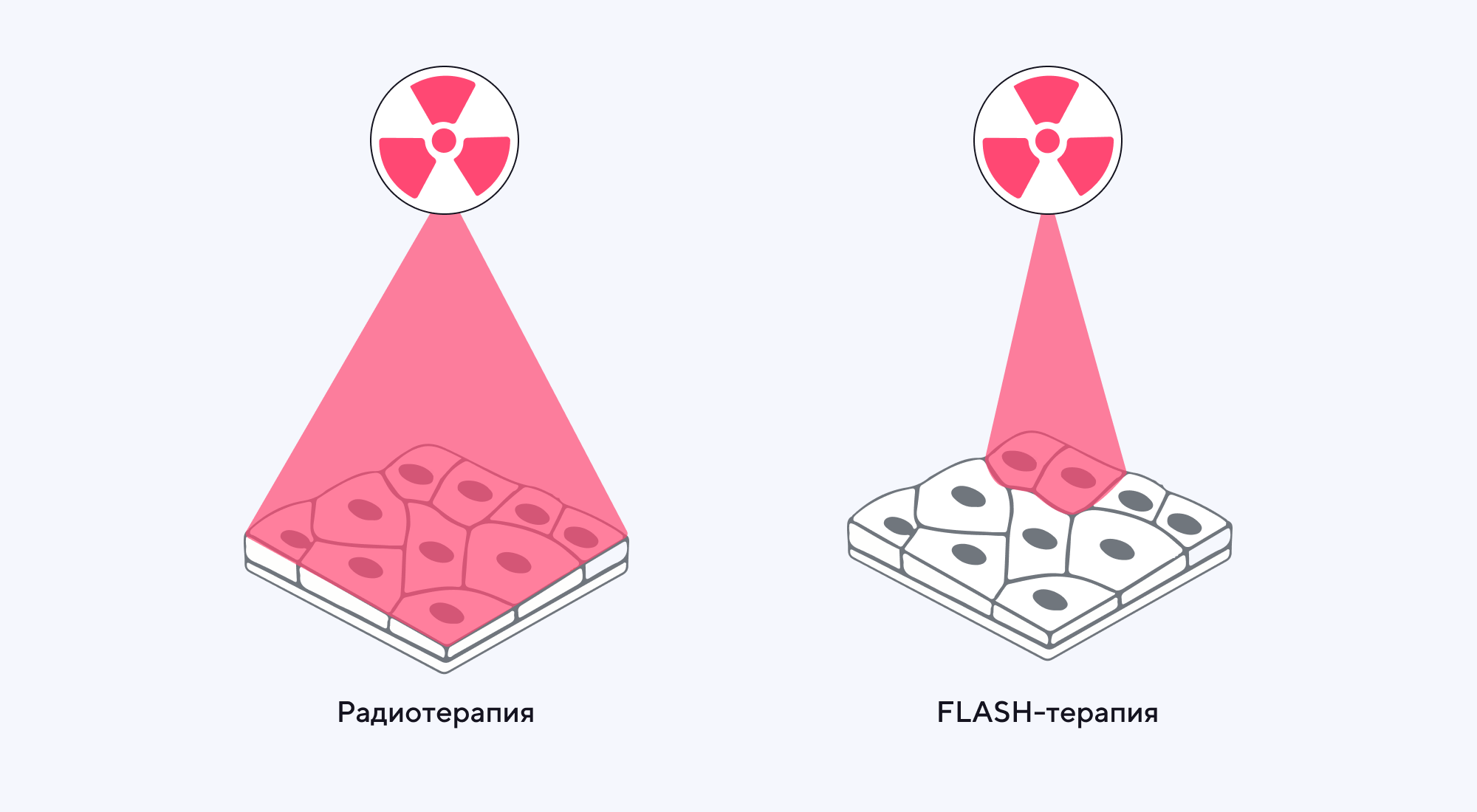
В отличие от классической лучевой терапии, при FLASH-радиотерапии излучению подвергаются точечные участки, благодаря чему влияние на окружающие ткани сведено к минимуму. Источник: Precision X-Ray
Оценка удаленных лимфоузлов позволит улучшить прогноз при раке толстой кишки
При развитии злокачественного новообразования в ходе лечения могут удалять лимфатические узлы. Считается, что такое хирургическое вмешательство в рамках операции на конкретном органе снижает вероятность метастазирования в будущем, блокируя возможности для миграции опухолевых клеток из первичного очага. В зависимости от локализации опухоли рекомендуется удалять разное количество лимфоузлов, например, не менее 15 при раке желудка. Недавно исследователи из Великобритании изучили взаимосвязь между прогнозом выживаемости и количеством удаленных лимфоузлов при раке толстой кишки. Выяснилось, что выживаемость улучшается при удалении девяти и более лимфоузлов. Поэтому ученые предлагают включить этот показатель в качестве маркера для оценки прогноза опухоли при аденокарциноме толстой кишки. — Lymph node yield as a surrogate marker for tumour biology and prognosis in colon cancer.
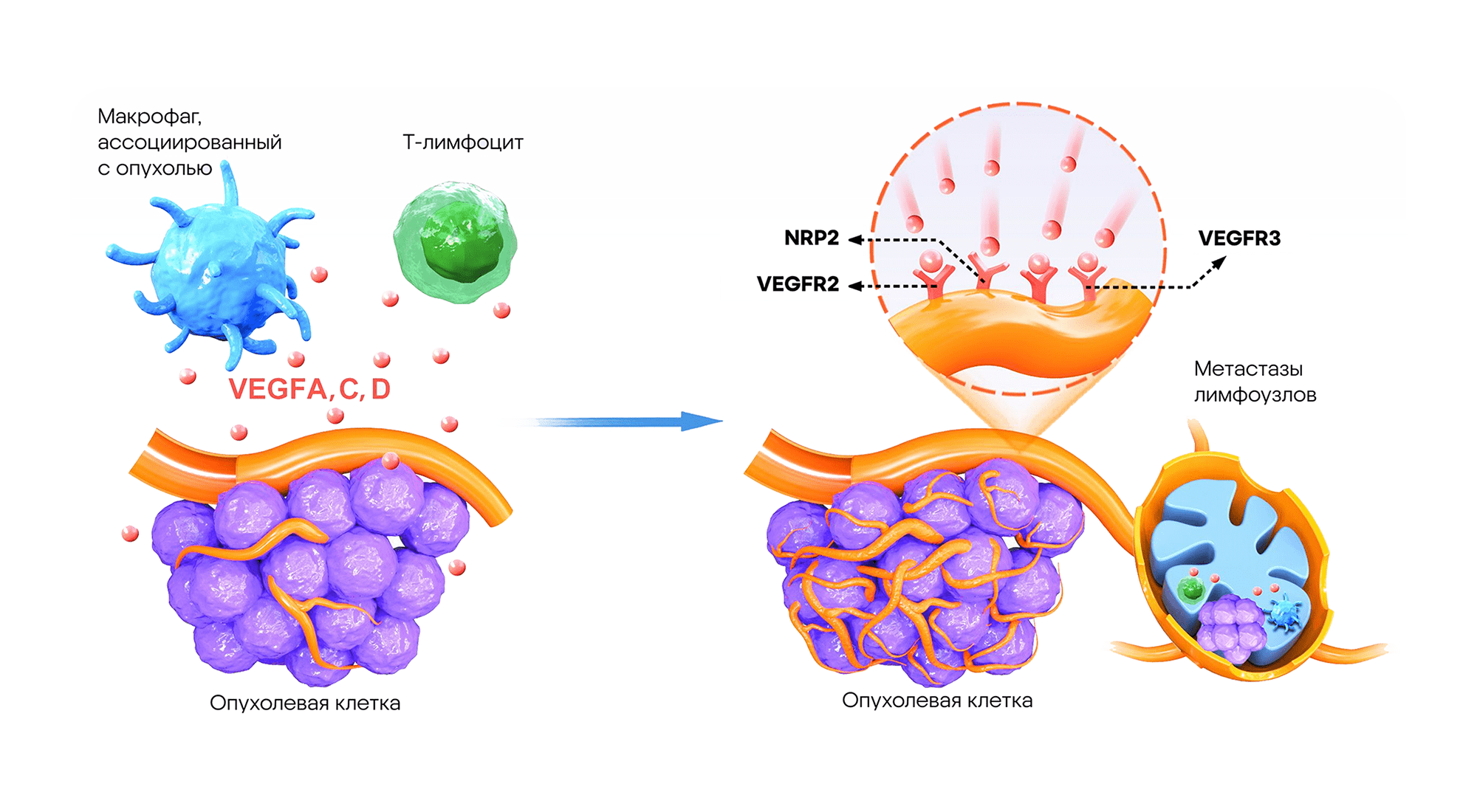
Сигнальный путь VEGFs-VEGFR-3 опосредованно вызывает активацию сигнального пути P13K/AKT и усиливает репликацию ДНК, что приводит к пролиферации лимфатических эндотелиальных клеток и неоваскуляризации, то есть патологическому разрастанию сосудов опухоли. Источник: адаптировано из Frontiers
Псевдоострая почечная недостаточность при терапии рака молочной железы
Для лечения определенных типов гормонозависимого прогрессирующего рака молочной железы могут назначать ингибиторы CDK4/6. Препараты на основе этих ингибиторов специфичным образом нацеливаются на особые белки, циклинзависимые киназы 4 и 6 (cyclin-dependent kinases, CDK4/6), и блокируют их, что прерывает деление опухолевых клеток. Однако у ингибиторов CDK4/6 есть негативный эффект: помимо терапевтического действия, они также могут подавлять канальцевую секрецию креатинина, вызывая псевдоострое повреждение почек — по крайней мере такое явление обнаружилось в исследованиях in vitro. Чтобы оценить частоту возникновения псевдоострой почечной недостаточности (ОПП), исследователи из Нидерландов обследовали 234 пациента, которые получали лечение с помощью ингибиторов CDK4/6 с 2017 по 2023 год. Выяснилось, что уровень креатинина, указывающий на псевдо-ОПП, оказался высоким и обнаружился у 73% пациентов. Эти результаты подтверждают важность своевременной диагностики и оценки скорости клубочковой фильтрации у людей, которые проходят лечение ингибиторами CDK4/6. — Pseudo acute kidney injury in patients receiving CDK4/6 inhibitors.
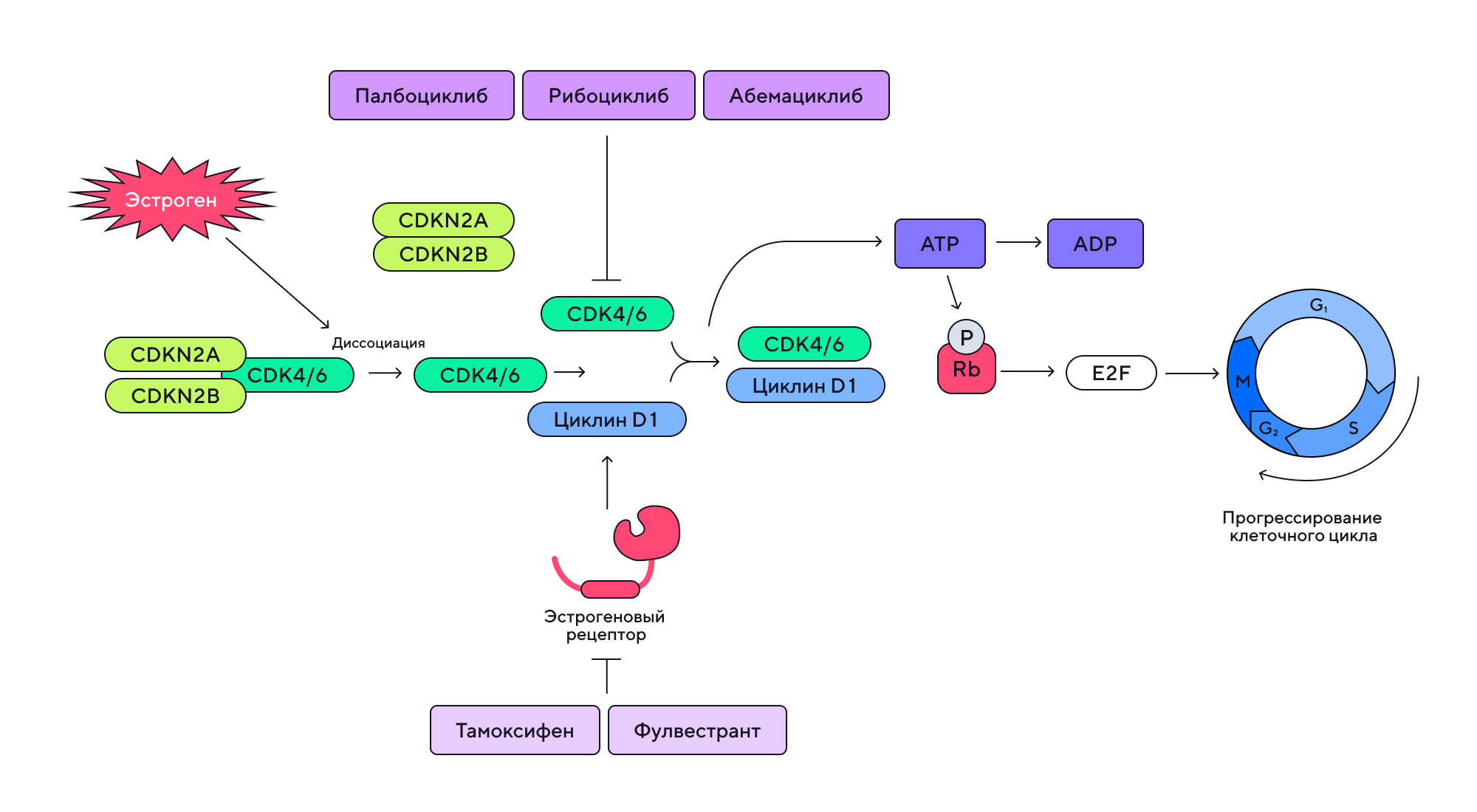
Эстроген-рецептор-положительный рак молочной железы считается одной из наиболее распространенных разновидностей при этом виде злокачественного новообразования. Первоначально для их терапии использовали антиэстрогены (тамоксифен, фулвестрант и другие препараты), однако после появления устойчивости опухолей к ним решили обратиться к другому классу препаратов — ингибиторам CDK4/6. Однако и эти терапевтические препараты требуют внимания из-за своей способности вызывать псевдоострую почечную недостаточность. Источник: адаптировано из MDPI