
Дайджест #1. О рубрике. ТАМ рецепторы, мутация и деградация белков, доставка вакцин и новое о терапии рака
В этом разделе — дайджест новостей биотеха. Тут мы будем делиться с вами свежими идеями, новыми открытиями и биотехнологическими подходами, которые применяют исследователи в лабораториях всех стран. Чаще всего это будут регулярные обзоры статей из журналов серии Nature Reviews — главных научных изданий мира по нашим темам.
О чем будем рассказывать? О генетике, молекулярной биологии, биохимии, биоинформатике, разработке IT-систем, роботизированных производственных технологиях и так далее.
Для кого этот дайджест? В основном для тех, кто уже в теме. Осторожно, написано по-научному! Но если вы только начали изучать биотех — вам тоже будет полезно. Вы узнаете новые термины и рано или поздно заговорите с нами на одном языке, а может даже найдете источник вдохновения для собственных открытий.
В первом дайджесте рассказываем о перспективах применения мишеней для терапии рака, мутациях, ассоциированных с заболеваниями, и новых методах разработки инновационных препаратов.
Онкология, молекулярная биология
Стратегии восстановления р53 для терапии рака
Один из ключевых признаков рака (hallmarks of cancer) — геномная нестабильность — связан с белком р53. В норме этот белок блокирует деление клеток с большим количеством мутаций. Но при генетическом сбое этот супрессор апоптоза инактивируется, что дает «зеленый свет» поврежденным клеткам. Вывод из строя р53 наблюдается почти во всех видах рака и достигается за счет двух основных механизмов: мутации в гене, кодирующем р53, или сверхэкспрессии негативных регуляторов белка р53, MDM2 и MDMX. Но, несмотря на достаточно хорошую изученность, белок р53 сложно использовать в качестве противораковой мишени: он является фактором транскрипции и поэтому долгое время считался неподходящим для терапии. Несмотря на эту сложность, были разработаны несколько стратегий для восстановления функций р53. Так, в мутантных опухолях, экспрессирующих р53, основная стратегия лечения — использовать соединения, действующие на мутации в р53, чтобы восстановить функции этого супрессора опухоли. Также разрабатываются подходы к истощению мутантного р53 либо к устранению уязвимостей, вызванных экспрессией мутантного р53. Еще один подход заключается в том, чтобы защитить p53 от действия MDM2 и MDMX, воздействуя на эти негативные регуляторы с помощью ингибиторов. В новом обзоре детально разбирают как уже существующие, так и альтернативные стратегии воздействия на р53, включая анализ текущих клинических испытаний, основанных на восстановлении функции р53. — Translating p53-based therapies for cancer into the clinic.
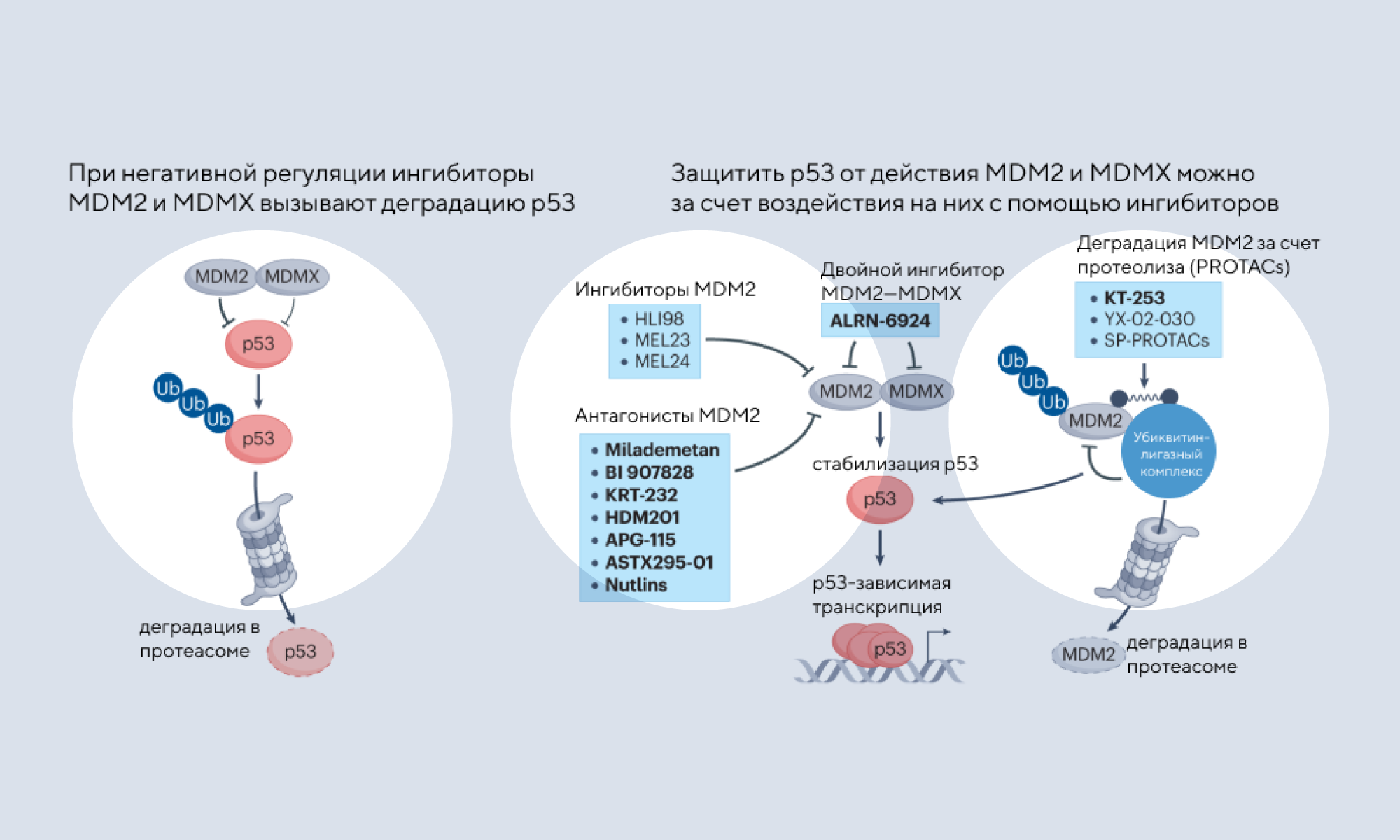
Источник: адаптировано из Nature Reviews Cancer
Исследование мутаций белка CRAF, связанных с раком
Гиперактивация киназ RAF, в частности, BRAF и CRAF, способна приводить к прогрессированию опухоли и развитию лекарственной устойчивости при многих типах рака. Из этих двух белков более изученной считается BRAF-киназа — в том числе благодаря своей высокой частоте мутаций при меланоме. Однако в недавнем исследовании решили сосредоточиться на белке CRAF, чья роль в онкогенезе и лекарственной устойчивости к противоопухолевым препаратам становится все более клинически значимой. В частности, авторы работы суммировали основные известные регуляторные механизмы и изменения генов, активирующие CRAF, и классифицировали мутации этого белка, а также привели результаты доклинических и клинических исследований, которые могут улучшить терапию онкозаболеваний, связанных с мутациями в CRAF. — The role of CRAF in cancer progression: from molecular mechanisms to precision therapies.
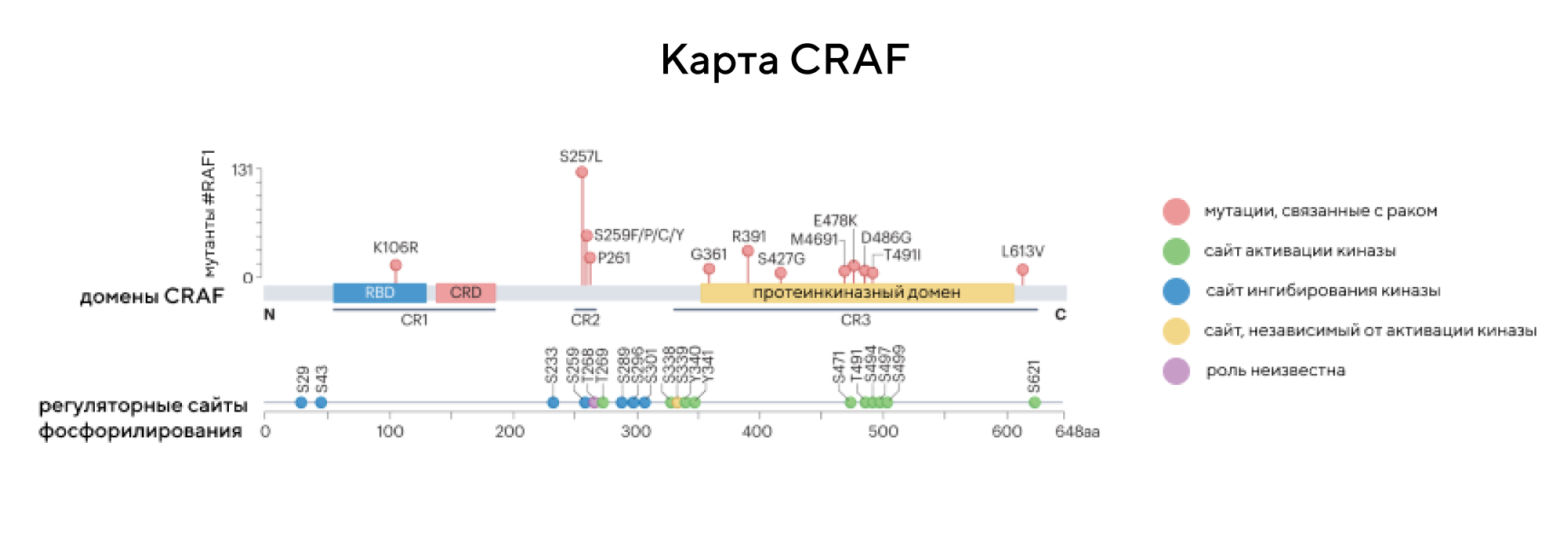
Источник: адаптировано из Nature Reviews Cancer
Перспективы лечения редкого вида карциномы
Один из редких видов рака — адренокортикальная карционома. Эта злокачественная опухоль, развивающаяся из коркового слоя надпочечников. Каждый год в мире выявляют 1–2 новых случая на миллион, причем в перспективе пяти лет выживают менее 60% пациентов. Несмотря на относительно низкую встречаемость, адренокортикальная карционома, как и другие редкие виды рака, встречается примерно у трети пациентов, среди которых ежегодно диагностируют рак. Сложность лечения этого заболевания в том, что на ранних стадиях этот вид карциномы развивается без симптомов, а значит, его трудно диагностировать. Иногда окончательный диагноз ставят уже после операции и возникновения рецидивов или после появления метастазов.
Генетические предпосылки, способные приводить к адренокортикальной карциономе, отличаются в детском и взрослом возрасте. У детей предрасположенность к этому виду рака связана с зародышевыми или соматическими мутациями гена TP53 — и хорошая новость состоит в том, что такие мутации имеют лучший прогноз для последующего лечения. Если же заболевание диагностируется во взрослом возрасте, то оно, как правило, связано с мутациями генов, кодирующих белки разных сигнальных путей: WNT/β-катенина, клеточного цикла и апоптоза p53, ремоделирования хроматина и поддержания теломер, цАМФ-протеинкиназы, А (PKA) или пути транскрипции ДНК и трансляции РНК. Все изученное на сегодняшний день многообразие соматических путей и профили экспрессии генов и микроРНК удалось классифицировать в недавнем обзоре исследователей из Стэнфордского университета — возможно, это позволит улучшить раннюю диагностику пациентов с адренокортикальной карциономой. — Advances in translational research of the rare cancer type adrenocortical carcinoma.
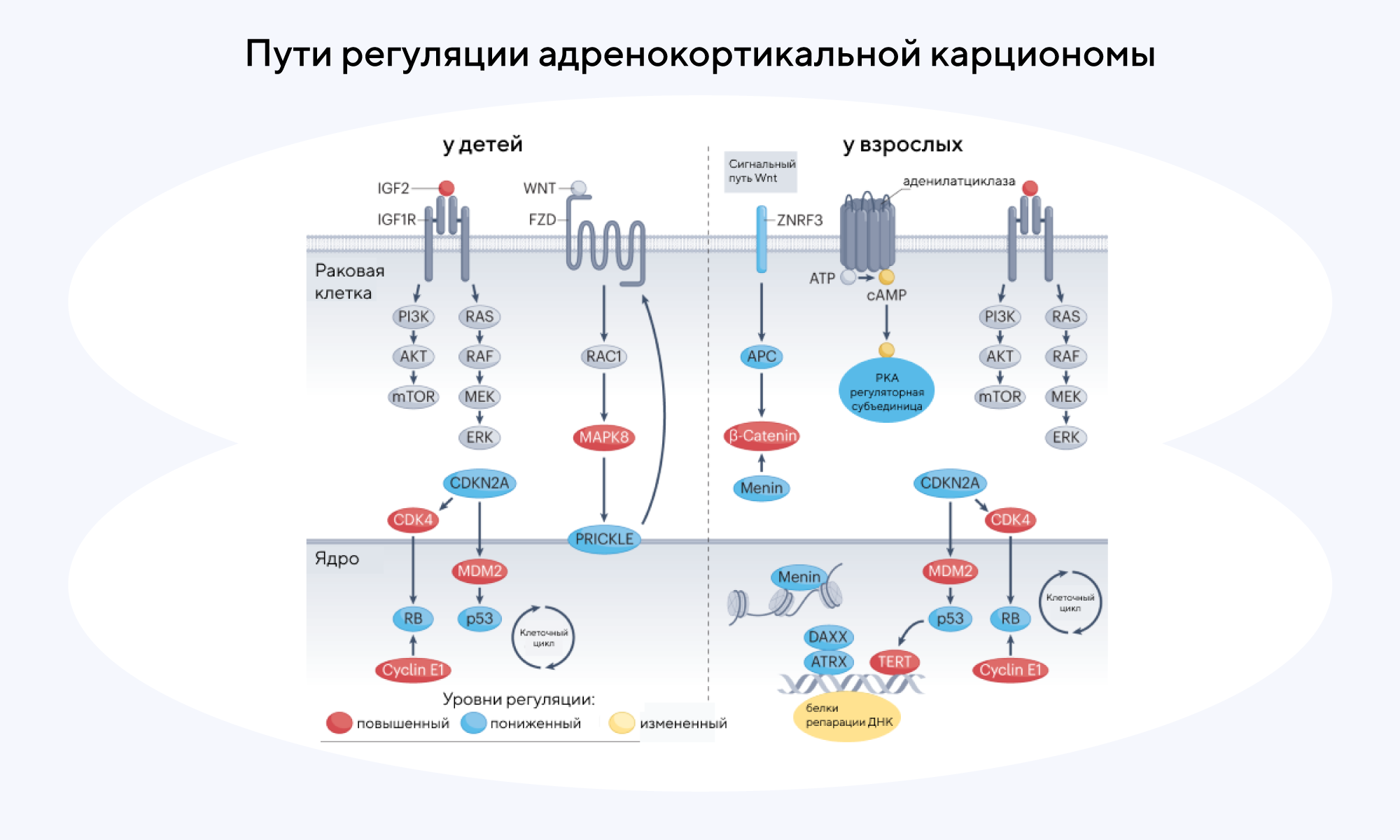
Источник: адаптировано из Nature Reviews Cancer
Сравнение метаболических исследований онкоклеток с клиническими результатами
Центральную роль в злокачественной трансформации и перерождении клеток играют метаболическое перепрограммирование. Чтобы обеспечить стремительный рост и частое деление опухоли, раковым клеткам приходится перестраивать свой обмен веществ. Однако метаболизм опухоли очень непросто оценить, так как он складывается из сложной мозаики внутренних и внешних факторов, так или иначе влияющих на раковые клетки. Из-за этого особенно ценится появление новых и усовершенствование существующих методов для оценки метаболизма раковых клеток в микросреде, связанной с опухолью. В начале 21 века широкое распространились методы диагностики, в которых используются метаболические особенности злокачественных клеток. Один из таких методов — отслеживание стабильных изотопов, который применяют для исследования метаболизма опухоли in vivo. В недавнем обзоре Nature Reviews Cancer описаны подходы к использованию отслеживания изотопов in vivo, чтобы определять метаболические «предпочтения» раковых клеток. Интересно, что новые данные свидетельствуют о корреляции между результатами, обнаруженными с помощью метода стабильных изотопов, с плохими клиническими результатами, которые приводят к прогрессированию рака у пациентов. — Metabolic pathway analysis using stable isotopes in patients with cancer.
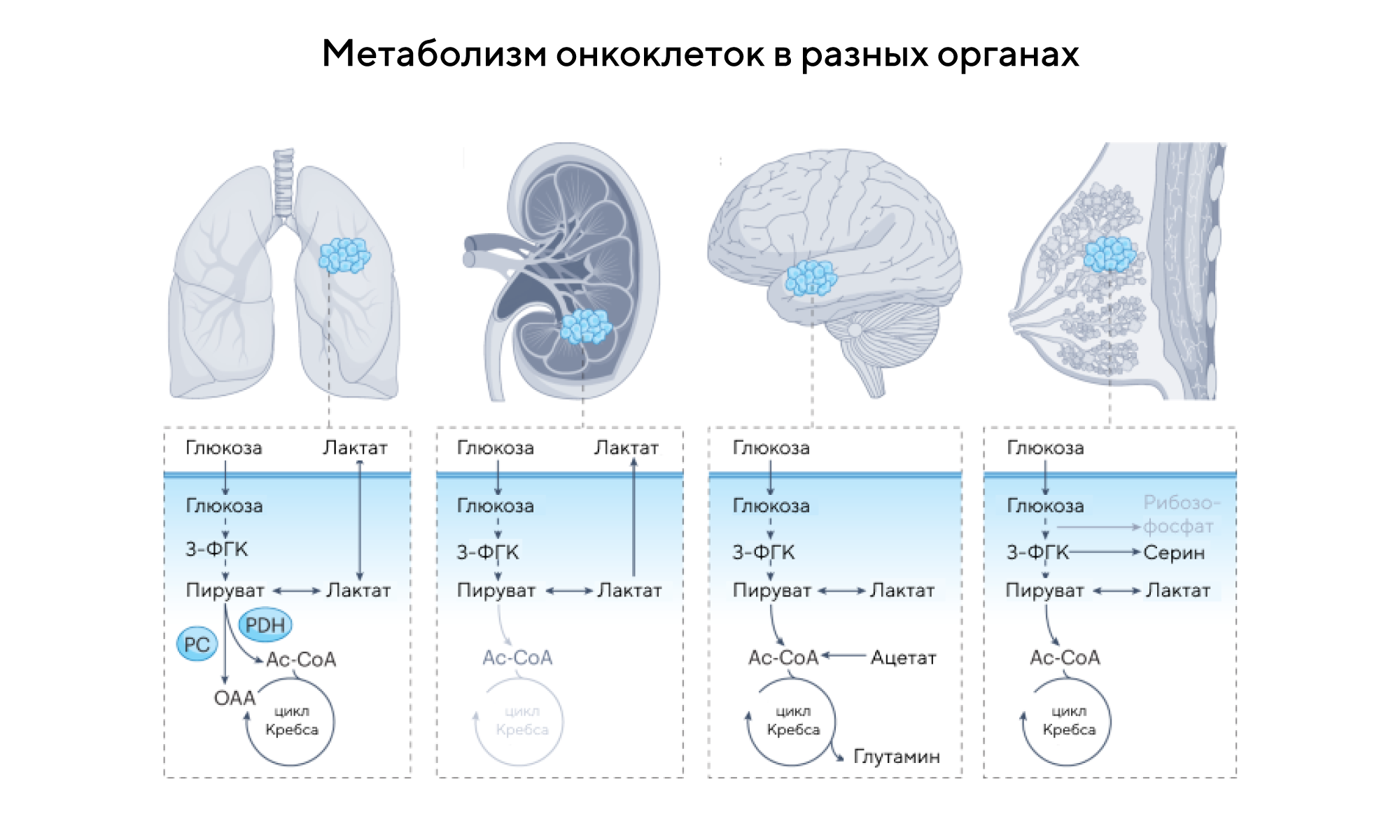
Источник: адаптировано из Nature Reviews Cancer
Иммунология
Взаимодействие Treg-клеток и IL-23 в микроокружении опухоли
Интерлейкин-23 (IL-23) — провоспалительный цитокин, который способствует росту опухоли и коррелирует с неблагоприятными исходами рака. До сих пор было неясно, как IL-23 способствует росту опухоли. Однако недавно выяснилось, что основным источником IL-23 в микроокружении опухолей являются макрофаги, ассоциированные с опухолью. В частности, среди IL-23-чувствительных клеток удалось идентифицировать Т-регуляторные клетки (Treg), инфильтрирующие опухоль. В исследовании с использованием трех доклинических моделей солидного рака было обнаружено, что Treg ответственны за опухолестимулирующий эффект IL-23. Это открывает новые возможности для разработки способов повышения противоопухолевого иммунитета, связанных с воздействием на IL-23/IL-23R. — IL-23 stabilizes an effector Treg cell program in the tumor microenvironment.
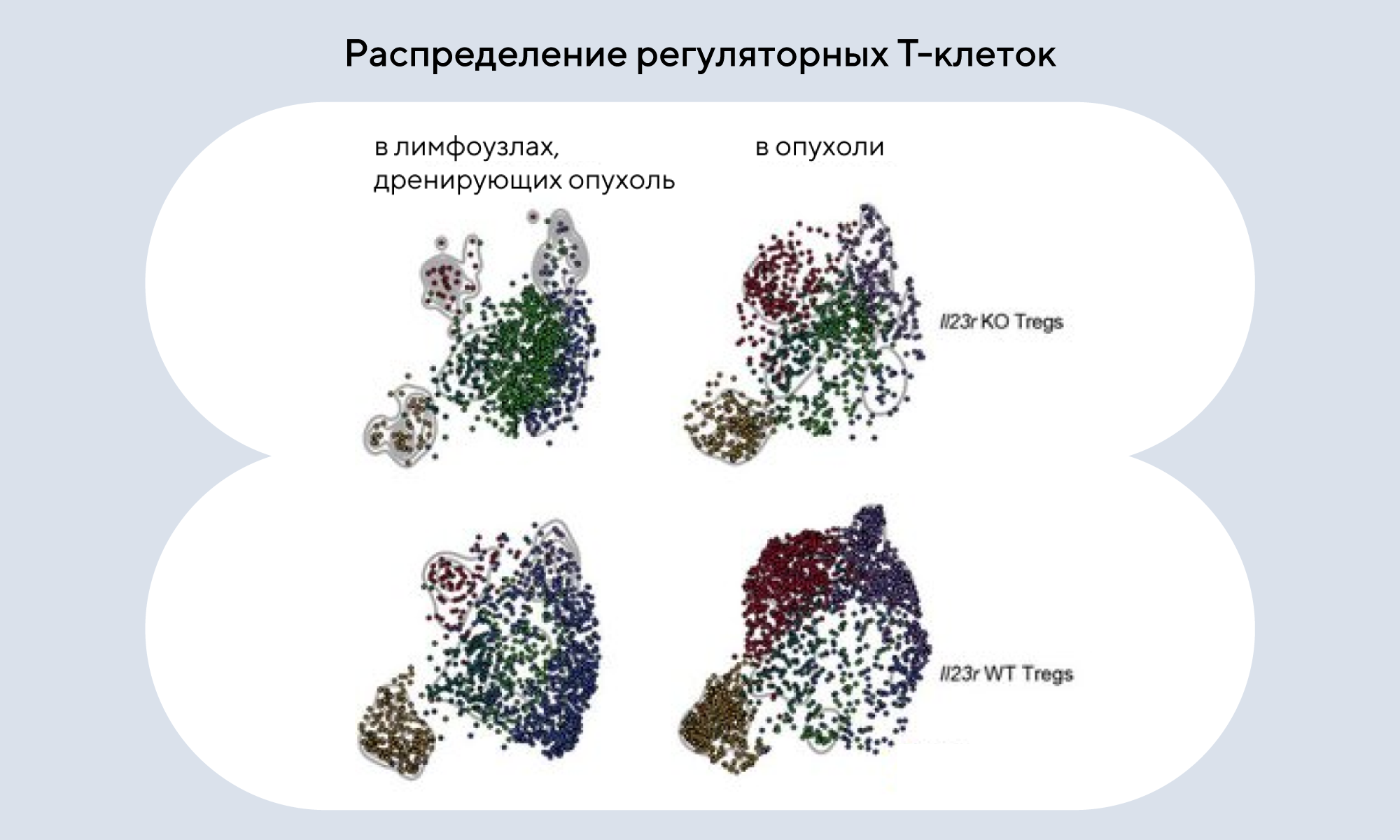
Источник: адаптировано из Nature Immunology
Восстановление последствий артрита с помощью CD200+ фибробластов
Фибробласты — важные регуляторы воспаления, однако неясно, происходит ли смена их фенотипа при воспалении. С помощью метода позитронно-эмиссионной томографии удалось визуализировать белок-активатор фибробластов in vivo при воспалении у людей. Так, у пациентов с артритом наблюдается высокая концентрация этого белка, однако его количество снижается после ингибирования фактора некроза опухоли и интерлейкина-17А. Результаты исследований показали, что снижение сигнала белка-активатора фибробластов отражает фенотипический переход от провоспалительных фибробластов MMP3+/IL6+ к восстановленной форме фибробластов CD200+DKK3+. Транскриптомный анализ суставов показал, что провоспалительные фибробласты колокализованы вместе с воспалительными иммунными клетками, а противовоспалительные фибробласты кластеризуются с врожденными лимфоидными клетками 2 типа. При этом фибробласты CD200+DKK3+ стабилизировали фенотип врожденных лимфоидных клеток 2-го типа и восстанавливали последствия артрита. Эти результаты открывают перспективы молекулярной регуляции для лечения воспалительных заболеваний. — CD200+ fibroblasts form a pro-resolving mesenchymal network in arthritis.
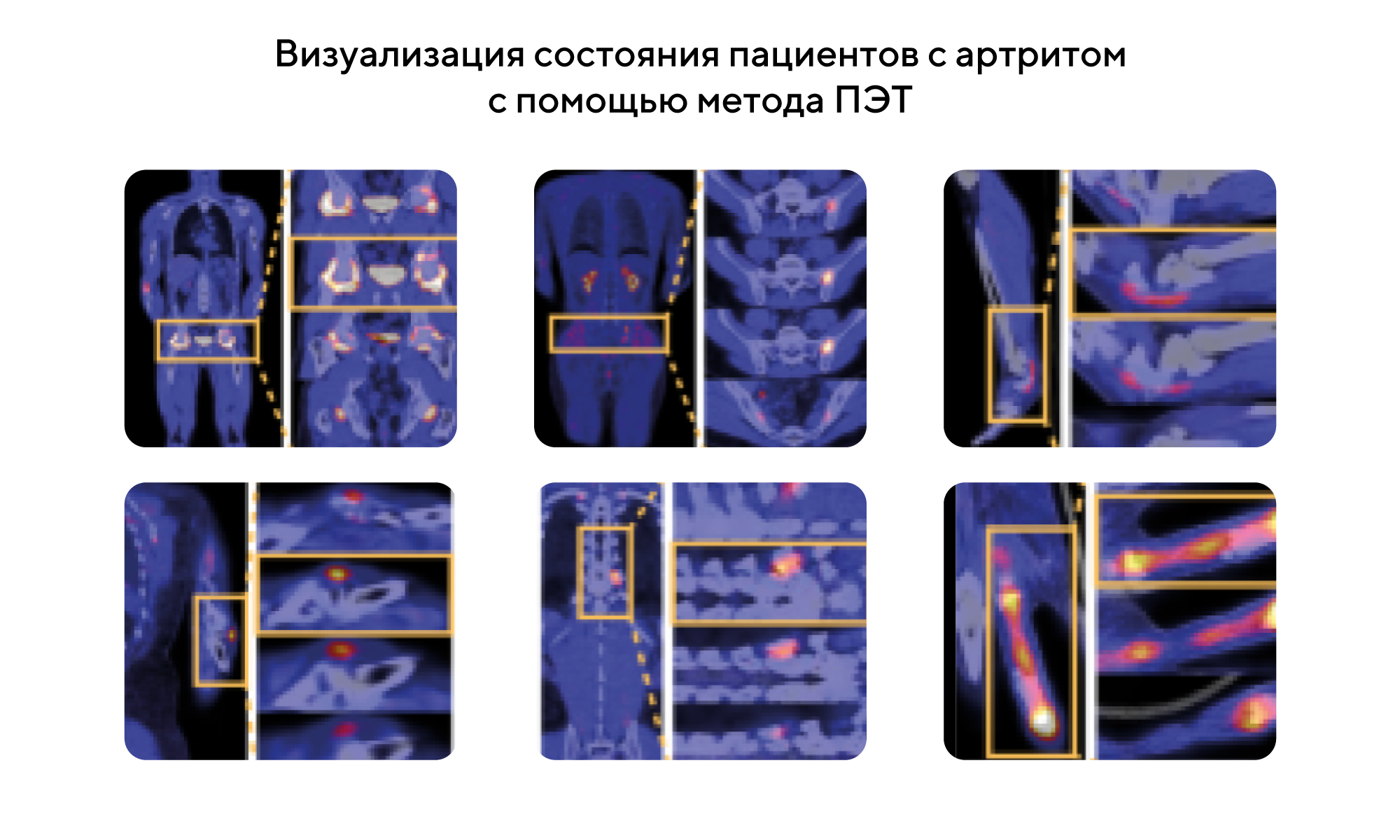
Источник: адаптировано из Nature Immunology
Разработка лекарств
Стратегии усовершенствования мРНК-вакцин
Одна из популярных технологий разработки вакцин -вакцины на основе мРНК с липидными наночастицами. Но, несмотря на свою популярность во время пандемии COVID-19, мРНК-вакцины вызывают ряд вопросов, связанных с потенциальной токсичностью из-за методов их производства и очистки. В новом исследовании обсуждают проблемы, связанные с распределением компонентов таких вакцин, которые могут приводить к их возможной реактогенности. Фокус этой работы — в изучении потенциальных побочных эффектов применения мРНК-вакцин, а также в перспективах и ограничениях существующих моделей и инструментов производства вакцин. — Strategies to reduce the risks of mRNA drug and vaccine toxicity.
Источник: адаптировано из mRNA vaccines and their delivery strategies: A journey from infectious diseases to cancer
Терапия рака через ингибиторы ТАМ-рецепторов
ТАМ-рецепторы регулируют тканевой и иммунный гомеостаз — передача сигналов рецепторами этого семейства связана с развитием ряда заболеваний, в числе которых рак и вирусные инфекции. Так, нарушение регуляции ТАМ-рецепторов может усиливать рост опухоли и вызывать метастазирование; это происходит из-за участия этих рецепторов во множестве онкогенных путей. В частности, ТАМ-рецепторы участвуют в эпителиально-мезенхимальном переходе, поддержании фенотипа стволовых клеток, иммунной модуляции, пролиферации и ангиогенезе. Потенциально ингибиторы ТАМ-рецепторов можно использовать в доклинической и клинической разработке для терапии рака. Чтобы обобщить информацию о терапевтическом ландшафте этих ингибиторов и оценить их клинический потенциал для лечения онкологических заболеваний, в Nature Reviews Drug Discovery опубликовали обзор, посвященный семейству ТАМ-рецепторов. — Therapeutic targeting of the functionally elusive TAM receptor family.
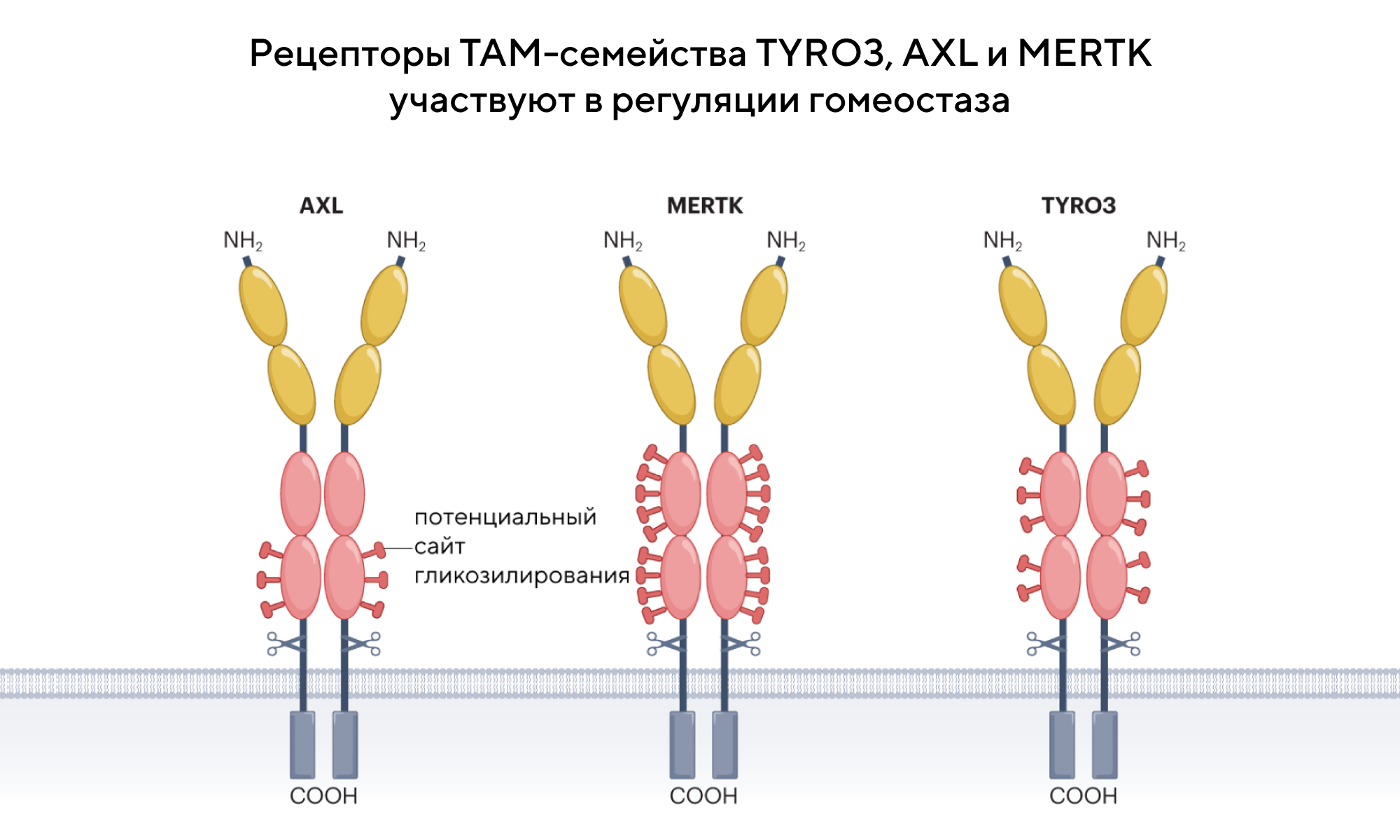
Источник: адаптировано из Nature Reviews Drug Discovery
Направленная деградация белков вне клеток
Таргетная деградация белков (targeted protein degradation, TPD) позволяет удалять внутриклеточные белки с помощью биспецифических молекул. Этот подход основан на рекрутировании белка интереса в лигазу E3 для дальнейшей деградации в протеасоме. Внутриклеточная таргетная деградация белка происходит каталитически, что потенциально может быть более эффективным и устойчивым методом при более низких дозах препарата. Однако недавно такой подход применили и в отношении внеклеточных белков, включая и секретируемые, и мембранные протеины. Для этого используют биспецифические антитела, конъюгаты или небольшие молекулы для деградации внеклеточных белков интереса, доставляя их в лизосомы для дальнейшей деградации. В новом обзоре рассматривают последние достижения в области направленной деградации белков, включая потенциальные мишени и системы деградации. — Extracellular targeted protein degradation: an emerging modality for drug discovery.
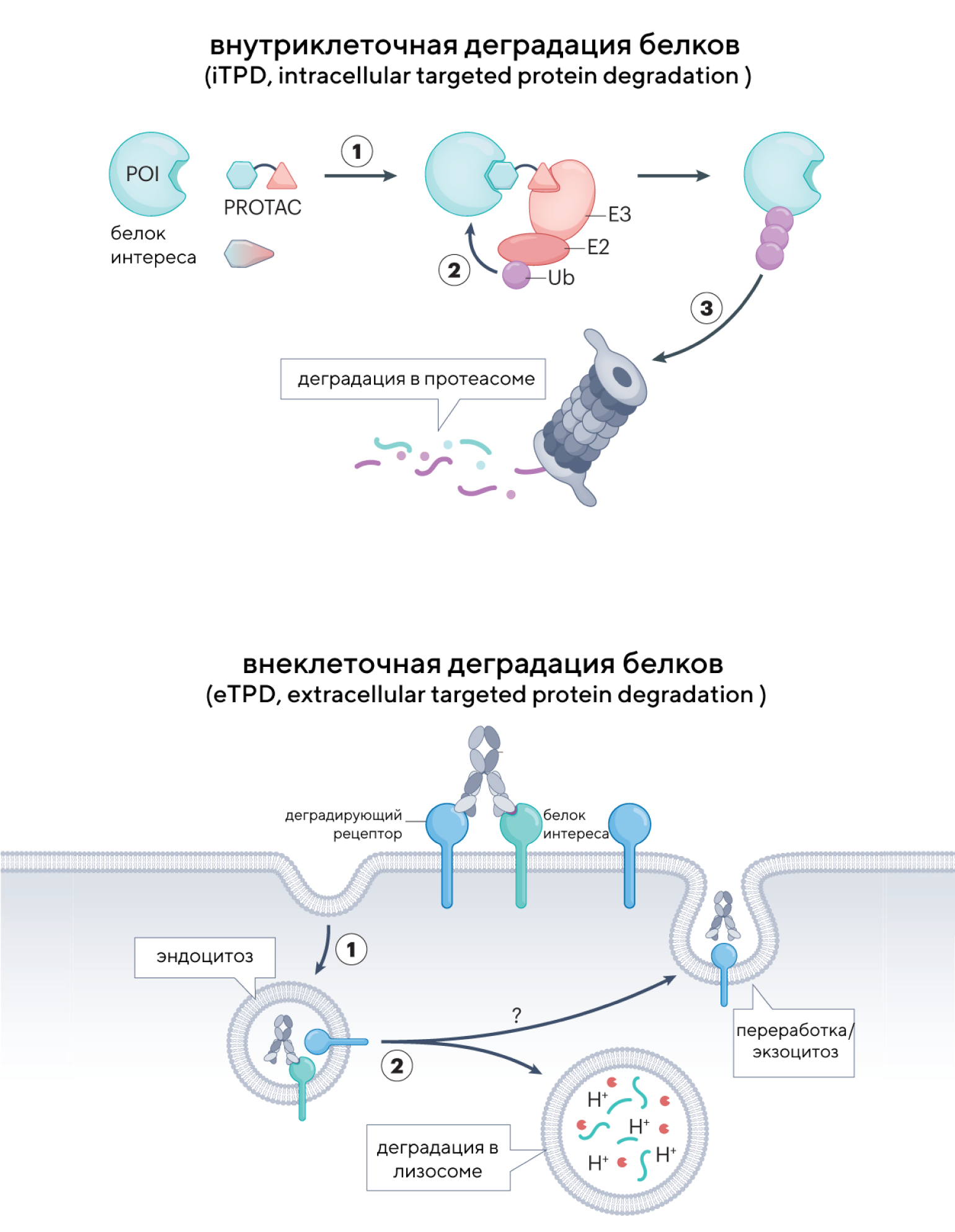
Источник: адаптировано из Nature Reviews Drug Discovery
тРНК-терапия генетических заболеваний
В последнее время появляется все больше исследований, посвященных терапевтическому потенциалу тРНК для лечения заболеваний, связанных с изменениями в мРНК. Разработка тРНК, способных распознать преждевременную остановки трансляции мРНК из-за наличия нонсенс-мутаций, может восстановить синтез и функцию белка. Также тРНК могут противодействовать эффектам точечных миссенс-мутаций в белках. В новом обзоре представлены достижения в области разработки терапии на основе тРНК, а также обсуждаются пока еще не решенные проблемы этой области лечения: эффективность и стабильность тРНК in vivo, конструирование систем доставки и надежное производство. — tRNA therapeutics for genetic diseases.
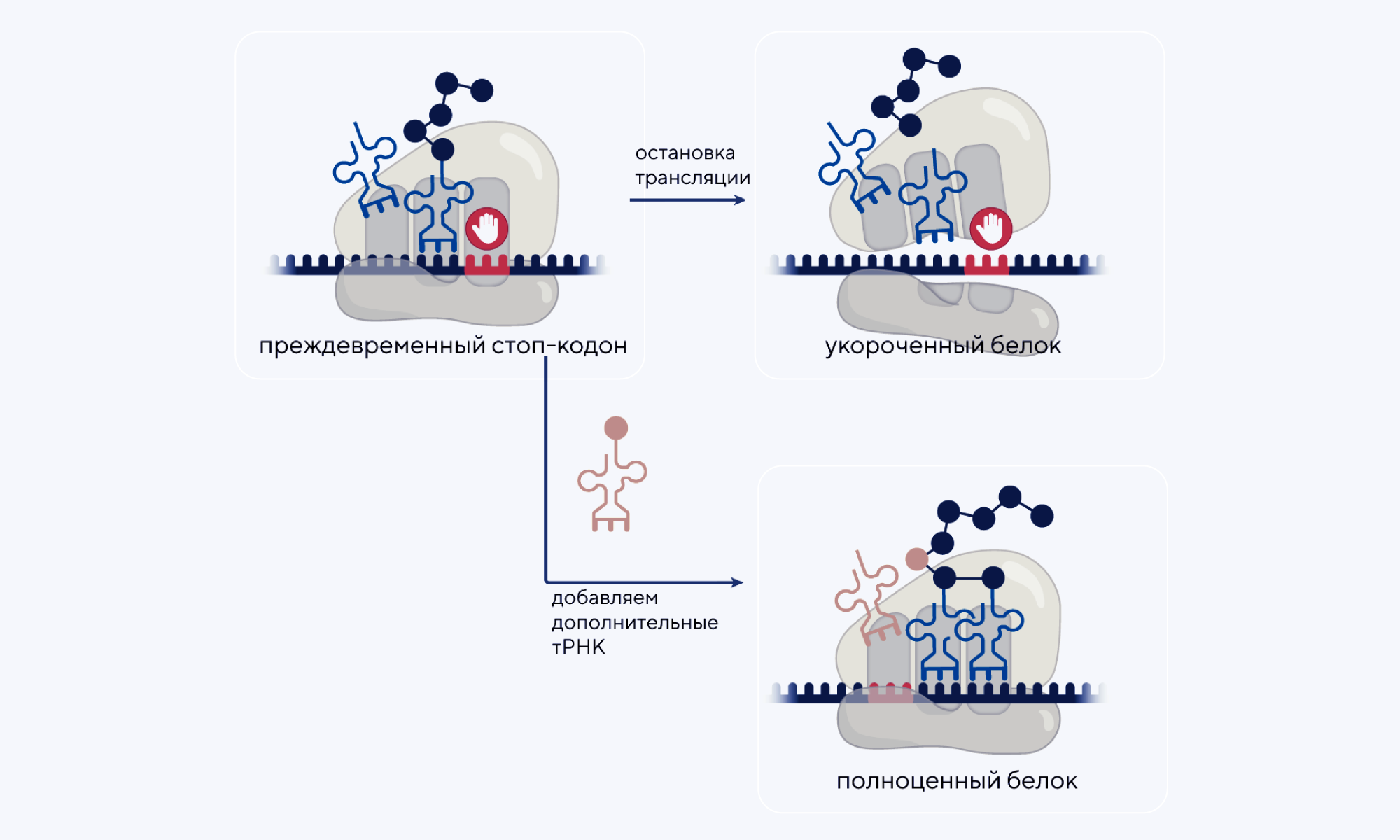
Источник: адаптировано из Nature Reviews Drug Discovery
