Дайджест #13. Коварная аминокислотная замена
При ревматоидном артрите иммунные клетки атакуют собственные суставы, вызывая отеки и деформацию. Свой вклад в развитие этой болезни вносят и особые антитела к цитруллинированному пептиду. Что это за соединение, почему из-за него уже свернутые белки становятся как бы «чужими» и какую роль в развитии ревматоидного артрита играет слизистая полости рта — читайте в новом дайджесте.
Онкология, генная терапия
Нестандартное нацеливание на опухолевые клетки
Эмбриональные клетки сходны с онкоклетками рядом молекулярных механизмов — и те, и другие способны много делиться и экспрессировать похожие белки. Это сходство можно использовать для прицельного нацеливания на опухоли, используя специфические компоненты, которых нет во взрослых здоровых тканях. Один из таких компонентов, который экспрессируют онкоклетки, — онкофетальный хондроитинсульфат. Сам по себе хондроитинсульфат во взрослом здоровом организме — это углеводный полимер, который входит в состав хряща. А в пораженных тканях онкофетальный хондроитинсульфат участвует в прогрессировании опухоли и способствует метастазированию. Недавно исследователи из Дании с помощью фагового дисплея отобрали, а затем охарактеризовали несколько фрагментов антител, специфично связывающихся с двумя эпитопами онкофетального хондроитинсульфата. Дальнейшие исследования in vitro и in vivo продемонстрировали высокую аффинность этих фрагментов в отношении широкого спектра солидных опухолей. Таким образом, антитела, специфичные к онкофетальному хондроитинсульфату, способны нарушать прогрессирование опухоли — это уже удалось продемонстрировать на моделях рака мышей, — что открывает новую перспективную терапию рака. — Tumor-agnostic cancer therapy using antibodies targeting oncofetal chondroitin sulfate.
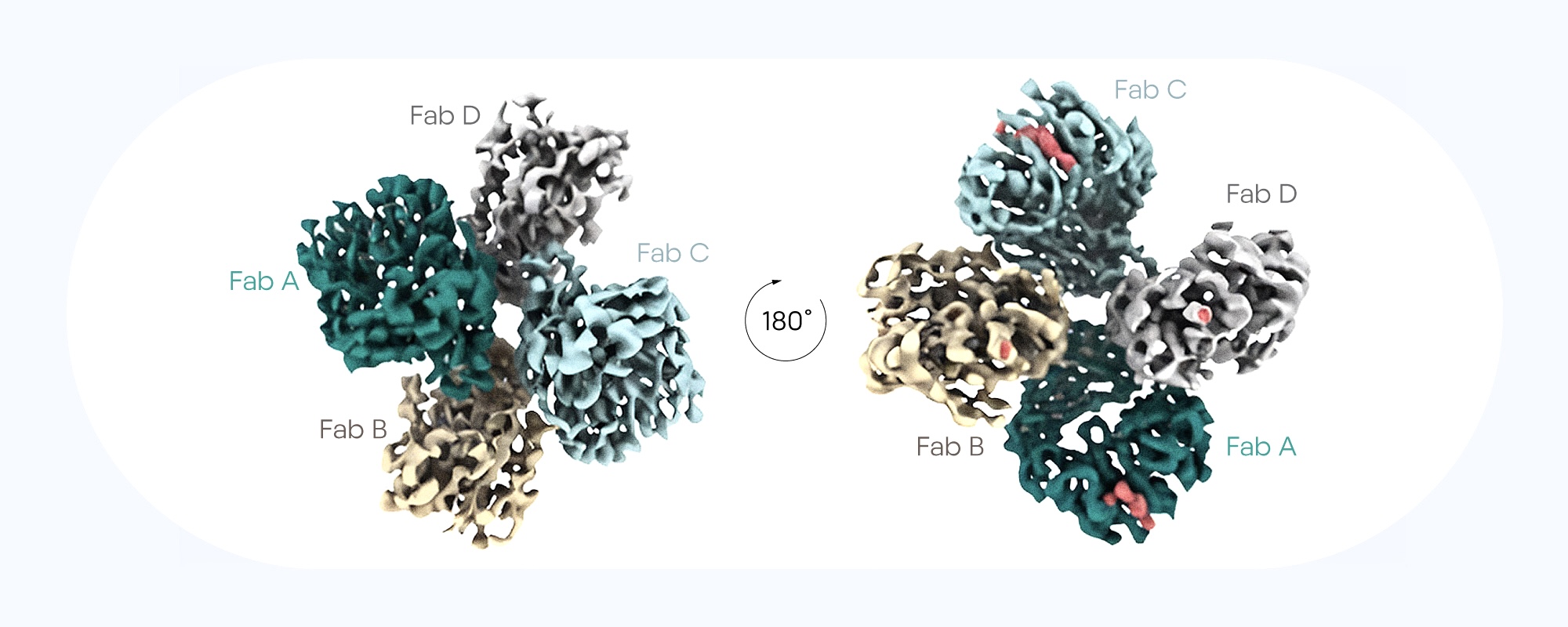
В исследовании использовали Fab-фрагменты антител, которые специфичным образом связываются с онкофетальным хондроитинсульфатом. Источник: Nature Communications
Как и зачем изменять микроокружение опухоли
Важный компонент опухоли — ее микроокружение, включающее кровеносные сосуды, внеклеточный матрикс, сигнальные молекулы, да и другие клетки. Микроокружение способно влиять на опухоль, провоцируя ее рост и метастазирование. Поэтому важную роль в изучении новых способов терапии рака отводят внеклеточным компонентам, влияющим на опухолевое микроокружение. Среди них — опухоль-ассоциированные фибробласты, которые способны обеспечивать резистентность опухоли к терапии. В новом обзоре объясняют, как устроены сложные взаимоотношения между фибробластами, раковыми и иммунными клетками, а также как можно влиять на функции Т-клеток, нацеливая их на опухоль. — CAF-induced physical constraints controlling T cell state and localization in solid tumours.
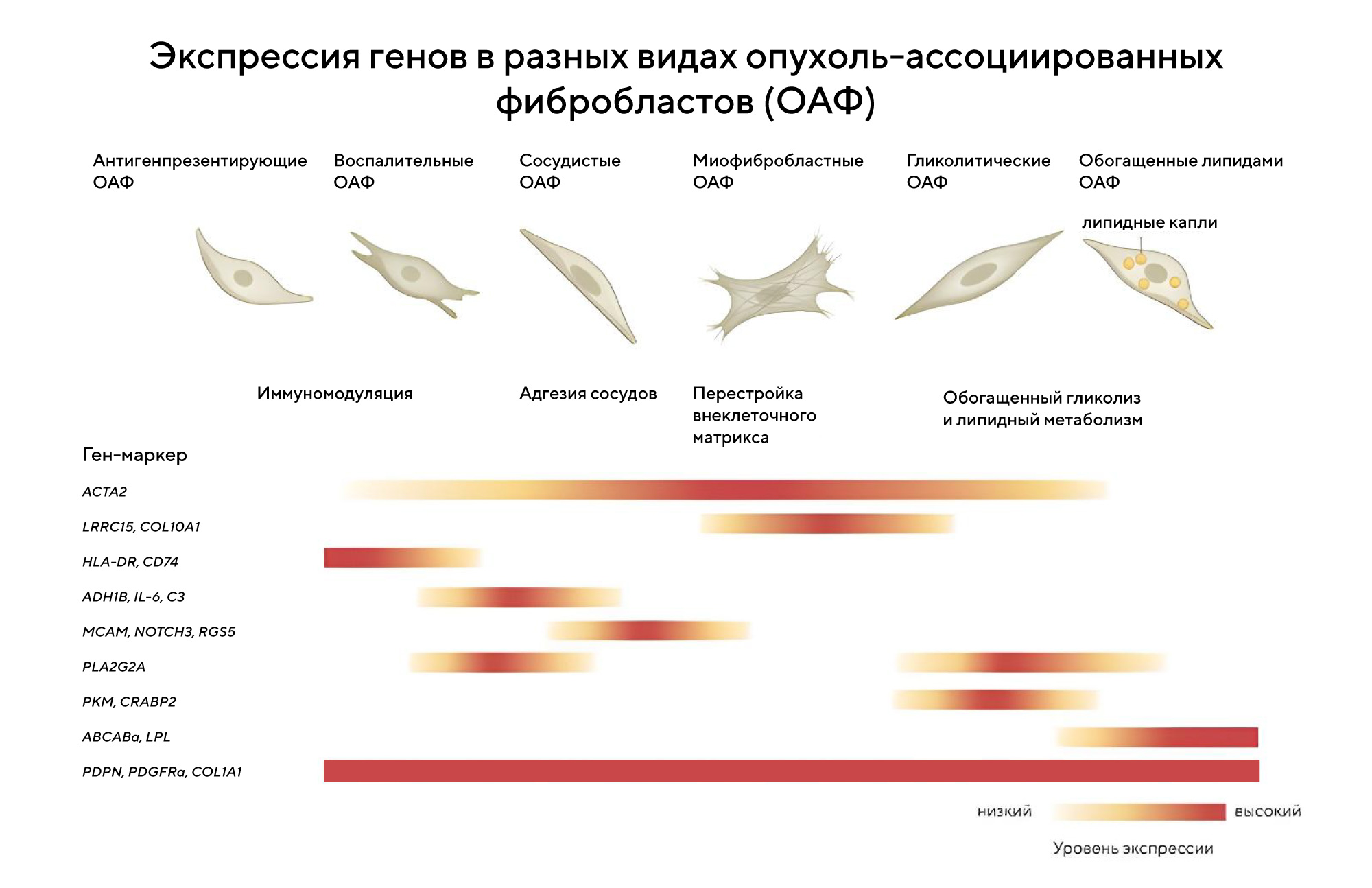
В разных видах опухоль-ассоциированных фибробластов по-разному экспрессируются гены: например, маркер образования фибробластов ACTA2 больше экспрессируется в фибробластах, ответственных за внеклеточные перестройки. Источник: Nature Reviews Cancer
Ингибирование онкогенов для генной терапии рака
Нарушение регуляции транскрипционного фактора NF-κB провоцирует воспаление, аутоиммунные заболевания и даже развитие рака. Кажется, что этот фактор давно должен был стать таргетной мишенью для лечения онкологических и других заболеваний, но этого до сих пор не удалось достичь. Это осложняется множеством побочных эффектов, которые вызывают разработанные и протестированные ингибиторы NF-κB. В новой работе китайские исследователи представили результаты неклассического подхода с участием NF-κB — сконструированный вектор получил многообещающее название HOPE. В отличие от классических методов, при которых ингибировали активность NF-κB, в альтернативном подходе сфокусировались на активации экзогенного эффекторного гена CRISPR-Cas13a в раковых клетках за счет использования специфического для NF-κB промотора DMP. Он нацеливается и подавляет экспрессию онкогенов TERT, PLK1, KRAS и MYC на уровне мРНК. Особенность вектора HOPE — в его таргетности: опыты на культурах клеток показали, что погибают именно онкоклетки, а не какие-либо другие. После клеточных экспериментов HOPE перешли к экспериментам in vivo: упаковали в вектор на основе аденоассоциированного вируса (AAV) и ввели его мышам с моделью колоректального рака. Результаты подтвердили, что rAAV-HOPE значительно подавляет рост опухоли, не вызывая значимых побочных эффектов. Это делает новый подход потенциально интересной технологией для генной терапии рака. — NF-κB-activated oncogene inhibition strategy for cancer gene therapy.
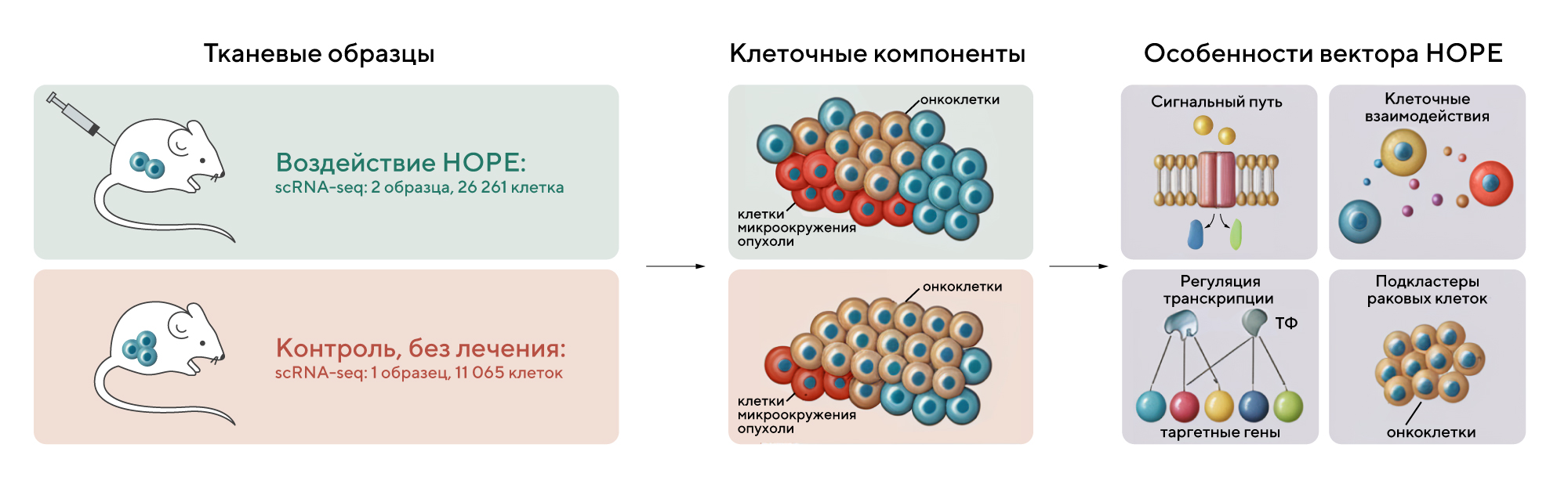
Схема эксперимента по сбору данных и анализу scRNA-seq для определения в клетках микроокружения опухоли изменений, происходящих под воздействием вектора НОРЕ. Источник: Cancer Gene Therapy
Новая мишень для лечения рака печени
Гепатоцеллюлярная карцинома — наиболее распространенная первичная злокачественная опухоль печени. В новом исследовании изучали роль гена HN1 в развитии этого вида рака. Повышенная регуляция этого гена ранее уже была подтверждена при других онкологических заболеваниях, что и сделало HN1 объектом исследования. Такая же закономерность распространяется и на гепатоцеллюлярную карциному: сверхэкспрессия HN1 способствует пролиферации и инвазии раковых клеток, а также причастна к дальнейшему метастазированию. Результаты исследований показали, что подавление HN1 снижает жизнеспособность онкоклеток, а также уменьшает вероятность распространения метастазов. Также любопытной оказалась взаимосвязь между подавлением HN1 и снижением экспрессии генов SREBP1 и SREBP2 — они кодируют соответствующие белки, связанные с производством стерола и жирных кислот. Более того, HN1 запускает сигнальный путь Akt, способствуя образованию опухолей посредством липогенеза, который контролируется SREBP1. Все эти результаты подчеркивают роль HN1 в качестве потенциальной терапевтической мишени для лечения гепатоцеллюлярной карциномы. — HN1-mediated activation of lipogenesis through Akt-SREBP signaling promotes hepatocellular carcinoma cell proliferation and metastasis.
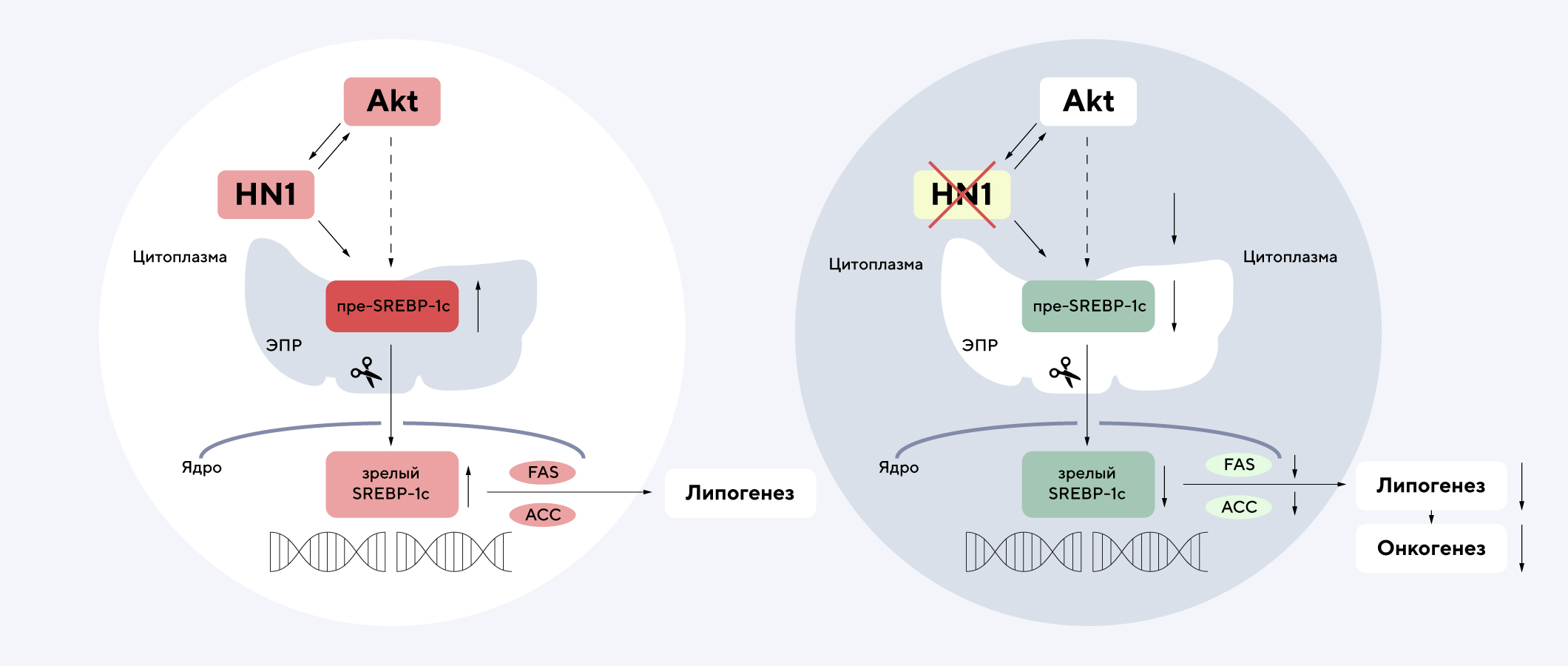
«Выключение» HN1 блокирует процессы липогенеза и последующего онкогенеза, что делает HN1 потенциальной мишенью при терапии гепатоцеллюлярной карциномы. Источник: Cancer Gene Therapy
Аутоиммунные заболевания
Как воспаление слизистой оболочки и микробиом связаны с ревматоидным артритом
У пациентов с ревматоидным артритом обнаруживаются определенные маркеры заболевания, среди которых антитела к циклическому цитруллинированному пептиду (АЦЦП). Цитруллин —одна из аминокислот организма, которая образуется из аргинина уже после синтеза белка. Из-за того, что замена одной аминокислоты на другую происходит уже в готовой молекуле, формируется необычная пространственная структура белка. В результате белок становится как бы «чужеродным» для собственной иммунной системы, и к нему образуются аутоантитела. Люди, серопозитивные по АЦЦП, входят в зону риска: у них в течение 3–5 лет может развиться ревматоидный артрит. В новом исследовании оценивали как раз таких людей, для которых ранее была показана взаимосвязь между воспалением слизистой оболочки легких с локальной продукцией АЦЦП и других ревматоидных факторов. Сравнение двух подгрупп — пациентов с ревматоидным артритом и людей из группы риска, серопозитивных по АЦЦП, — показало: и у тех, и у других в фекальной микробиоте обнаружен один и тот же бактериальный штамм, проявивший артритогенную активность на животных моделях. Но на этом дело не остановилось: в дополнение к уже имеющимся данным о возможной взаимосвязи между воспалением слизистых и развитием ревматоидного артрита удалось показать, что воспаление пародонта и особый состав микробиоты ротовой полости также способствуют развитию ревматоидного артрита. Получается, что слизистые оболочки и связанный с ними микробиом с конкретными штаммами могут запускать ревматоидный артрит за счет механизмов патогенеза. Эти результаты могут повлиять на разработку новых методов для профилактики и борьбы с ревматоидным артритом. — Distinct mucosal endotypes as initiators and drivers of rheumatoid arthritis.
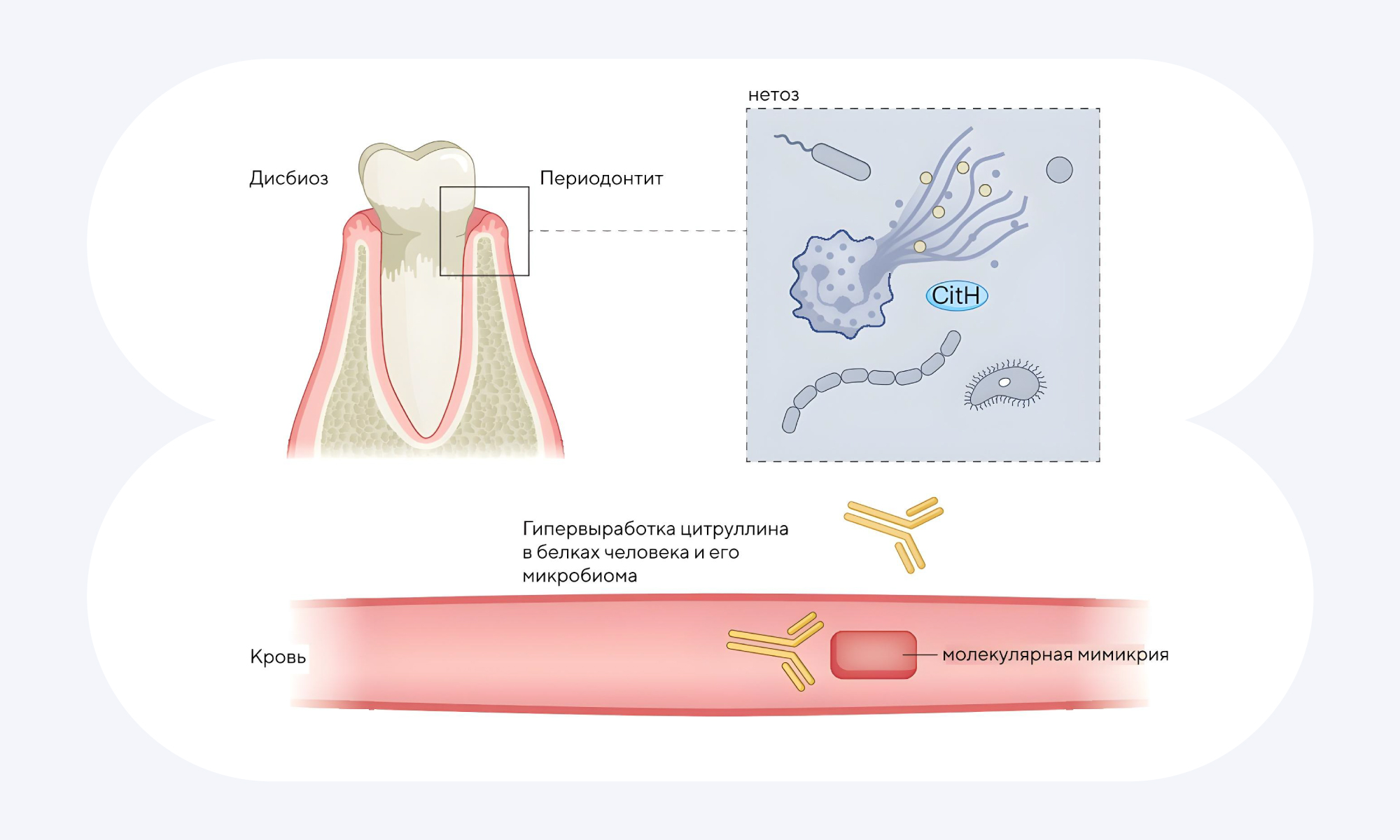
При периодонтите происходит нарушение целостности ткани в области связочного аппарата зуба, из-за чего запускается механизм борьбы с патогеном — нетоз. Нейтрофилы выбрасывают своеобразные ловушки — NETs, которые должны опутать чужеродный патоген. Однако часто это запускает аутоиммунные реакции, которые могут приводить к развитию аутоиммунных заболеваний. Источник: Nature Reviews Rheumatology
Тау-белок как новый маркер рассеянного склероза
Один из важных механизмов нейродегенерации — неправильное сворачивание белков. Пожалуй, самый известный из них — тау-белок, ассоциированный с микротрубочками. Этот белок можно найти в первую очередь в мозге, где он стабилизирует микротрубочки нейронов. Однако при избыточном фосфорилировании тау-белка он образует нейрофибриллярные клубки, что является важным признаком болезни Альцгеймера. Недавно выяснилось, что неполадки с тау-белком могут считаться маркером и другого нейродегенеративного заболевания — рассеянного склероза. В новом исследовании замеряли уровни тау-белка в спинномозговой жидкости и обнаружили взаимосвязь между повышением тау-белка и развитием нескольких фенотипов рассеянного склероза. — Tau phosphorylation correlates with multiple sclerosis disease course.
Фосфорилирование — типичная посттрансляционная модификация тау-белка, необходимая для связывания микротрубочек и их удержания вместе. Но иногда обычная программа дает сбой, и тау-белок гиперфосфорилируется, теряя свои конструктивные функции и провоцируя развитие нейродегенеративных заболеваний. Источник: «Википедия»