
Эволюция борьбы с опухолями: как развиваются технологии лечения онкологических заболеваний
История лечения онкологических заболеваний насчитывает множество взлетов и падений. Еще сравнительно недавно злокачественные новообразования лечили исключительно методами радио- и химиотерапии, но уже в конце XX века на арену вышел новый игрок — таргетная терапия. И если химиотерапию, которая была и остается одним из самых известных направлений медицинского вмешательства при злокачественных опухолях, можно сравнить с «острым мечом», способным «разрубить» все подряд, то таргетные препараты на основе биофармацевтических и наноинженерных технологий — это «снайперская винтовка с GPS-навигатором», поражающая врагов точно в цель, минуя здоровые клетки.
4 февраля, во Всемирный день борьбы с онкологическими заболеваниями, особенно важно говорить о подходах, которые меняют само представление о лечении рака. Вот почему многие фармацевтические компании, в том числе и BIOCAD, разрабатывают препараты для «прицельной» терапии. В этом обзоре попробуем разобраться, за какими горизонтами кроется будущее таргетной терапии и стоит ли ожидать в ближайшем будущем выхода на рынок препаратов для лечения генетических поломок при онкологических заболеваниях.
От припарок до пробирок: как эволюционировали способы лечения опухолей
Злокачественные новообразования, которые в повседневном обиходе часто называют упрощенным термином «рак», — это целая группа патологий с рядом типичных особенностей. Среди наиболее распространенных признаков опухолевой ткани — быстрое и бесконтрольное разрастание, способность к метастазированию и определенная устойчивость к лечению. Об этих свойствах знали еще древние врачеватели, жившие задолго до нашей эры, и пытались лечить опухоли подручными средствами вроде припарок с лечебными травами, если верить свидетельствам — знаменитому папирусу Эберса и менее известному «Хирургическому папирусу». Также в ходу были попытки хирургического удаления новообразований и использование ядов наподобие мышьяка и ртути, которые скорее создавали видимость лечения, поскольку были направлены против внешних проявлений, а не настоящей причины болезни. Эти нехитрые средства сохранялись в обиходе врачей вплоть до конца XIX века, пока на помощь не пришли рентгеновские лучи, положившие начало лучевой терапии. И несмотря на ограничения применения радиоактивного излучения в медицине, эти методы продолжают совершенствоваться — стоит вспомнить хотя бы разработку CyberKnife («КиберНож»).
Если же говорить о фармацевтических, а не о физических способах терапии рака, то переломным моментом можно назвать изобретение химиотерапевтических препаратов. Первым цитостатическим препаратом стал хлорметин — производное иприта, противоопухолевую активность которого активно исследовали в 1940-е гг. американские фармакологи. Введение этого вещества пациенту с лимфосаркомой, известному под инициалами J. D., показало уменьшение и даже полное исчезновение некоторых опухолей. К сожалению, успех лечения этого пациента был кратковременным, но в истории изучения препаратов против рака появилась новая веха. Впоследствии, с открытием структуры молекулы ДНК и прогрессом в молекулярной биологии, выяснились подробности действия подобных веществ: они связывают ДНК делящихся клеток, в том числе опухолевых, нарушая их функции и останавливая рост.
Стандартом химиотерапии в 1950-70-х гг. стали цитостатические препараты, такие как циклофосфамид и цисплатин, которые в сочетании с антиметаболитами (метотрексат) и антрациклиновыми антибиотиками (доксорубицин), направленными на замедление или прекращение роста опухолевых клеток, активно назначались пациентам с опухолями.
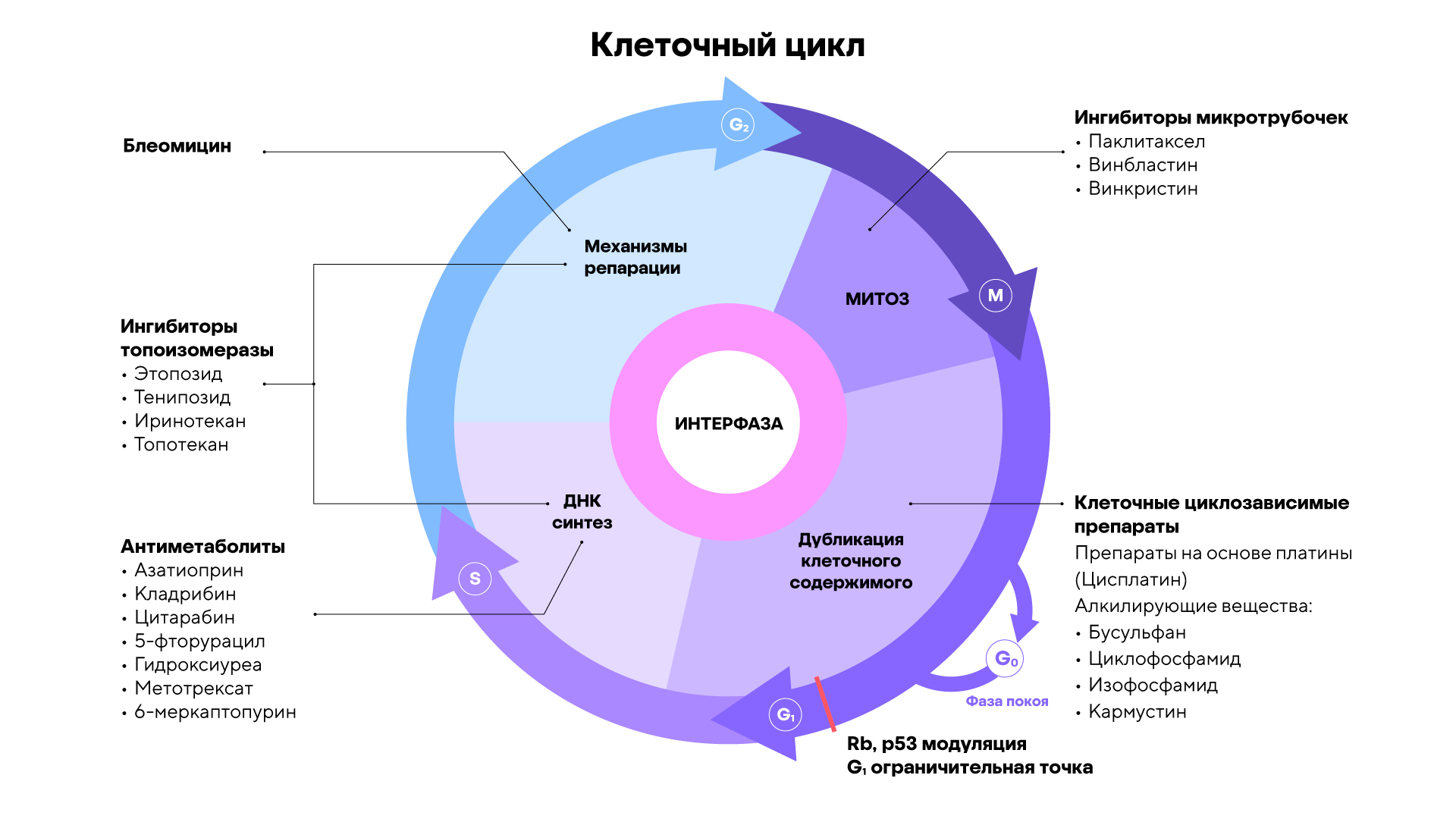
Механизм действия многих химиотерапевтических препаратов основан на их воздействии на определенную стадию клеточного цикла. Это приводит к остановке деления и последующей гибели опухолевых клеток
Однако существенным минусом химиотерапевтических средств оставалась их «неразборчивость»: они готовы уничтожать как опухолевые, так и здоровые клетки с высокой регенераторной активностью. Из-за этого у пациентов возникает множество побочных эффектов, включая тошноту, выпадение волос и подавление иммунитета. Вот почему врачи и исследователи стали задумываться над разработкой более точного и прицельного оружия против опухолей. И такая возможность появилась: в 1980–1990-х годах, с развитием методов молекулярной биологии, на арену вышли более современные точечные средства терапии.
Терапевтические антитела: как прицельно сражаться с опухолью
Передовым средством в борьбе со злокачественными новообразованиями стали биологические молекулы — особым образом сконструированные антитела, нацеленные на конкретные мишени в опухолевых клетках. Именно антителам довелось стать удачным инструментом в борьбе с опухолевыми клетками. Причина — в их высокой избирательности: антитела не затрагивают здоровые ткани, нацеливаясь на клетки опухолей.
История развития технологий получения терапевтических антител берет свое начало в 1970–1980-х годах. Первым важным шагом на пути к созданию моноклональных антител в качестве терапевтических препаратов стало открытие технологии гибридóм1. Суть этого метода заключается в получении большого количества моноклональных, то есть происходящих от одной клетки-предшественницы, антител. Причем эти антитела не простые, а получены в результате слияния клеток двух видов — опухолевых клеток и B-лимфоцитов, полученных от иммунизированного животного. От первых такие клетки наследуют способность к «бессмертию», то есть возможность бесконечно долго делиться. От вторых (нормально функционирующих) — способность синтезировать антитела конкретного типа.
Благодаря развитию в области молекулярной биологии, генной инженерии и компьютерных технологий появились новые возможности не только для усовершенствования гибридомной технологии разработки терапевтических антител, но и для создания новых «негибридомных» методов получения моноклональных антител.
Создание библиотек антител на основе фагового дисплея2 представляет собой альтернативный метод по сравнению с традиционной технологией гибридом. В 1985 году Джордж П. Смит первым описал технологию фагового дисплея3, продемонстрировав, что нитевидные фаги способны отображать интересующий пептид на своей поверхности после встраивания чужеродного фрагмента ДНК в ген белка оболочки нитевидного фага. Принцип метода заключается в том, что пептиды, белки или их фрагменты экспонируются (представляются) на поверхности бактериофагов. Бактериофаг защищен белковой оболочкой (капсидом), которая окружает его генетический материал. При внедрении интересующего гена в ген бактериофага, отвечающего за синтез белка капсида, на поверхности вируса проявляется в итоге «чужой» ген. Создается так называемая библиотека фагов. Затем эту библиотеку пропускают через нужную мишень (антитело, рецептор, фермент) и отбирают те фаги, которые связались с мишенью, для дальнейшей селекции.
Благодаря дисплейным технологиям стало возможным получать библиотеки вариабельных и константных участков генов, кодирующих антитела, комбинировать их в пробирке, вносить мутации, отбирать необходимые варианты и экспрессировать их в бактериях.
Моноклональные антитела: «волшебные пули» иммунитета
Моноклональные антитела, которые происходят от одной клетки-предшественницы, стали реальным воплощением когда-то почти несбыточной мечты о «волшебных пулях» — лекарствах, способных целенаправленно и специфично находить опухолевые клетки и запускать процессы их дальнейшего уничтожения. Концепция «волшебной пули» была заимствована онкологами у немецкого иммунолога Пауля Эрлиха, изучавшего проблему молекулярной специфичности4.
Если говорить об эволюции препаратов на основе моноклональных антител5, часто упоминают трастузумаб — один из ранних препаратов этого класса, одобренный FDA в 1998 году в комбинации с химиотерапией для терапии HER2-положительного метастатического рака молочной железы. Препарат направлен на рецептор HER2 (рецептор эпидермального фактора роста, тип 2), расположенный на поверхности опухолевых клеток, и применяется в рамках комплексного лечения в соответствии с клиническими показаниями.
Однако настоящим прорывом в использовании антител для терапии опухолей6 стало использование этих молекул в качестве ингибиторов контрольных точек иммунного ответа. Сами по себе иммунные чекпоинты на службе у нормальных клеток работают во благо организма: с помощью этих рецепторов на поверхности клеток удается подавлять иммунный ответ, чтобы отразить атаку иммунной системы на собственные ткани и органы. Однако у этого защитного механизма есть и обратная сторона: опухолевые клетки научились «вооружаться» похожими рецепторами и маскироваться под нормальные клетки. Именно здесь на помощь приходят моноклональные антитела — они специфически узнают замаскировавшихся «врагов» и блокируют рецепторы (контрольные точки иммунного ответа) на их поверхности. В результате клетки опухолей снова становятся «видимыми» для иммунной системы, благодаря чему возможно уничтожение злокачественных новообразований.
Среди наиболее известных иммунных чекпоинтов, которые были отмечены Нобелевской премией в 2018 году, — белки CTLA-4 и PD-1, а также лиганд PD-L1. Так, белок CTLA-4 располагается на поверхности различных типов Т-лимфоцитов и способен подавлять активацию других лимфоцитов, в частности, блокируя работу антигенпрезентирующих клеток в лимфоузлах и тканях. Эта блокировка тормозит иммунные реакции и является важной защитой от аутоиммунных заболеваний. Ингибирование CTLA-4 на поверхности опухолевых клеток помогает снижать активность и объем опухоли. Первым препаратом, который подавляет CTLA-4, стал ипилимумаб, широко применяемый для лечения меланомы. Другой важный белок — PD-1, который несут на себе активированные Т-киллеры, в норме позволяет предотвращать чрезмерную активность иммунных клеток и, как следствие, аутоиммунные реакции. Однако опухолевые клетки взяли на вооружение этот инструмент и в ответ на работу иммунной системы научились вырабатывать PD-L1. Но здесь снова приходят на помощь моноклональные антитела: их связывание с белком PD-1 и его лигандом PD-L1 позволяет «отключать тормоза» и дает иммунным клеткам возможность распознавать и уничтожать опухоль. В числе известных препаратов против PD-1/PD-L1: пембролизумаб, ниволумаб, пролголимаб, которые блокируют PD-1, а также атезолизумаб и дурвалумаб, ингибирующие PD-L1. Эти терапевтические молекулы позволяют лечить различные виды онкологических заболеваний.
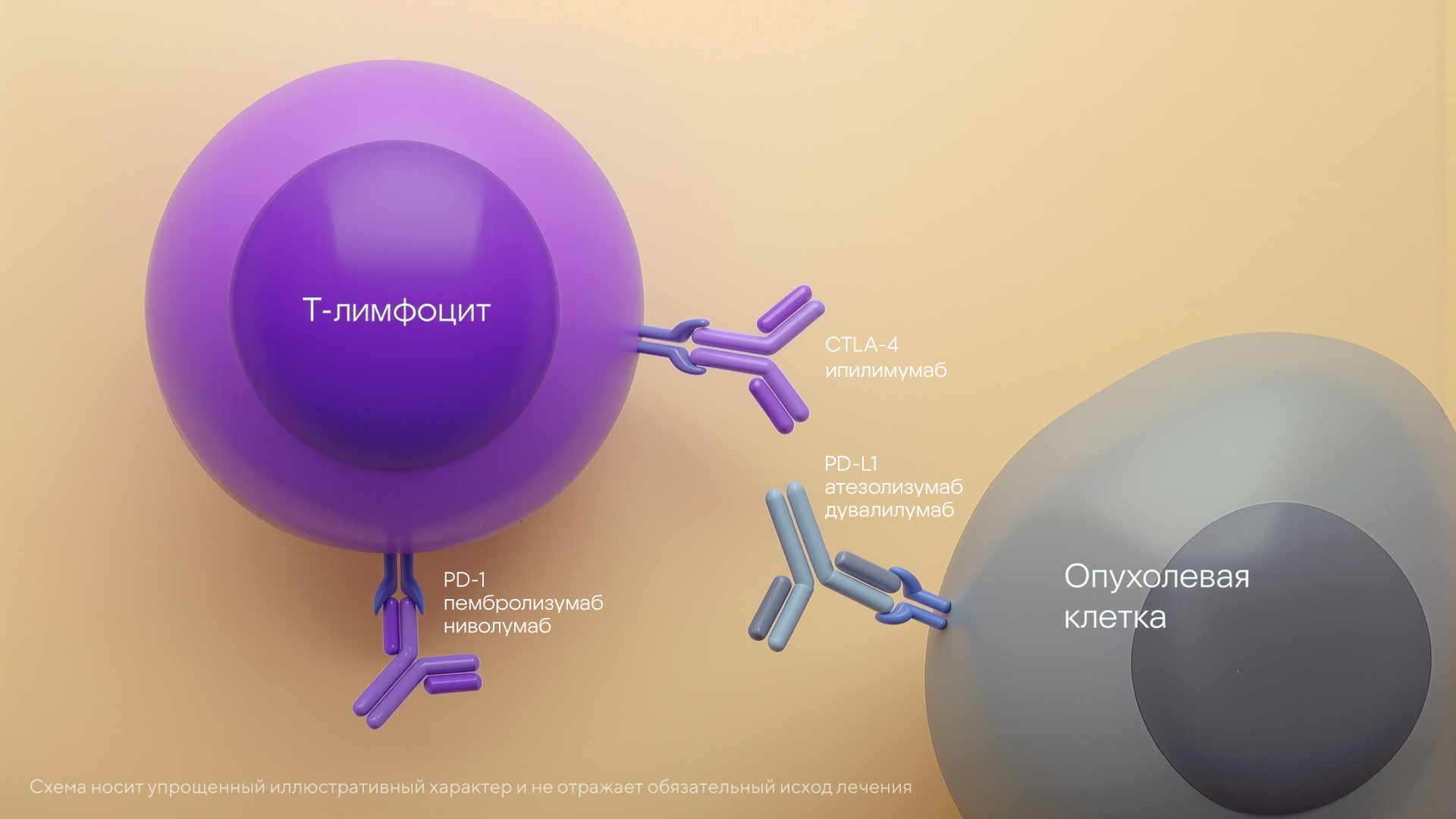
Наиболее известные ингибиторы контрольных точек иммунного ответа. Эти моноклональные антитела способны блокировать рецепторы на иммунных и опухолевых клетках, препятствуя их связыванию и, следовательно, ошибочному «узнаванию» опухолевых клеток как «своих»
Биспецифические антитела: «стрельба» сразу по двум мишеням
Биспецифические антитела — это еще одна разновидность моноклональных антител, происходящих из одной клетки-предшественницы. Однако есть деталь: если большинство встречающихся в природе антител являются моноспецифическими, способными связываться только с одной молекулярной мишенью, то биспецифические антитела — это особым образом сконструированные молекулы, которые могут одновременно соединяться сразу с двумя разными мишенями. Например, одной «рукой» биспецифик связывается с молекулой на поверхности опухолевой клетки, а другой — с рецептором иммунной клетки. В результате образуется своеобразный «мостик», который рекрутирует, то есть «привлекает», иммунные клетки непосредственно к месту действия — к опухоли, подлежащей уничтожению.
Однако не все биспецифические антитела протягивают «руки» сразу двум разным клеткам. Существуют также такие конструкции биспецификов, которые связываются с двумя разными участками антигена (эпитопами), в результате этого удается повысить степень связывания (так называемую аффинность) белка-мишени. Другой вариант — когда биспецифическое антитело узнает и связывает две разные мишени на поверхности одной и той же клетки: это позволяет заблокировать два процесса одновременно.
Наконец, препараты на основе биспецификов можно использовать в случае, когда необходимо создать связь между разными клетками или факторами. Этот подход можно применять, в частности, для терапии гемофилии, А — редкого наследственного заболевания, при котором кровь плохо сворачивается из-за нехватки или отсутствия фактора свертывания VIII. В этом случае особым образом сконструированное биспецифическое антитело может смоделировать эффект отсутствующего у пациентов фактора VIIIa, связывая между собой два других фактора свертывания крови — IXa и X. Одним из заметных успехов в этой разновидности лечения гемофилии, А стала регистрация препарата эмицизумаб, который представляет собой биспецифическое моноклональное антитело на основе иммуноглобулина G4. Принцип действия этого препарата заключается как раз в связывании и сближении факторов свертывания крови, благодаря чему у пациентов с гемофилией, А снижается частота кровотечений.
Несмотря на сложности в разработке, некоторые препараты на основе биспецифических антител уже получили одобрение и зарегистрированы. В их числе — блинатумомаб (анти-CD19/анти-CD3), первый одобренный биспецифик, который связывает поверхностный белок B-лимфоцитов CD19 и рецептор CD3 на поверхности Т-лимфоцитов. В результате удается сблизить эти клетки и активировать Т-лимфоциты для уничтожения избыточных B-лимфоцитов. Блинатумомаб был зарегистрирован для терапии некоторых лейкозов и лимфом, в том числе при рецидивах B-клеточного острого лимфобластного лейкоза. В BIOCAD также разрабатывают препараты на основе биспецификов, нацеленные сразу на две мишени: BCD-106 — антитело, связывающее белки PD-L1 и CD47, предназначенное для терапии солидных опухолей; а также BCD-248 — антитело против BCMA и CD3 для терапии множественной миеломы.
На конец 2025 года на разных стадиях клинических исследований находится более 300 кандидатов лекарственных препаратов на основе биспецифических моноклональных антител. При этом большинство из них сфокусировано на лечении солидных опухолей (в частности, против мишеней HER2/CD3, EGFR/CD3), а значительную часть составляют комбинации биспецификов с модифицированными CAR-T-клетками, которые позволяют преодолевать резистентность к терапии.
ADC: конъюгаты антител для точного поражения цели
Особое место в разработке биопрепаратов для терапии опухолей занимают ADC (antibody-drug conjugate) — конъюгаты антител с лекарственными соединениями. Это своеобразный гибрид химии и биологии, где моноклональное антитело выступает в роли «ракеты-носителя», доставляющей мощный токсин («боеголовку»), например радионуклид или противоопухолевое лекарство, к опухолевой клетке. Связующим звеном между двумя этими частями выступает линкер — молекулярная конструкция, которая до момента распознавания мишени на опухолевой клетке удерживает токсин вместе с антителом. В ключевой момент, когда мишень успешно узнается антителом, молекула поглощается клеткой и особым образом воздействует на нее — например, высвободившийся токсин-конъюгат разрушает жизненно важные структуры опухолевой клетки. Получается, что ADC представляет собой своеобразную «бомбу замедленного действия», которая «подрывает» опухоль только в нужный момент, не задевая здоровые клетки.
В числе зарегистрированных препаратов на основе ADC — трастузумаб эмтанзин и трастузумаб дерукстекан7. Первый представляет собой конъюгат моноклонального антитела с цитотоксическим агентом. Второй — конъюгат с модифицированным цитотоксическим компонентом и особенностями взаимодействия с рецептором HER2. По состоянию на конец 2025 года в клинической разработке находилось более 300 кандидатов препаратов на основе ADC.
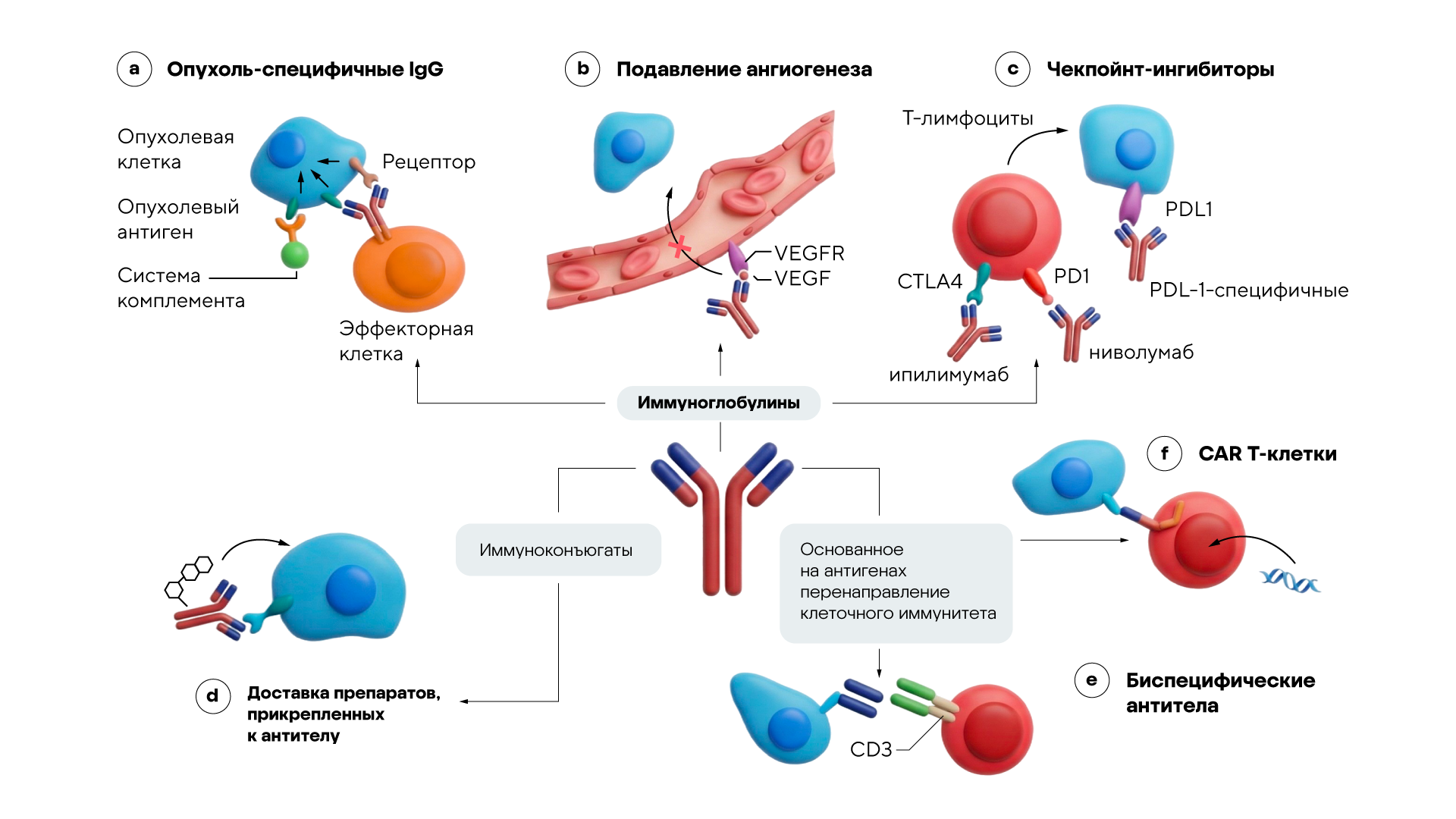
В арсенале препаратов на основе моноклональных антител есть целый ряд механизмов: они способны блокировать сигнальные пути, подавлять процесс ангиогенеза — образования новых кровеносных сосудов в опухолях, активировать комплемент-зависимую цитотоксичность, ингибировать контрольные точки иммунного ответа, а также выступать в качестве переносчиков, доставляя лекарственные вещества в конкретные участки
Будущее терапии опухолей: передовые технологии на вооружении медицины
В числе наиболее «новых» перспектив для лечения злокачественных заболеваний можно выделить неклассические методы лечения на основе клеточных и генных технологий. В отличие от малых молекул и моноклональных антител, здесь исследователи имеют дело с генетическими конструкциями и особым образом модифицированными клетками.
Генная терапия онкологических заболеваний заключается во введении генетического материала в клетки для лечения конкретной разновидности злокачественного новообразования, связанного с конкретными генами. Часто в качестве таких «курьеров» используют вирусы, например AAV (аденоассоциированные вирусы) и лентивирусы, которые доставляют в клетки исправленные гены. Ключевое преимущество этих вирусных векторов в том, что они непатогенны, то есть безопасны для здоровых клеток организма, и их можно «нацеливать» на определенные мишени в организме с высокой степенью точности. Однако есть и недостатки: так, AAV имеют ограниченную емкость, то есть не могут переносить большие генетические конструкции, и почти не встраиваются в геном, из-за чего не способны стабильно передаваться от одного клеточного поколения к другому — а значит, действие такой терапии будет кратковременным.
Частным случаем генной терапии можно назвать РНК-терапию. В настоящее время8 активно разрабатываются препараты, действующие по принципу РНК-интерференции или антисмысловых РНК, однако на сегодня в терапии рака значимых результатов достигнуть не удалось. Но есть и более обнадеживающие новости — разработка РНК-вакцин. В данный момент исследуется разработка компании Moderna, которая представляет собой неоантигенную вакцину для лечения меланомы. Однако получение подобных препаратов «на потоке» очень сложно и дорого: сначала необходимо взять у пациента небольшой кусочек опухоли — биоптат, затем отсеквенировать опухолевые клетки для определения состава их неоантигенов, выбрать несколько наиболее подходящих кандидатов, после чего синтезировать их мРНК. Дополнительно осложняет этот вид лечения то, что клетки опухолей в принципе очень различаются: например, в биоптат могут попасть клетки с одним неоантигенным составом, однако «за кадром» останутся другие — с другими неоантигенами, против которых препарат будет неэффективен.
Наконец, клеточная терапия опухолей основана на разработке модифицированных Т-клеток, вооруженных химерными антигенными рецепторами (Chimeric Antigen Receptor T-cells). На самом деле этот подход стоит на стыке нескольких технологий: здесь и генная модификация клеток, и разработка антительных компонентов, и клеточная трансплантация. В результате CAR-T-терапии удается получать Т-лимфоциты с особыми рецепторами, которые могут специфичным образом уничтожать опухолевые клетки. В настоящий момент проводится более 500 различных клинических исследований, находящихся на разных фазах получения препаратов на основе CAR-T.
История развития методов лечения опухолей — это история набирающего обороты прогресса человечества в борьбе со злокачественными новообразованиями. На смену хорошо зарекомендовавшей себя, но рубящей все вокруг, словно острым мечом, химиотерапии приходит иммунотерапия препаратами на основе моноклональных антител. Этот современный подход предлагает высокоспецифичные и эффективные решения там, где традиционные методы лечения оказались бессильны. С помощью моноклональных антител можно воздействовать на опухоли с высокой степенью точности, помогая сохранять здоровье сотен тысяч людей по всему миру.
Возможно, когда-нибудь на смену иммунотерапии антителами придут клеточная и генная терапия, однако пока что эти подходы остаются «сырыми» и неотработанными. Тем не менее огромный потенциал, заложенный в этих технологиях, продолжает привлекать значительные инвестиции в разработку генотерапевтических и клеточных конструкций, что дает надежду на дальнейшие прорывы в успешном лечении онкологических заболеваний.