Три грани научного поиска: от мышей и чашки Петри до цифровой модели человека
Представьте современного научного сотрудника, которому нужно изучить эффективность и безопасность какой-то молекулы — основы для нового лекарства. Для этого ему предстоит провести несколько этапов исследований и экспериментов. Он может смотреть на трехмерные культуры через микроскоп, наблюдать, как на вещество реагируют трансгенные животные, и даже прогнозировать на компьютере, против каких заболеваний поможет молекула.
Но раньше выбор у исследователей был ограничен: эксперименты проводились на животных, и только в случае успеха — на людях. Было сложно представить, что когда-то ученые смогут изучать препараты на виртуальных моделях органов и предсказывать реакции организма с помощью программ ИИ.
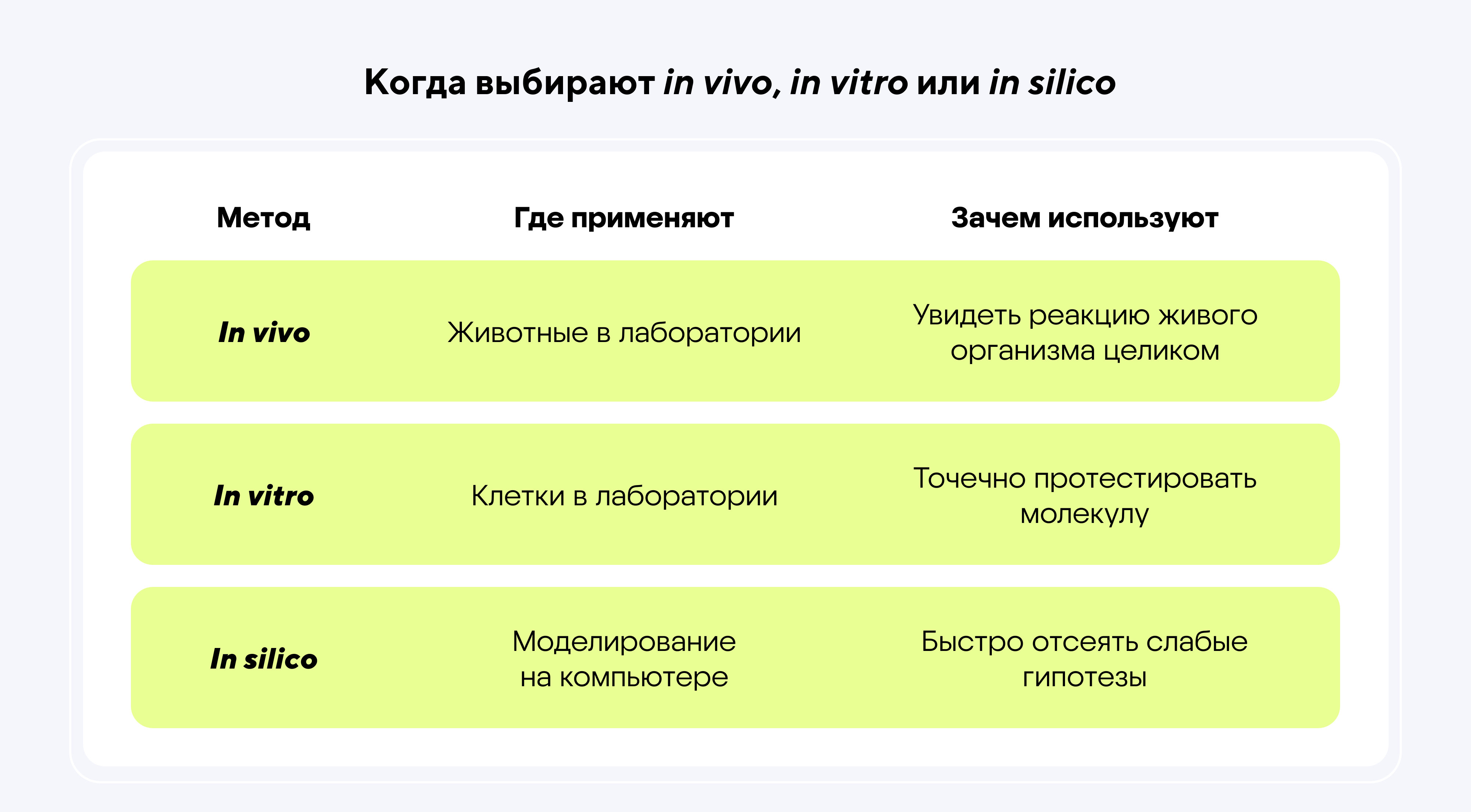
Сегодня используют три основных метода научных исследований:
- In vivo — тестирование на животных и клинические испытания на людях.
- In vitro — эксперименты в пробирках.
- In silico — моделирование биологических процессов на компьютерах.
И каждый из них приближает нас к новым лекарствам.
In vivo: зачем нужны исследования на животных
История применения метода in vivo уходит в глубокую древность. Еще врачи Древней Греции — Гиппократ и Гален — наблюдали за животными, чтобы понять, как работает организм. Но активно использовать технологию in vivo (правда тогда она еще так не называлась) стали в XVI–XVII веках: в это время Андреас Везалий изучал строение сердца на человеческих трупах, а Уильям Гарвей открыл круги кровообращения. Перед этим он долго наблюдал за живыми животными и проводил эксперименты с их кровеносной системой.
В биомедицину метод пришел гораздо позже — в 1901 году. С развитием микроскопии исследователи стали применять его для изучения клеточных процессов и реакций на лекарственные молекулы. Сегодня ученые сначала проверяют эффективность и безопасность на животных, а потом проводят клинические испытания на людях:
Где применяют метод in vivo
Методику in vivo используют во многих областях медицины и биологии.
Фармакология и токсикология
Ученые проверяют, как новые вещества влияют на весь организм: узнают терапевтическую дозу лекарства и изучают его возможные побочные эффекты.
Исследование заболеваний, в том числе онкологических
На животных моделях изучают, как опухоль растет и реагирует на разные виды лечения. Делают это двумя способами: с помощью трансгенных и ксеногенных моделей животных, в чьи организмы добавлены чужие гены человека или другого вида. Это нужно, чтобы изучать болезни и проверять лекарства в условиях, похожих на человеческие.
В первом случае у животных заранее модифицируют гены, которые связаны с развитием определенных типов опухолей. Это помогает исследователям изучать заболевание и реакцию на лечение в условиях, приближенных к реальным. При втором подходе опухолевые клетки человека пересаживают иммунодефицитным мышам, чтобы протестировать экспериментальные препараты на человеческой ткани1, 2.
Нейронаука
С помощью исследований in vivo ученые, в частности, изучают, как мозг реагирует на боль, стресс, память и социальное поведение.
Преимущества и недостатки метода
Главный плюс — реалистичность. Ученые видят реакцию на лечение с учетом всех сложных процессов работы живого организма, включая метаболизм и иммунный ответ.
Но ограничения у метода тоже есть. In vivo — один из самых ресурсозатратных способов проведения исследований. Он требует строгого соблюдения этических стандартов и длительной подготовки. Ведь даже небольшие различия между особями животных, например в весе или возрасте, могут сильно повлиять на результат.
К тому же идея использовать животных для экспериментов всегда вызывала споры. В обществе возникают дискуссии о том, где проходит граница между пользой для человека и страданиями лабораторных грызунов. Поэтому сотрудники лабораторий сегодня следуют международным стандартам. В них описано, как нужно ухаживать за животными и когда от эксперимента стоит отказаться и провести вместо него более гуманное исследование. Протоколы внедрили практически во всех лабораториях и строго соблюдают на этапе доклиники3.
Что будет дальше
Ученые все чаще используют методы визуализации, например МРТ и рентгенографию. Так специалисты получают более точные данные о процессах в живом организме. Это помогает лучше изучить биологические механизмы в реальном времени.
Еще специалисты применяют неинвазивные датчики и устройства для мониторинга физиологических параметров. Таким образом ученые решают сразу две задачи: ускоряют процесс получения результатов и повышают комфорт животных и людей во время экспериментов.
In vitro: как науке помогают пробирки
Идея изучать биологические процессы вне организма возникла еще в XIX веке. В 1885 году немецкий биолог Роберт Кох впервые культивировал бактерии на питательной среде, что можно считать одним из первых успешных примеров in vitro.
Активнее развиваться метод стал в XX веке. В 1907 году американский биолог Росс Гаррисон впервые вырастил нервные клетки лягушки в искусственной среде, доказав, что вне организма клетки можно поддерживать живыми. С тех пор появились другие технологии поддержания жизнеспособности клеток в питательных растворах: инкубаторы, автоматизированные платформы и высокоточные инструменты для анализа молекулярных изменений.
Где применяют метод in vitro
Методы in vitro широко применяют в разных областях.
Биология
Ученые изучают клеточный метаболизм, механизмы деления и дифференцировки клеток. А также исследуют влияние на них вирусов, бактерий и других микроорганизмов.
Фармакология
Исследователи изучают, как лекарственные соединения влияют на жизнедеятельность клеток, оценивают токсичность веществ и тестируют комбинации препаратов.
Медицина
Метод используют для разработки ряда диагностических методов. Например, полимеразную цепную реакцию (ПЦР) создали и улучшили именно методом in vitro. Благодаря этому способу активно развиваются репродуктивные технологии, например экстракорпоральное оплодотворение (ЭКО).
Биотехнологии
Метод используют для производства белков, гормонов и других биологически активных веществ с помощью клеточных культур. А также отслеживают, может ли генетическая модификация клеток помочь при лечении определенных заболеваний.
Преимущества и недостатки метода
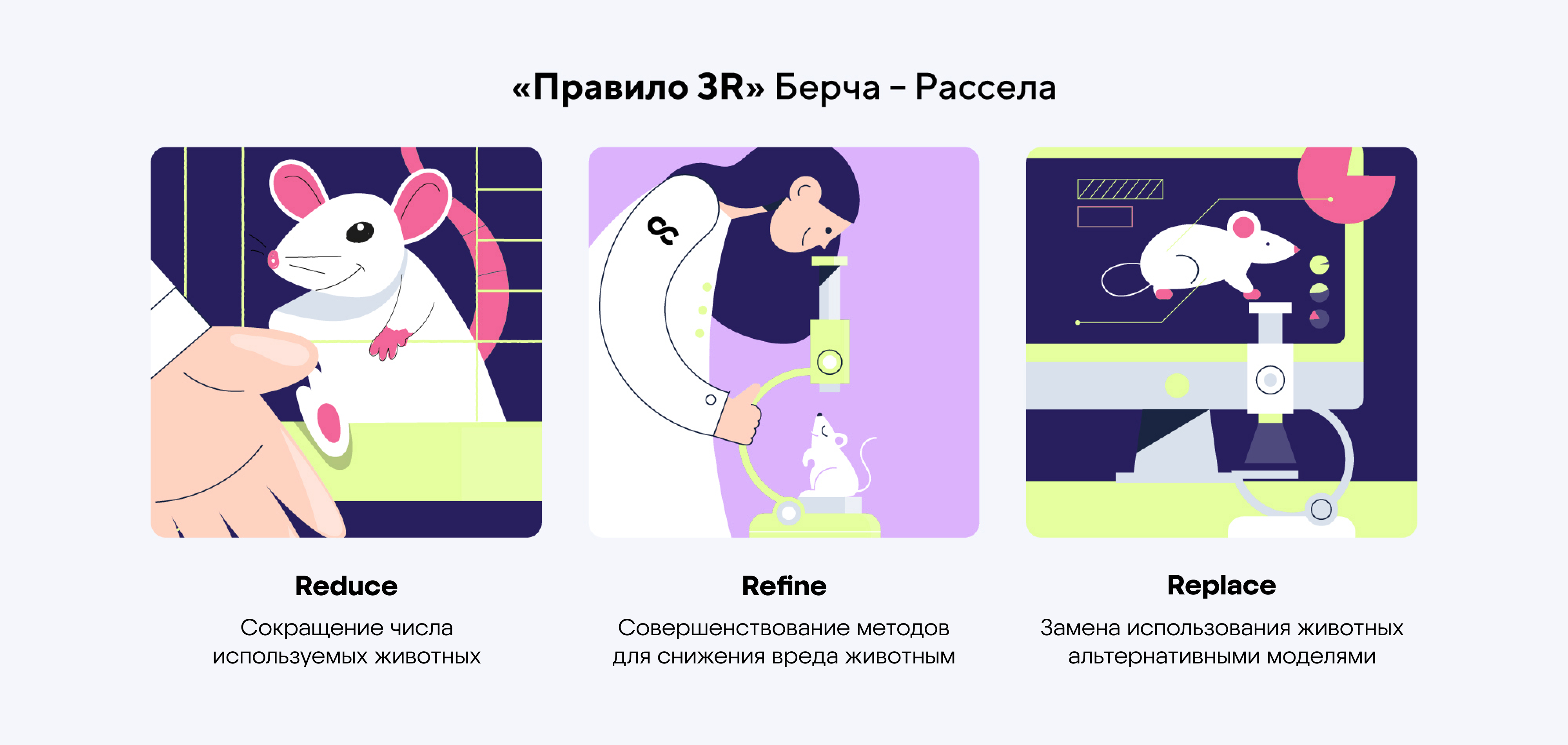
Важный плюс — это высокий уровень контроля. Условия эксперимента можно задать с максимальной точностью — от температуры, pH и концентрации веществ до активности отдельных генов. Так ученые могут быстро проверить гипотезы и реже использовать животных для исследований. Такой подход соответствует современным этическим стандартам, в том числе правилу 3R Берча — Рассела:
Но у методов in vitro есть и ограничения. Клетки выращивают в искусственной среде, то есть они не получают сигналов от гормонов, не взаимодействуют с другими типами клеток и не зависят от реакции иммунной системы. Это уменьшает точность эксперимента: ученым становится сложнее предсказать, как клетки будут реагировать на какое-то вещество в живом организме.
Что будет дальше
Ученые разрабатывают сложные in vitro модели, чтобы результаты исследований были точнее. Например, трехмерные культуры и органоиды, а также чип-системы с микросредой, которая копирует параметры живой ткани. Такие технологии находятся на границе между in vitro и in vivo и в будущем, возможно, заменят классические модели4, 5.
Также специалисты планируют активнее выращивать модели из собственных клеток пациента. Это позволит ученым тестировать препараты на клетках конкретного человека, что повысит эффективность лечения и снизит вероятность побочных эффектов.
In silico: как ИИ и виртуальные модели ускоряют выпуск лекарств
Метод in silico — самый современный подход, при котором биологические и медицинские исследования проводят на компьютере. Компьютерные модели позволяют просчитать поведение молекулы до ее синтеза и спрогнозировать реакцию организма на препарат еще до начала испытаний. А также создать белок с заданной функцией или смоделировать работу органа в динамике.
Развитие методики было постепенным: сначала специалисты разрабатывали простые алгоритмы для моделирования биологических процессов. Затем поручили компьютеру воссоздавать структуры белков. А потом, благодаря секвенированию генома человека, получили крупные базы данных последовательностей ДНК, белков и других структур. Это подтолкнуло научное сообщество к развитию алгоритмов анализа и предсказания функций биомолекул.
В 2000-е появились методы, которые могли моделировать целые биологические системы — клетки, ткани и органы. В последние годы на этот процесс повлиял ИИ: с ним алгоритмы стали точнее, а на их создание уходит меньше времени.
Где применяют метод in silico
Выделяют несколько направлений применения методов in silico.
Разработка лекарственных препаратов
Благодаря компьютерным моделям можно еще до синтеза вещества в лаборатории спрогнозировать способность молекулы связываться с нужной биомишенью, например с белком, который участвует в развитии заболевания. Для этого программа анализирует тысячи молекул и отбирает те, которые подойдут к активному центру белка, как ключ к замку.
Такой подход позволяет значительно сократить объем ручной работы. Вместо тысяч соединений-кандидатов ученые получают короткий список молекул, которые с большей вероятностью окажутся эффективными.
Еще один пример применения in silico метода при разработке лекарств — прогнозирование действий молекулы в организме. С помощью компьютерного моделирования ученые получают следующие данные:
- насколько хорошо всасывается вещество;
- как быстро распределяется по органам и тканям;
- превращается ли в другие соединения в ходе метаболизма;
- как выводится из организма;
- насколько вещество токсично.
Модели in silico позволяют с высокой скоростью оценить эти свойства и исключить неподходящие соединения до перехода к этапам in vitro и in vivo.
Генетические исследования
Расшифровка генома человека — задача сама по себе масштабная: каждый геном содержит около трех миллиардов нуклеотидов. Современные секвенаторы — приборы, которые считывают последовательность нуклеотидов в ДНК, позволяют быстро получить эти данные. Но без дальнейшей компьютерной обработки они остаются просто набором букв. И здесь на помощь приходят компьютерные алгоритмы анализа:
- сопоставляют участки ДНК;
- выявляют мутации;
- устанавливают связи между генетическими изменениями и конкретными биологическими признаками.
Также с помощью in silico методов можно выявить мутации в генах, которые связаны с повышенным риском развития некоторых онкологических заболеваний. А еще выяснить, из-за каких генетических нарушений происходит задержка в развитии у детей.
Кроме диагностики, такие модели помогают подобрать таргетное лечение — когда лекарству нужно повлиять на клетки только с определенной мутацией.
Синтетическая биология
Ученые создают с помощью ИИ новые белки, ферменты и даже модели клеток. Например, языковая модель ProGen, которую обучали на базах белковых последовательностей, смогла синтезировать белки с лизоцимной активностью. Они разрушают клеточные стенки бактерий6, как это делает фермент лизоцим в слюне и слезах человека.
Еще ИИ применяют для создания белков с новыми структурами и активными участками для связывания молекул. Такие «кибербелки» выполняют задачи, которые не по силам их природным «братьям»6.
In silico моделирование активно применяют для воссоздания сложных биологических систем. Например, цифровых моделей поджелудочной железы и мозга мышей7, на которых можно проводить исследования без участия живых грызунов.
Преимущества и недостатки метода
Первоначально in silico применяли как вспомогательный метод, но с развитием вычислительных мощностей и машинного обучения он превратился в полноценный инструмент научного поиска и прогноза.
Но несмотря на это, у моделей in silico есть недостатки. Точность моделирования напрямую зависит от качества исходных данных, заложенных математических допущений и корректности интерпретации результатов. Поэтому исследования in silico всегда дополняют другими стандартными лабораторными методами.
Что будет дальше
Одна из целей ученых — создание цифрового двойника человека: детальной компьютерной модели, учитывающей работу всех органов и систем конкретного пациента. С ее помощью врачи смогут заранее оценить эффективность лечения и поменять его, если состояние человека изменится.
Еще специалисты хотят наполнять цифровые библиотеки данными о каждой клеточной модели — ее геноме, метаболизме, сигнальных путях и реакции на потенциальные препараты. Это поможет выявлять чувствительность клеток к конкретным соединениям и прогнозировать развитие заболеваний.
Что в итоге
Когда ученые используют сразу три подхода — живые модели, клеточные тесты и цифровые прогнозы, — новые лекарства получается создать этичнее, быстрее и дешевле. Сильные стороны каждого подхода дополняют друг друга и помогают исследователям лучше понимать биологические процессы.