
Дайджест #12. Изучаем снимки «матового стекла»
Компьютерная томография позволяет визуализировать опухоли на ранних стадиях. Один из примеров — идентификация рака легких по туманным снимкам паренхимы легкого, которые еще называют «матовым стеклом». Такие слабопрозрачные пятна, которые хуже пропускают Х-лучи, скрывают за собой уплотнения органа. Центром одного из недавних исследований стал пациент с такими узелками «матового стекла» в легких. Оказалось, что даже с достаточно высокой опухолевой нагрузкой у него наблюдался медленный рост опухоли — и это в отсутствие систематического лечения. О том, что помогло ему на протяжении долго времени противостоять болезни, читайте в новом дайджесте.
Онкология
Найден потенциальный участник воспалительного процесса при меланоме
Один из важных мембранных белков, участвующих во врожденном иммунитете, — Toll-подобный рецептор 4, TLR4. После распознавания своего лиганда на поверхности клетки, TLR4 рекрутирует адаптерные белки в клеточную мембрану, в результате чего запускается воспаление. Долгое время оставалось неизвестным, от чего зависит процесс рекрутирования адаптерных белков — только ли от белок-белковых взаимодействий или в процессе сигналинга участвуют и другие посредники. Чтобы лучше разобраться в этом вопросе, биологи из Германии изучили молекулярную передачу сигналов на мышиных моделях меланомы и сепсиса. В результате удалось выявить важного участника — сфинголипид сфинганин, который физически взаимодействует с адаптерными белками MyD88 и TIRAP и способствует рекрутированию MyD88 в макрофагах. При дефиците фермента, катализирующего биосинтез этого сфинголипида, снижается концентрация MyD88 на мембране и подавляется воспалительный процесс. Получается, что важным чекпоинтом, связанным с мышиными моделями меланомы и сепсиса, можно считать сфинганин — и это делает его потенциальной мишенью при терапии рака кожи. — Sphinganine recruits TLR4 adaptors in macrophages and promotes inflammation in murine models of sepsis and melanoma.
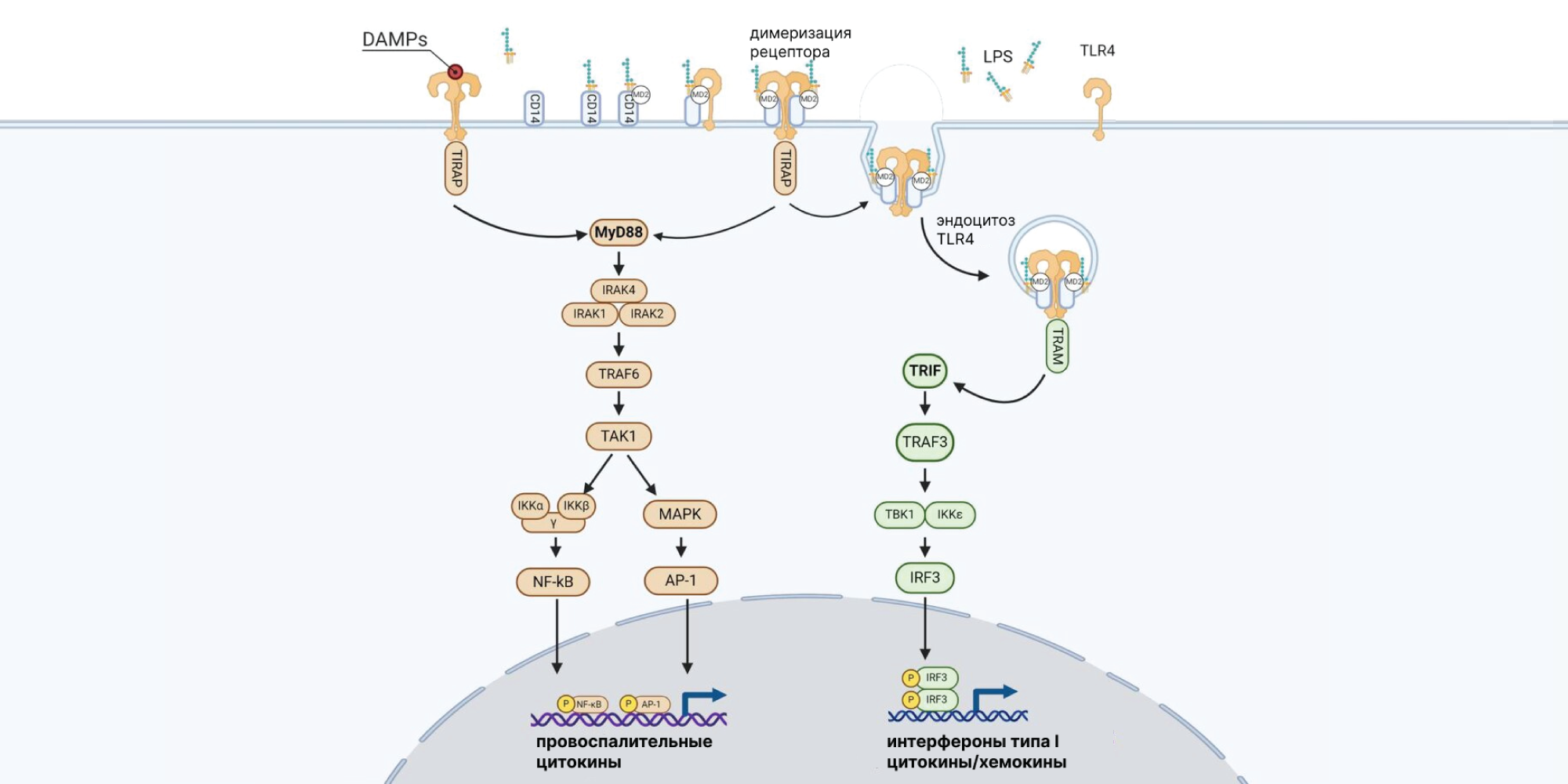
Источник: Wikipedia
MyD88-зависимый путь — один из клеточных сигнальных путей, который регулируется двумя адаптер-ассоциированными белками: MyD88 и TIRAP. Благодаря накоплению MyD88 в макрофагах запускается воспалительный процесс.
Что помогает противостоять раку легких
Компьютерная томография позволяет выявлять заболевания легких, включая аденокарциному, на ранних стадиях. Это возможно благодаря так называемым узелкам «матового стекла» — уплотнениям легочной ткани, которые плохо пропускают рентгеновские лучи. В настоящее время наличие скоплений таких узелков признают в качестве маркера первичного рака на ранней стадии. В недавнем исследовании изучали пациента с первичным раком легких с такими признаками — множественными узелками «матового стекла». Несмотря на долгое течение болезни и высокую опухолевую нагрузку — в легких было много воспалительных очагов, включая внутрилегочные метастазы, — у пациента наблюдался медленный рост опухоли, и это с учетом отсутствия систематического лечения. Генетический анализ выявил мутации рецептора эпидермального фактора роста (EGFR) во множестве сайтов, включая классическую мутацию L858R, делецию в 19-м экзоне и наличие редкого генетического варианта V834L. На протяжении всей болезни иммунный ответ у пациента оставался очень сильным: во многом это стало возможным благодаря активации врожденных иммунных ответов, связанных с интегрин-опосредованной адгезией внеклеточного матрикса. Получается, что секрет длительной выживаемости этого пациента при длительном течении аденокарциномы легких — комбинация врожденного иммунитета, конкретного набора мутаций в раковых клетках и фенотипа микроокружения опухоли. — Innate immune dynamics in the context of multisite EGFR mutations in lung adenocarcinoma.

По наличию узелков «матового стекла» на КТ легких определяют злокачественные новообразования — рак легких. На томограмме они, как правило, представляют собой единичные уплотнения обычно небольшого размера — от 2 мм. Источник: kt-spb
Генетическое управление для иммунотерапии опухолей
Один из путей программируемой клеточной гибели, в том числе и для онкоклеток, — ферроптоз. Этот способ связан с накоплением в клетке свободных радикалов и последующим оксидативным стрессом. Ферроптоз вызывается различными факторами, в том числе медиаторами воспаления, среди которых выделяют интерфероны. В новом исследовании на мышиных моделях проанализировали влияние сигнального пути интерферона на ферроптоз в опухолевых клетках и его взаимосвязь с истощением CD8+ Т-клеток. Благодаря дифференциальному анализу генов и биоинформатическим методам удалось выявить основные гены, связанные с ферроптозом опухолей. Так, ключевым игроком в истощении CD8+ Т-клеток является ген HSPA6, а другой важный участник в регуляции истощения Т-клеток — ген DNAJB1. Подавление экспрессии этих генов открывает перспективы для повышения эффективности терапии PD-1 и ингибирования роста и метастазирования опухолей. — Interferon signaling and ferroptosis in tumor immunology and therapy.
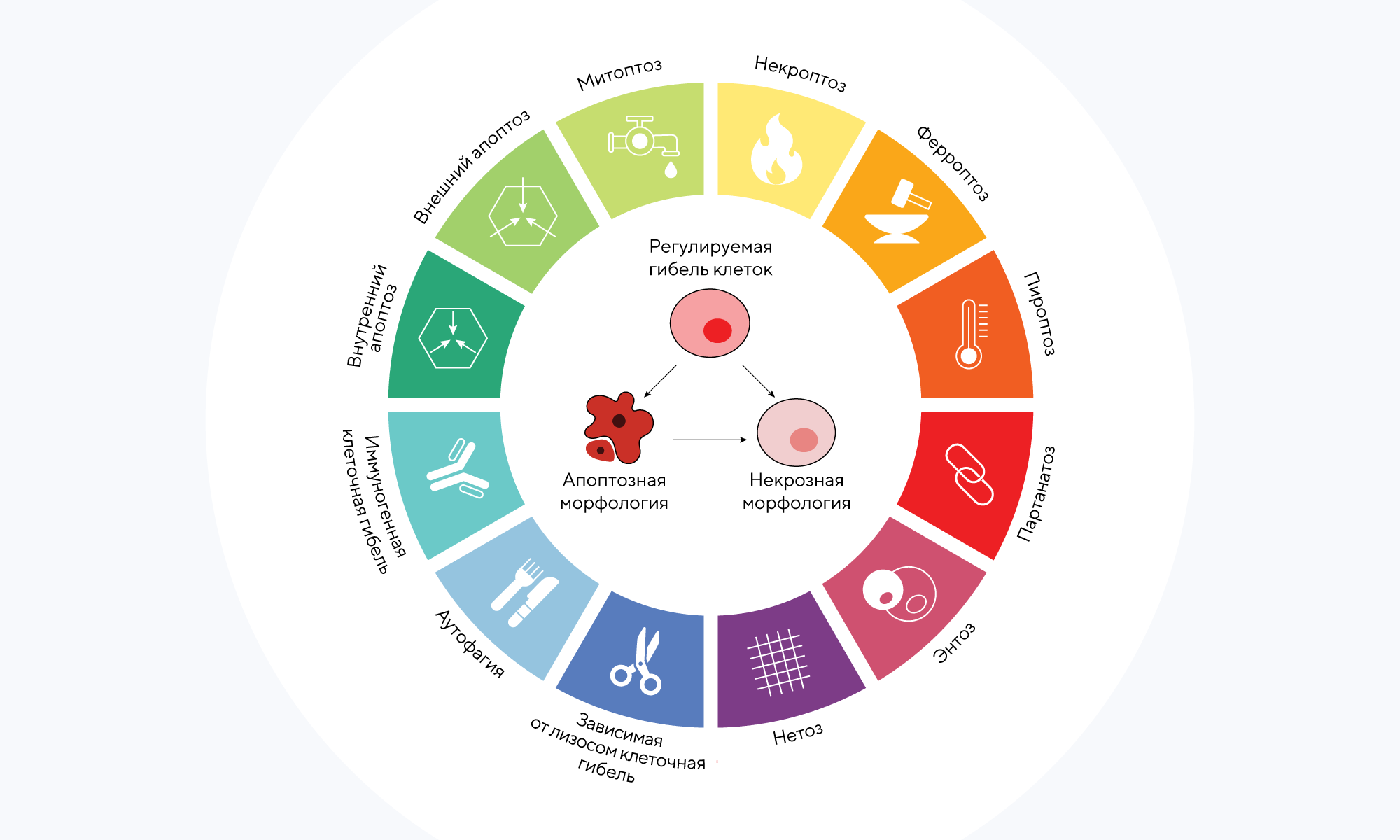
Источник: «Элементы»
Ферроптоз — лишь один из механизмов запрограммированной клеточной гибели или гибели клеточных органелл. Кроме гибели с участием железа, клетки могут поглощать друг друга, перевариваться лизосомами, уничтожать собственные митохондрии, погибать из-за гиперактивации ферментов и т. д.
Как клаудин влияет на течение рака
Клаудины — семейство белков, которые образуют плотные контакты между эпителиальными клетками. В их числе — мембранный белок клаудин 18.2, который экспрессируется клетками при раке желудка и считается одним из важных биомаркеров онкогенеза. В новом исследовании решили изучить гетерогенность экспрессии этого белка при раке желудка. Так, выяснилось, что опухоли с высокой и средней экспрессией клаудина 18.2 чаще метастазируют в брюшину, но в меньшей степени ассоциированы с поражениями печени и лимфоузлами, удаленными от очага поражения. Эти результаты подсвечивают важность клаудина 18.2 как важной терапевтической мишени против рака желудка с метастазированием, а также намечают потенциальную стратегию лечения. Хочется отметить, что сейчас на разных стадиях разработки находятся несколько антител к клаудину 18.2. — Heterogeneity of claudin 18.2 expression in metastatic gastric cancer.
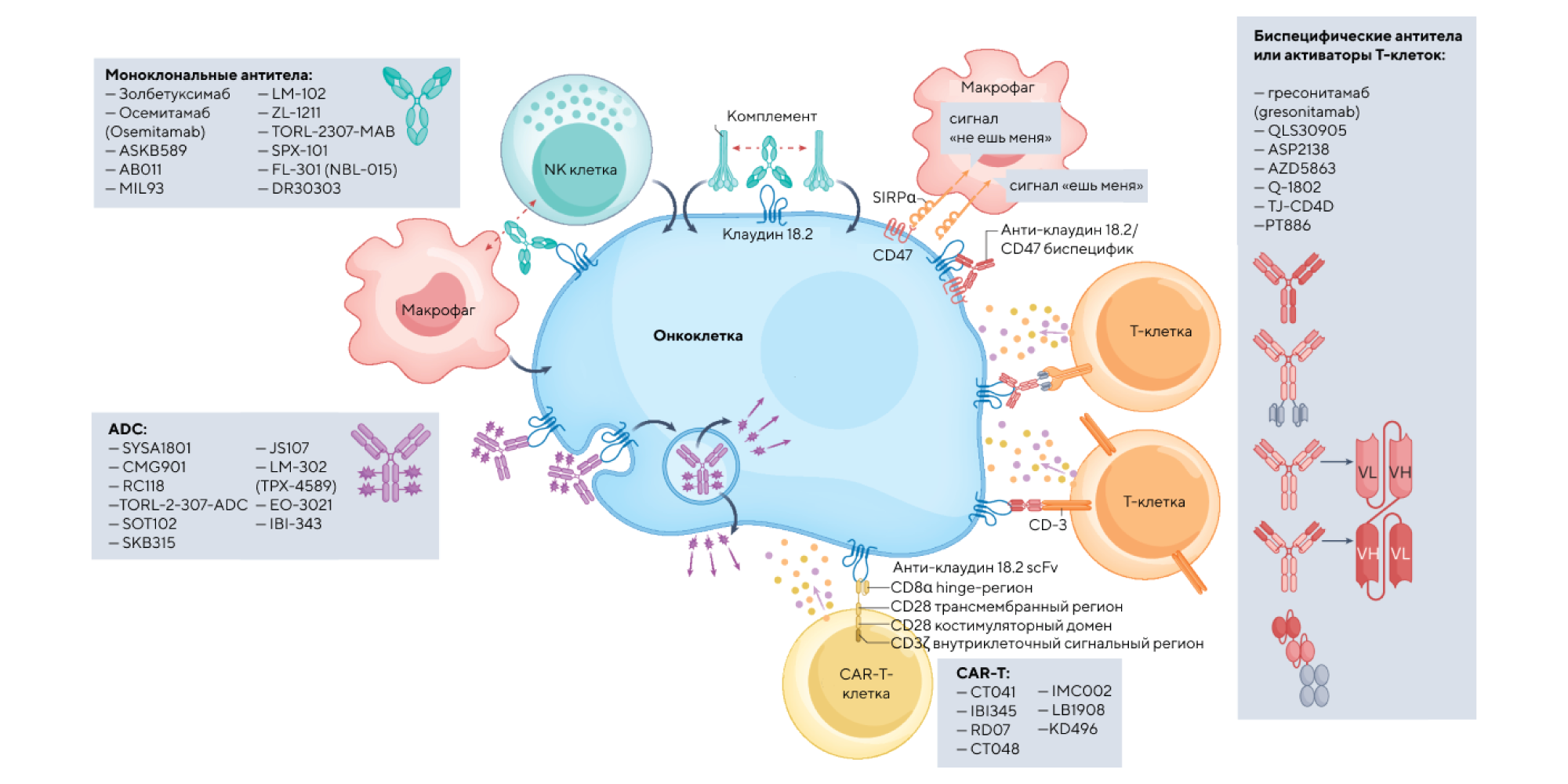
Клаудин 18.2 — многообещающая терапевтическая мишень для лечения рака желудка. Источник: Nature Reviews Clinical Oncology
Аутоиммунные заболевания
Что обостряет ревматоидный артрит
Одна из причин агрессивного пародонтита, воспаления тканей вокруг зуба, — бактерия Aggregatibacter actinomycetemcomitans. Однако это не единственное заболевание, связанное с этим патогеном — также эта бактерия может вызывать или обострять ревматоидный артрит. Чтобы лучше разобраться в механизме инфицирования, исследователи из Японии изучили прогрессирование болезни у мышей с моделью ревматоидного артрита. Выяснилось, что обострение заболевания связано с активацией инфламмасом, опосредованной каспазой-11. Инфламмасомы вызывают секрецию IL-1β, что приводит к воспалению и провоцирует системную инфекцию в макрофагах. Чтобы подавить активацию инфламмасом, мышам вводили антибиотик полимиксин B, хлорохин и антитела анти-CD11b. В результате удалось выяснить механизм инфицирования: после деградации бактерий лизосомами происходит распознавание липополисахарида в цитозоле и последующая инвазия через CD11b, что запускает артрит после активации инфламмасом в макрофагах. Получается, что ингибирование активации инфламмасом, опосредованной каспазой-11, усиливает обострение ревматоидного артрита, вызванного бактерией A. actinomycetemcomitans. — Caspase-11 mediated inflammasome activation in macrophages by systemic infection of A. actinomycetemcomitans exacerbates arthritis.
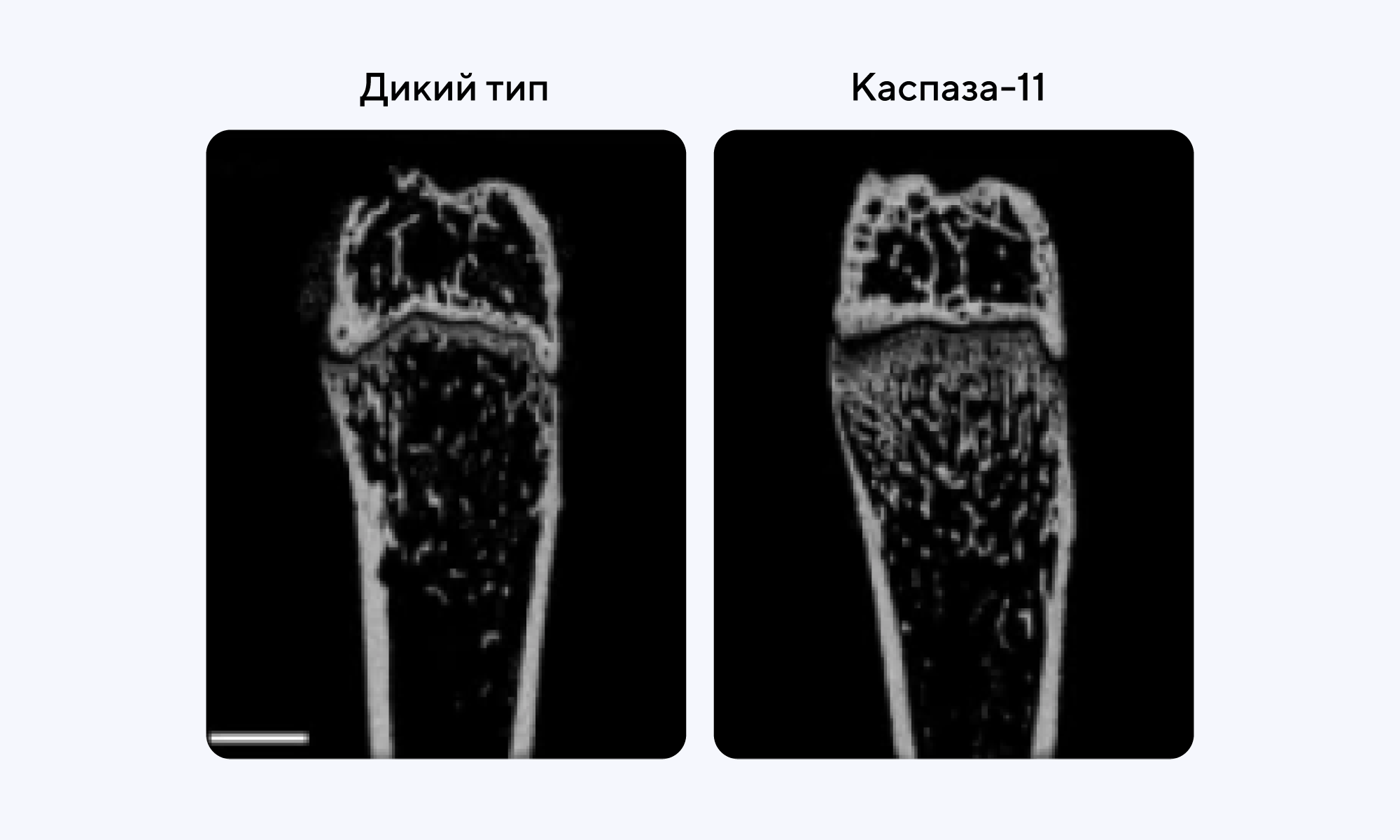
На рисунке — сравнение снимков КТ суставов мышей дикого типа и модели с артритом. Источник: International Journal of Oral Science
Ревматоидный артрит — хроническое заболевание, при котором воспаляются суставы. В новом исследовании выявили роль инфламмасом, активируемых посредством каспазы-11, в развитии артрита. Так, каспаза-11 опосредованно запускает воспаление суставов за счет секреции IL-1β при инфицировании организма бактерией A. actinomycetemcomitans.
Что определяет уязвимость к первичному рассеянному склерозу
Рассеянный склероз — одно из хронических воспалительных заболеваний нервной системы с непредсказуемым течением. Чтобы лучше разобраться в механизмах развития этой болезни, шведские исследователи изучили молекулярные изменения клеток, связанные с рассеянным склерозом, и сопоставили их с генетическими и эпигенетическими данными из независимых когорт пациентов. Выяснилось, что в случае первичного прогрессирования рассеянного склероза наблюдается гиперметилирование локуса 1q21.1, что влияет на экспрессию проксимальных генов CHD1L и PRKAB2 в мозге. Нокдаун CHD1L в. нейронах, полученных из плюрипотентных стволовых клеток человека, приводил к дефициту развития и функциональности нейронов. Эти данные подсвечивают локус 1q21.1, изменения в котором связаны с прогрессированием первичного рассеянного склероза. — A genetic-epigenetic interplay at 1q21.1 locus underlies CHD1L-mediated vulnerability to primary progressive multiple sclerosis.
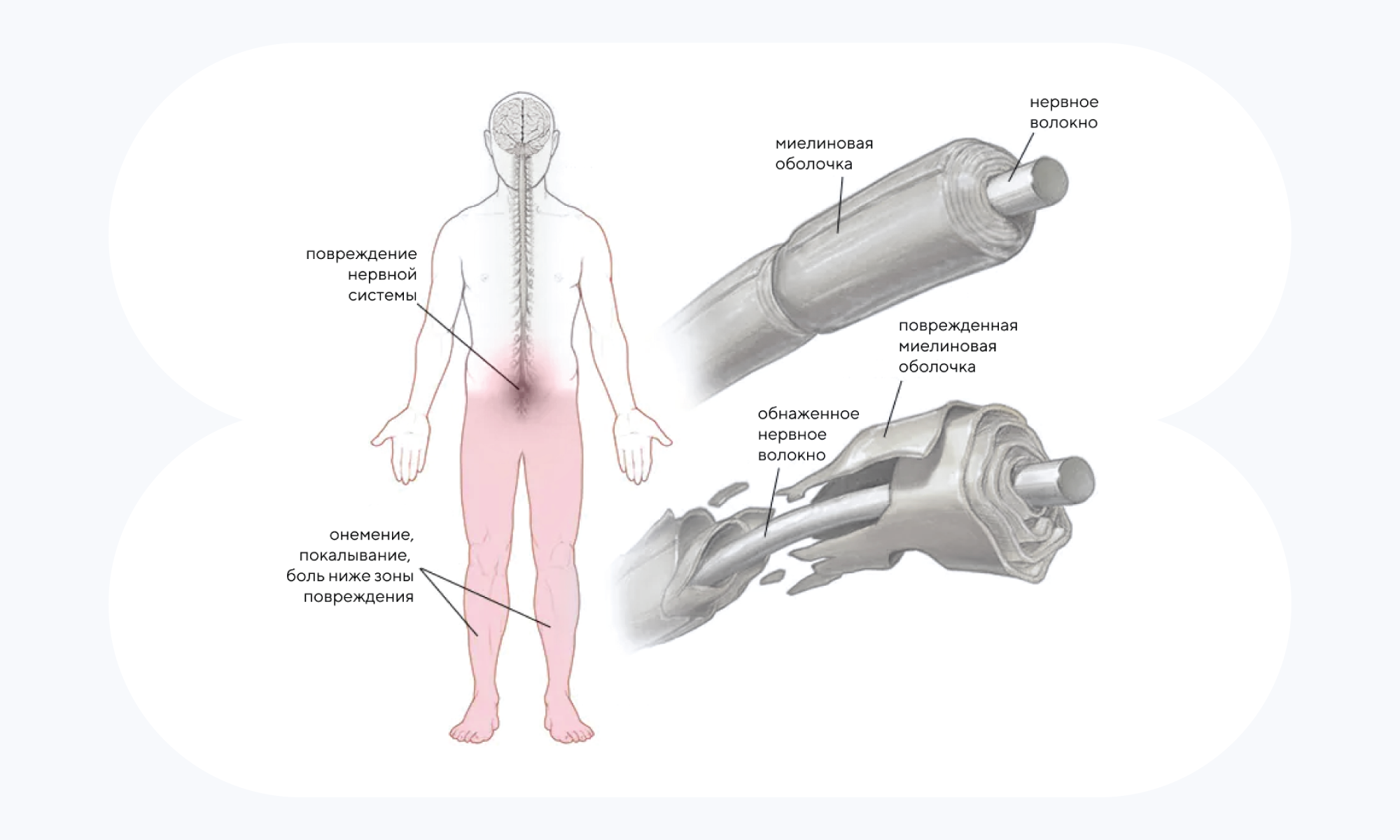
Источник: Mayo Clinic
При рассеянном склерозе иммунные клетки атакуют собственные миелиновые оболочки нейронов. Лишившись защитной оболочки, обнаженные аксоны нервных клеток становятся уязвимыми и теряют способность проводить нервные импульсы.