
Дайджест #16. Непривычное лечение опухолей глаз
Компания Chimerix разработала необычный класс соединений — имипридоны. Эти молекулы уже показали свой терапевтический эффект на практике: так, действие препарата Dordaviprone на основе трехкольцевого имипридона успешно проверили при лечении рака мозга: он селективно подавляет пролиферацию опухолевых клеток, при этом не затрагивая здоровые клетки. Недавно опубликовали результаты еще одного исследования препарата на основе имипридонов — целью стало лечение редкого вида опухоли глаза. О том, почему это заболевание сложно поддается лечению и каких успехов удалось достигнуть, читайте в новом дайджесте.
Найден новый способ терапии увеальной меланомы
Увеальная меланома — редкий вид опухоли глаза, которая развивается в меланоцитах в радужной оболочке. Это заболевание отличается агрессивным течением и, к сожалению, пока небольшим выбором вариантов лечения — обычно рекомендуют хирургическую операцию или лучевую терапию (если не считать недавно одобренного FDA препарата Tebentafusp, который стал первой биспецифической молекулой для терапии солидной опухоли — ею стала как раз увеальная меланома). Однако недавно удалось найти многообещающий способ подавления этой опухоли. Открытие основывалось на предшествующих работах, в которых показали связь между развитием увеальной меланомы и высоким уровнем окислительного фосфорилирования в меланоцитах. Если таргетно ингибировать этот процесс, можно безопасно и эффективно заблокировать рост и развитие опухоли. В достижении этой цели хорошо работают имипридоны (imipridones) — новый класс селективных противораковых соединений. Имипридоны нацеливаются на рецепторы, сопряженные с G-белком, а также на митохондриальную протеазу P (ClpP, caseinolytic protease P), приводя к гибели раковых клеток. В исследовании терапии увеальной меланомы участвовали имипридоны ONC201 и ONC212, активирующие ClpP. Эффект превзошел все ожидания: ONC201 и ONC212 ингибировали рост и миграцию опухолевых клеток, блокировали метастазирование и запускали процесс апоптоза — запрограммированной клеточной гибели. В результате снижалась опухолевая нагрузка и увеличивалась выживаемость in vivo — правда, пока это удалось показать только на мышиных моделях. Эти результаты показывают важность имипридонов ONC201 и ONC212 в качестве перспективных препаратов для терапии этой агрессивной опухоли глаза. — Imipridones inhibit tumor growth and improve survival in an orthotopic liver metastasis mouse model of human uveal melanoma.

Имипридоны ONC201 и ONC212 вызывают гибель опухолевых клеток, взаимодействуя с митохондриальной протеазой ClpP и вызывая ее гиперактивацию. Это происходит за счет увеличения протеолитической полости с 12 Å до 17 Å. В результате неконтролируемо разрушаются митохондриальные белки, включая субъединицы комплексов I и II, что вызывает нарушение дыхательной функции и в конце концов гибель раковых клеток. Источник: адаптировано из Cancer Cell
Почему возникают покоящиеся клетки и как это связано с метастазами
Одна из основных причин тяжелого течения рака — метастазирование. Ключевую роль в распространении метастазов играет выживание покоящихся онкоклеток в кровеносной системе. Чтобы лучше изучить переход клеток к состоянию покоя, китайские исследователи разработали модель покоящихся раковых клеток с использованием метода высокоплотного культивирования. Секвенирование РНК одиночных клеток показало важную роль гена CDC25A в переходе клеток к покою. Ранее белок CDC25A уже называли одним из факторов, связанных с раком, так как его обнаруживают в опухолях, где он приводит к остановке клеточного цикла. В новой работе выявили еще одну интересную особенность CDC25A — связь этого белка с холестерином. Повышение регуляции CDC25A усиливает метаболизм холестерина, в результате чего изменяется структура цитоскелета и свойства мембраны, способствуя метастазированию онкоклеток и дальнейшему переходу в состояние покоя. Эти результаты подсвечивают важность белка CDC25A как потенциальной мишени для разработки терапии против рака. — Quiescent cancer cells induced by high-density cultivation reveals cholesterol-mediated survival and lung metastatic traits.
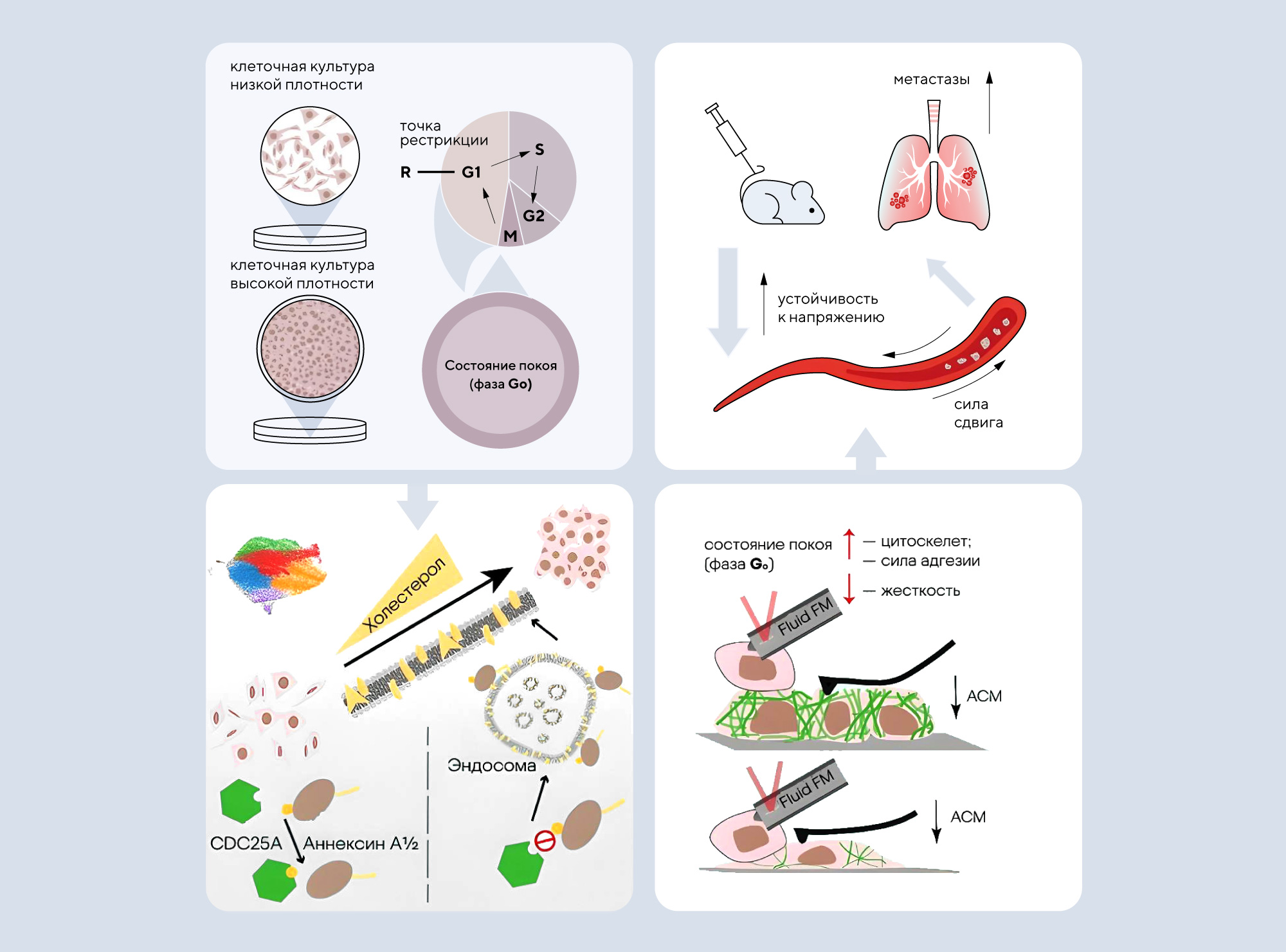
Схема эксперимента. Источник: адаптировано из British Journal of Cancer
В исследовании участвовала клеточная модель онкоклеток высокой плотности. Клетки находились в состоянии покоя (фазе Go), во время которой клетки не делятся. Выяснилось, что под действием аннексина А1/2 активируется белок CDC25А, который значительно увеличивает метаболизм холестерина через эндосомы. Наблюдение за клетками методами атомно-силовой микроскопии (АСМ) и жидкостно-силовой микроскопии (Fluid FM) показало, что в покоящихся раковых клетках под действием холестерина снижается жесткость мембраны, укрепляется цитоскелет и сила сцепления между клетками и повышается устойчивость к механистическим силам в кровеносном русле — онкоклетки как бы «держатся на плаву», не поддаваясь напору крови.
Как подсветить опухоль
Самым распространенным способом лечения рака головы и шеи остается хирургическая операция, при которой удаляют опухоль. Однако часто хирургам бывает сложно разобраться, где заканчиваются края опухоли и начинается здоровая ткань. Чтобы провести операцию более аккуратно, используют специальные флуоресцентные молекулы, которые вводят в опухоль и заставляют ее клетки светиться. Исследователи из Германии предложили новый многообещающий инструмент для аккуратного удаления опухолевых клеток — флуоресцентный пептид TPP-IRDye800, который связывается с мембранным вариантом белка Hsp70. В норме этот белок работает внутри клеток и защищает их от повреждений, поддерживая АТФ-зависимое сворачивание протеинов. Однако в раковых клетках может происходить гиперактивация Hsp70, в результате чего он перемещается в мембрану и участвует в росте и миграции опухоли. В предыдущих исследованиях уже удалось показать важную роль Hsp70 при плоскоклеточном раке головы и шеи. В новой работе продемонстрировали успешное связывание пептида TPP-IRDye800 с Hsp70, в результате чего удалось эффективно разграничить опухоль и метастазы для их дальнейшей хирургической резекции. — Improved ex vivo fluorescence imaging of human head and neck cancer using the peptide tracer TPP-IRDye800 targeting membrane-bound Hsp70 on tumor cells.
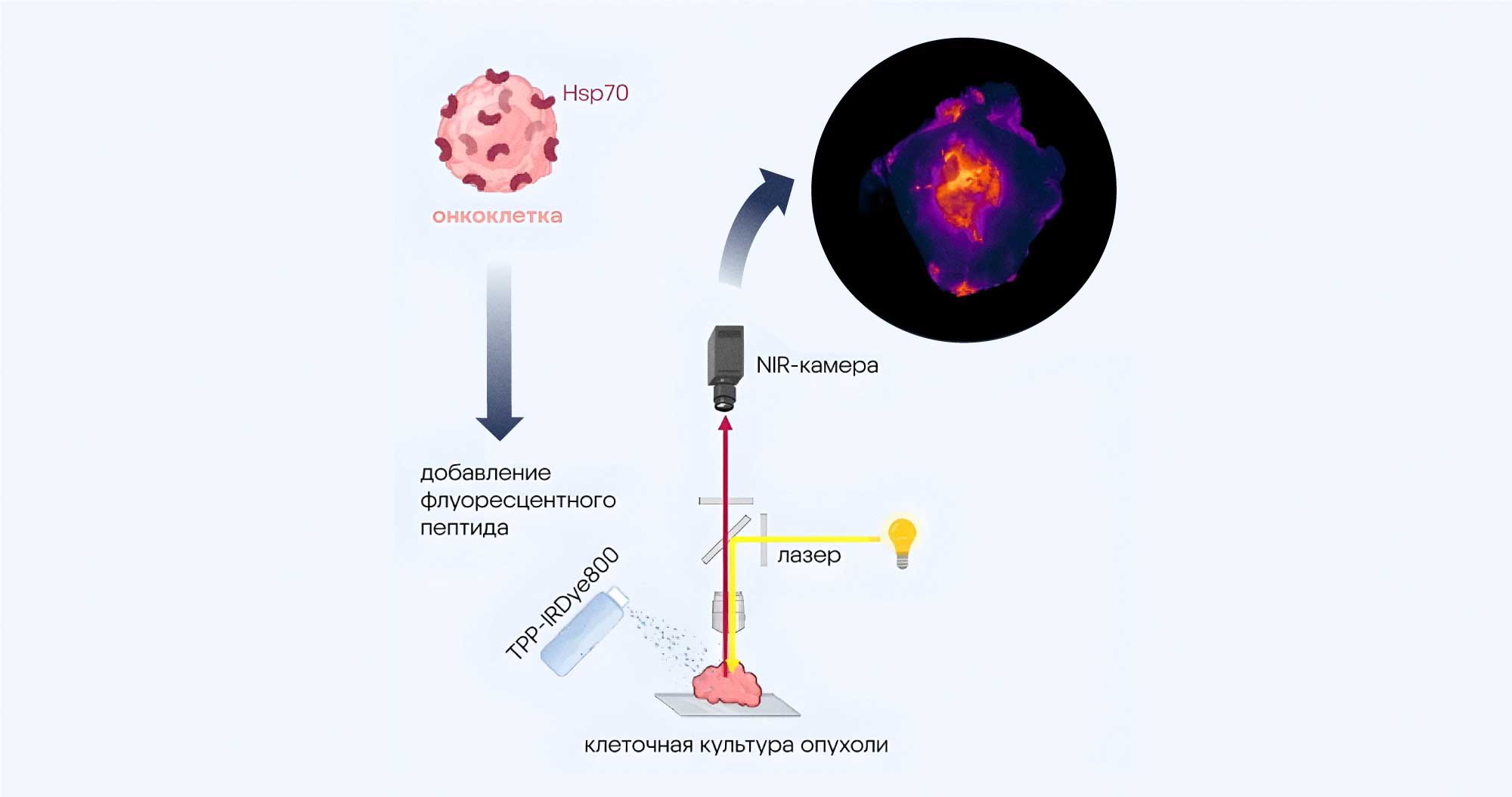
В исследовании участвовали клетки рака головы и шеи, экспрессирующие белок Hsp70. Под воздействием флуоресцентного пептида TPP-IRDye800, который связывается с Hsp70, удалось визуализировать границы опухоли с помощью NIR-камеры (Near-Infrared), работающей в ближнем инфракрасном диапазоне. Источник: British Journal of Cancer
Доставка микроРНК в клетки позволяет остановить метастазирование
МикроРНК — небольшие некодирующие молекулы, которые выполняют множество важных задач: от дифференциации клеток до запуска или остановки опухолевых процессов. В 2024 году за открытие микроРНК даже вручили Нобелевскую премию — об этом можно прочитать в статье про эти необычные молекулы. В новой работе японских исследователей главным героем тоже стала микроРНК-29b (miR-29b), которая считается супрессором опухоли. Так, ранее уже была показана важная роль miR-29b в подавлении злокачественного перерождения клеток при остром миелоидном лейкозе. Новое исследование показывает, что miR-29b может быть эффективна и при перитонеальном канцероматозе — злокачественном метастазировании органов ЖКТ и яичников. МикроРНК в составе AAV доставляли не напрямую к опухолевым клеткам, а в опухолевую строму, что приводило к изменению микроокружения опухоли. Этот способ позволил устранить одну из трудностей генной терапии рака: часто сложно нацелить препарат сразу на онкоклетки, не вызывая при этом серьезных побочных эффектов. Новый подход с использованием доставки через брюшные метастазы представляет собой многообещающую терапевтическую стратегию лечения рака. — Intraperitoneal administration of adeno-associated virus encoding microRNA-29b for the treatment of peritoneal metastasis.
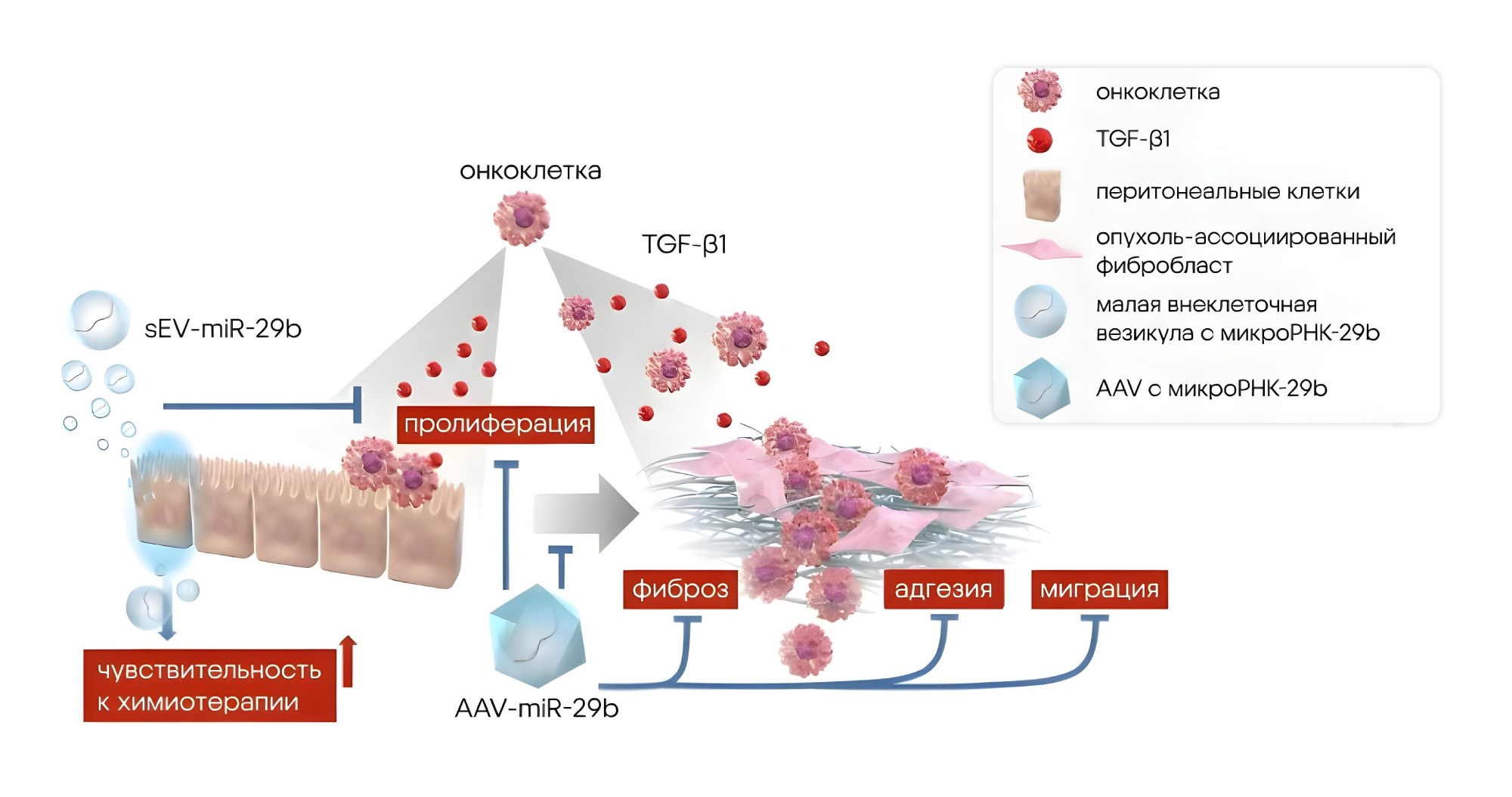
В ходе исследования во внутрибрюшинное пространство однократно вводили AAV-miR-29b, что приводило к ингибированию метастазирования и подавлению фиброза брюшины. Более того, генная терапия с помощью AAV-DJ-miR-29b повышала эффективность химиотерапии, сдерживая рост уже образовавшихся метастазов. Источник: Cancer Gene Therapy
Как перепрограммировать микроокружение опухоли
Онколитические вирусы способны заражать и уничтожать раковые клетки, что делает их удобными инструментами для терапии рака. В недавней работе исследователей из Китая сообщается как раз об одном из способов лечения глиобластомы с помощью онколитического аденовируса. Обычно доставка таких вирусов к нужному месту в организме сталкивается со множеством сложностей. В их числе — иммуногенность: вектор воспринимается как чужак и нейтрализуется антителами, не успев выполнить свою терапевтическую миссию. Чтобы преодолеть это препятствие, ученые упаковали аденовирус в обертку из хемокина CXCL11 с дубильной кислотой и ионами железа Fe3+. Этот носитель успешно защищал аденовирус от иммунного ответа и продлевал время его циркуляции — по крайней мере это удалось продемонстрировать в экспериментах in vitro и in vivo, на мышиных моделях с глиобластомой. Непосредственно в области опухоли дубильная кислота с железом растворялась, высвобождая Fe3+ и аденовирус. Онколитический аденовирус действовал на опухолевые клетки, вызывая их разрушение, а Fe3+ вызывало образование кислорода из пероксида водорода. В результате такой дополнительный эффект снимал гипоксию и изменял микроокружение опухоли, делая ее более доступной для работы иммунных клеток. Эти результаты открывают многообещающие горизонты для терапии глиобластом с помощью онколитических аденовирусов. — Systemic delivery of tannic acid-ferric-masked oncolytic adenovirus reprograms tumor microenvironment for improved therapeutic efficacy in glioblastoma.
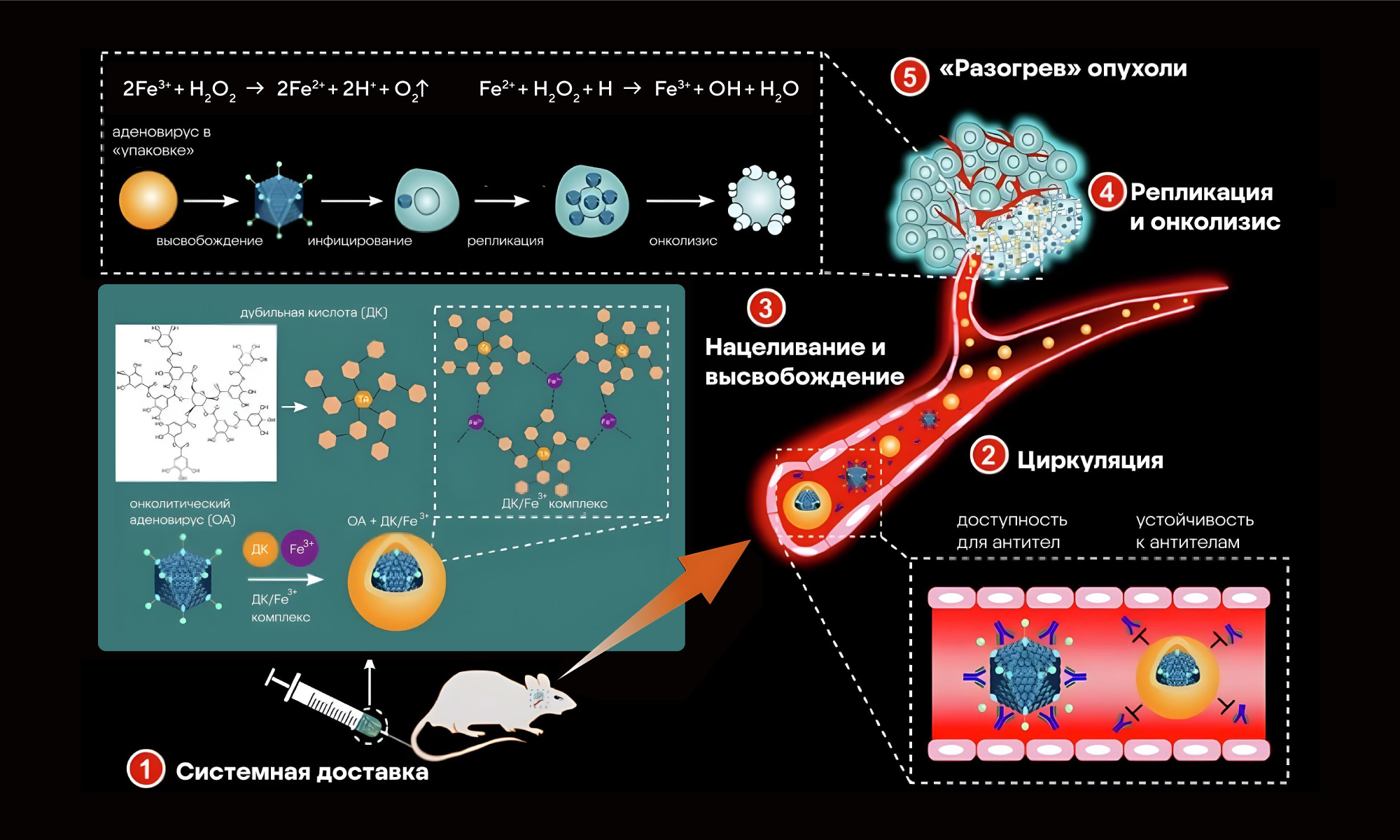
Схема эксперимента: чтобы «разогреть» опухоль — превратить «холодную», недоступную для терапии опухоль в «горячую», видимую для иммунных клеток — исследователи использовали онколитический аденовирус. Для успешной таргетной доставки этого аденовируса его вооружили комплексом из дубильной кислоты и ионов железа Fe3+. Источник: Cancer Gene Therapy