Научный дайджест #25: замедляем негативный опухолевый сценарий
Рак молочной железы продолжает оставаться одной из главных угроз для здоровья женщин во всем мире. Однако прогресс в изучении молекулярных причин этого заболевания не стоит на месте. И вот недавно удалось обнаружить важный механизм, который потенциально может «обуздать» течение злокачественного новообразования или по крайней мере сделать его более контролируемым. О том, благодаря чему будет возможно изменять негативный опухолевый сценарий, а также о других важных новостях современной онкологии читайте в нашем новом дайджесте!
Как повысить эффективность терапии острого лимфобластного лейкоза
Острый лимфобластный лейкоз — злокачественное заболевание крови, которое наиболее часто встречается у детей и характеризуется быстрым размножением незрелых лимфоцитов. Один из ключевых «игроков» в лечении этой болезни — фермент L-аспарагиназа, который лишает опухолевые клетки необходимой аминокислоты аспарагина, подавляя их рост и выживание. К сожалению, терапевтические препараты на основе этого фермента обладают рядом минусов, в числе которых — иммуногенность, нестабильность, короткий период полувыведения и сопутствующая активность глутаминазы, которая способна вызывать нейротоксичность и панкреатит. Более «продвинутые» версии препаратов лишены части недостатков, но их производство коммерчески дорого.
Чтобы решить эту проблему и создать терапевтически эффективные и одновременно недорогие препараты, исследователи из Индии разработали модифицированные варианты L-аспарагиназы с улучшенными свойствами. В их числе — повышенная стабильность, сниженная иммуноактивность и увеличенная эффективность. Такие модификации позволяют снизить побочные эффекты и увеличить терапевтическую безопасность препарата. Возможно, разработка препаратов на основе подобных вариантов фермента улучшит результаты лечения детей с острым лимфобластным лейкозом и сократит риски осложнений. — Engineered L-asparaginase variants with enhanced therapeutic properties to improve treatment of childhood acute lymphatic leukemia.
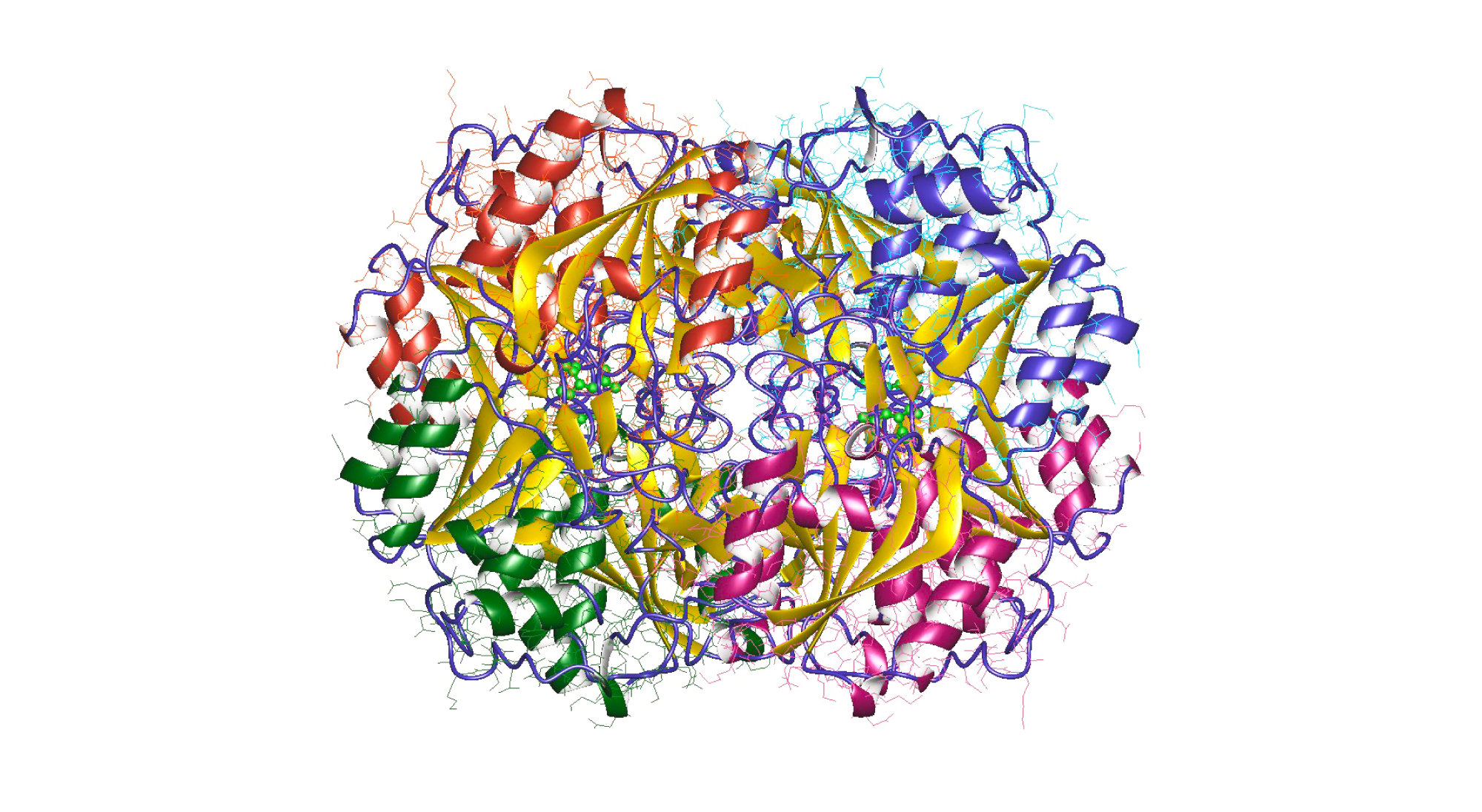
Структура фермента L-аспарагиназы, который производится с помощью бактерии Escherichia coli. С помощью направленного мутагенеза исследователям удалось создать два варианта фермента, заменив определенные аминокислотные остатки. Источник: «Википедия»
Роль длинной некодирующей РНК в прогрессии рака молочной железы
Длинные некодирующие РНК (long non-coding RNAs, lncRNAs) — важные регуляторы клеточных процессов: в частности, они влияют на экспрессию генов и способны изменять ключевые функции в клетках. В исследовании, проведенном международной командой ученых, изучалась lncRNA PRSS23-AS1 и ее участие в развитии рака молочной железы — одного из самых распространенных видов онкологических заболеваний у женщин. Ученые выяснили, что молекула PRSS23-AS1 способна регулировать процессы эпителиально-мезенхимального перехода (Epithelial-mesenchymal transition, EMT) — это ключевой механизм, способствующий метастазированию. Механизм задействует ось miR-3176 и белок YBX1, влияя на подвижность и агрессивность опухолевых клеток.
Изучение роли PRSS23-AS1 в регуляции EMT подсвечивает значение молекулярных механизмов опухолевой агрессии. Это исследование открывает перспективы для разработки таргетных терапевтических стратегий, направленных на блокирование молекулярных взаимодействий, способствующих метастазированию. Получается, что PRSS23-AS1 может стать потенциальной мишенью в борьбе с прогрессированием рака молочной железы, повышая эффективность лечения и улучшая прогноз для пациентов. — Long non-coding RNA PRSS23-AS1 as ceRNA promotes breast cancer progression by regulating EMT via miR-3176 /YBX1 axis.
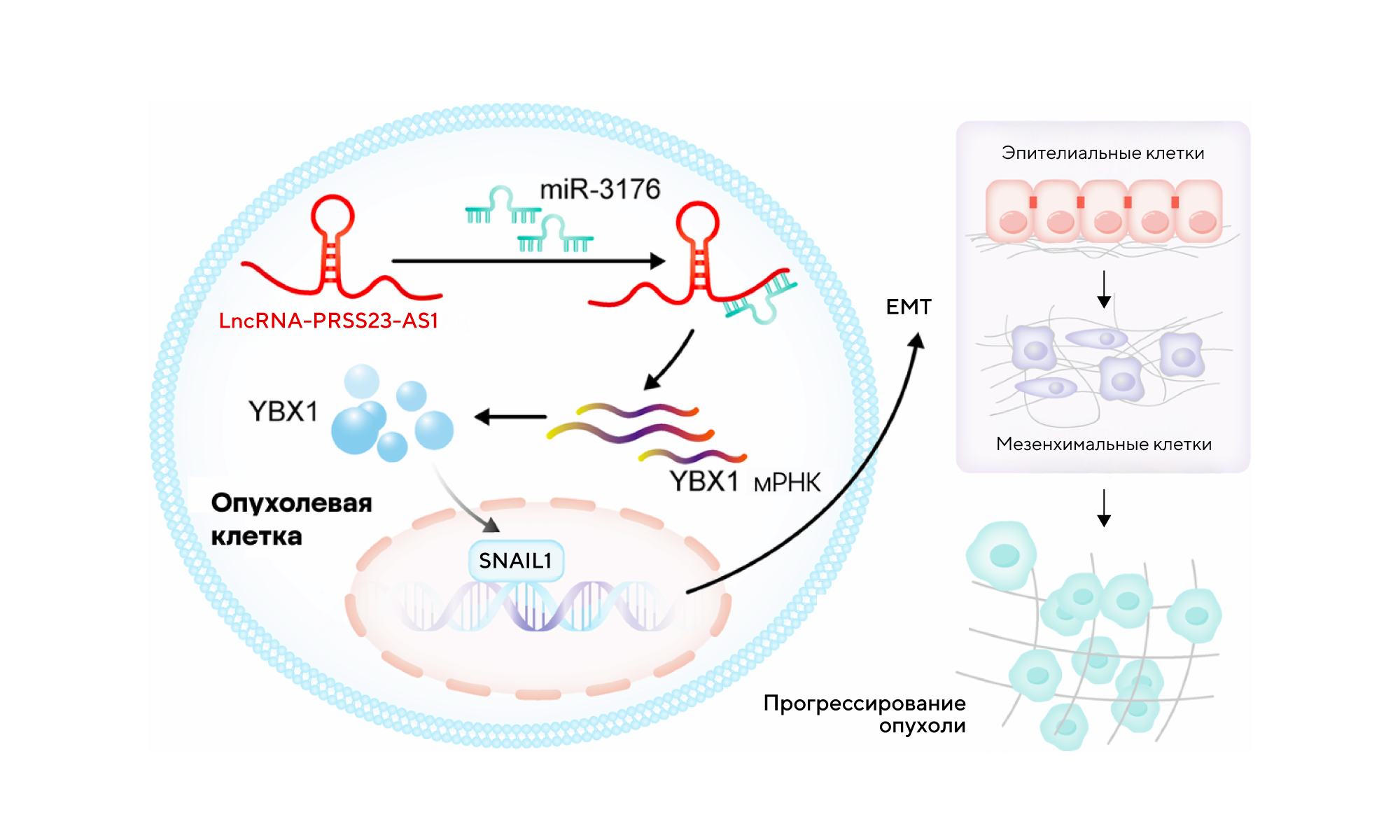
В исследовании изучали роль длинной некодирующей РНК Lnc-PRSS23-AS1 и экспрессии miR-3176 в процессах опухолеобразования. Выяснилось, что «выключение» Lnc-PRSS23-AS1 или повышенная экспрессия miR-3176 подавляли пролиферацию, миграцию и инвазию клеток рака молочной железы in vitro и in vivo. И наоборот, ингибирование miR-3176 или повышенная экспрессия YBX1 обращали эти эффекты вспять. Источник: адаптировано из Cancer Gene Therapy
Как спрогнозировать риск развития колоректального рака
Семейный аденоматозный полипоз — наследственное заболевание, при котором в толстой кишке образуются сотни и тысячи полипов. Эти образования значительно повышают риск развития колоректального рака. В предупреждении и снижении рисков помогают ранняя диагностика и прогнозирование вероятности перерождения этих полипов в злокачественные новообразования, но главным вопросом остается то, как «схватить болезнь за хвост» на ее начальных этапах развития. Недавно ученым из Израиля удалось разработать инновационный метод прогнозирования риска колоректального рака у пациентов с полипозом. Суть этого подхода — в использовании особых органоидов, которые представляют собой модели кишечной ткани, выращенные из стволовых клеток конкретного пациента. Создавая такие миниатюрные «копии» кишечника персонально для разных людей, исследователи смогли протестировать поведение клеток и их реакцию на различные факторы. В результате удалось предсказать вероятность малигнизации более точно, чем с использованием традиционных методов. Более того, использование таких органоидов открывает перспективы для разработки индивидуальных терапевтических стратегий. — Predicting colorectal cancer risk in FAP patients using patient-specific organoids.
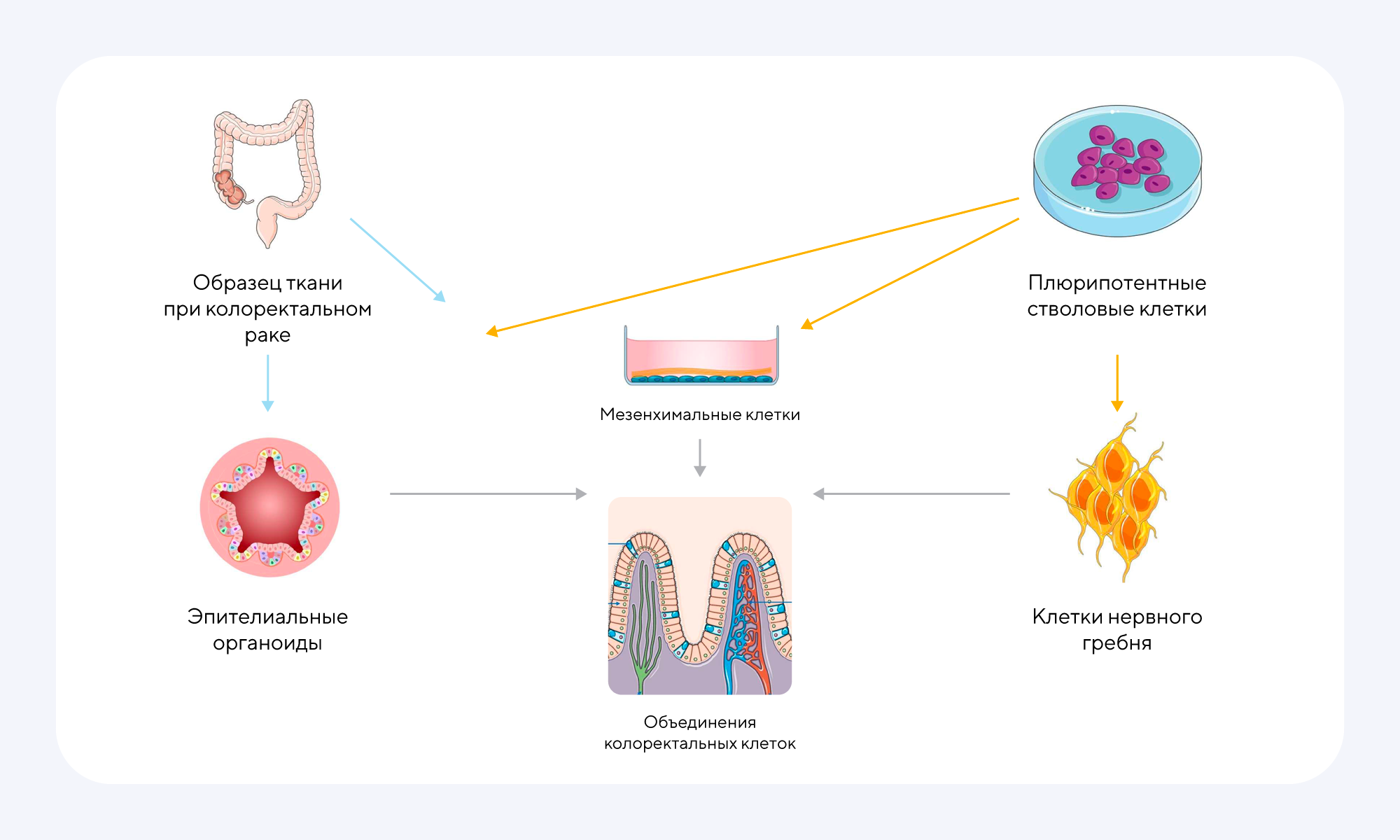
Клеточные модели кишечника и желудочно-кишечного тракта создают с помощью стволовых клеток, которые выделяют из биоптатов толстой кишки, или плюрипотентных стволовых клеток, полученных из клеток кишечника человека. После дифференцировки в клетки нервного гребня, сфероиды кишечника и мезенхимальные клетки три полученные субпопуляции объединяются для формирования так называемых «клеточных ассамблей» — групп клеток, которые взаимодействуют друг с другом и образуют функциональные структуры, не являясь при этом настоящими органами. Источник: адаптировано из preprints.org
Открываем новые горизонты для терапии множественной миеломы
Множественная миелома — злокачественное заболевание крови, при котором опухолевые клетки активно размножаются в костном мозге. В редких случаях это состояние отягощается распространением миеломы, когда опухоль выходит за пределы костного мозга, что значительно ухудшает прогноз и ограничивает возможности лечения. Для пациентов с подобным течением заболевания особенно важны инновационные подходы, направленные на целенаправленное уничтожение опухолевых клеток.
В новом исследовании, посвященном активности CAR-T-клеток и биспецифических антител у пациентов со множественной распространяющейся миеломой, удалось выявить важные закономерности. Так, с помощью CAR-T-терапии и одновременного использования препаратов на основе биспецифических антител удавалось повысить эффективность лечения. Конкретно в ходе исследования подробно изучали механизмы действия этих стратегий на опухоли, расположенные за пределами костного мозга, что до настоящего момента оставалось нерешенной задачей. Полученные результаты показывают, что оба подхода — и CAR-T-терапия, и биспецифические антитела — способны эффективно активировать иммунную систему против очагов миеломы за пределами костного мозга. Это открывает новые перспективы лечения этой сложной формы заболевания, и, в частности, позволяет достигать более глубокой ремиссии у пациентов. — Activity of CAR-T cells and bispecific antibodies in multiple myeloma with extramedullary involvement.
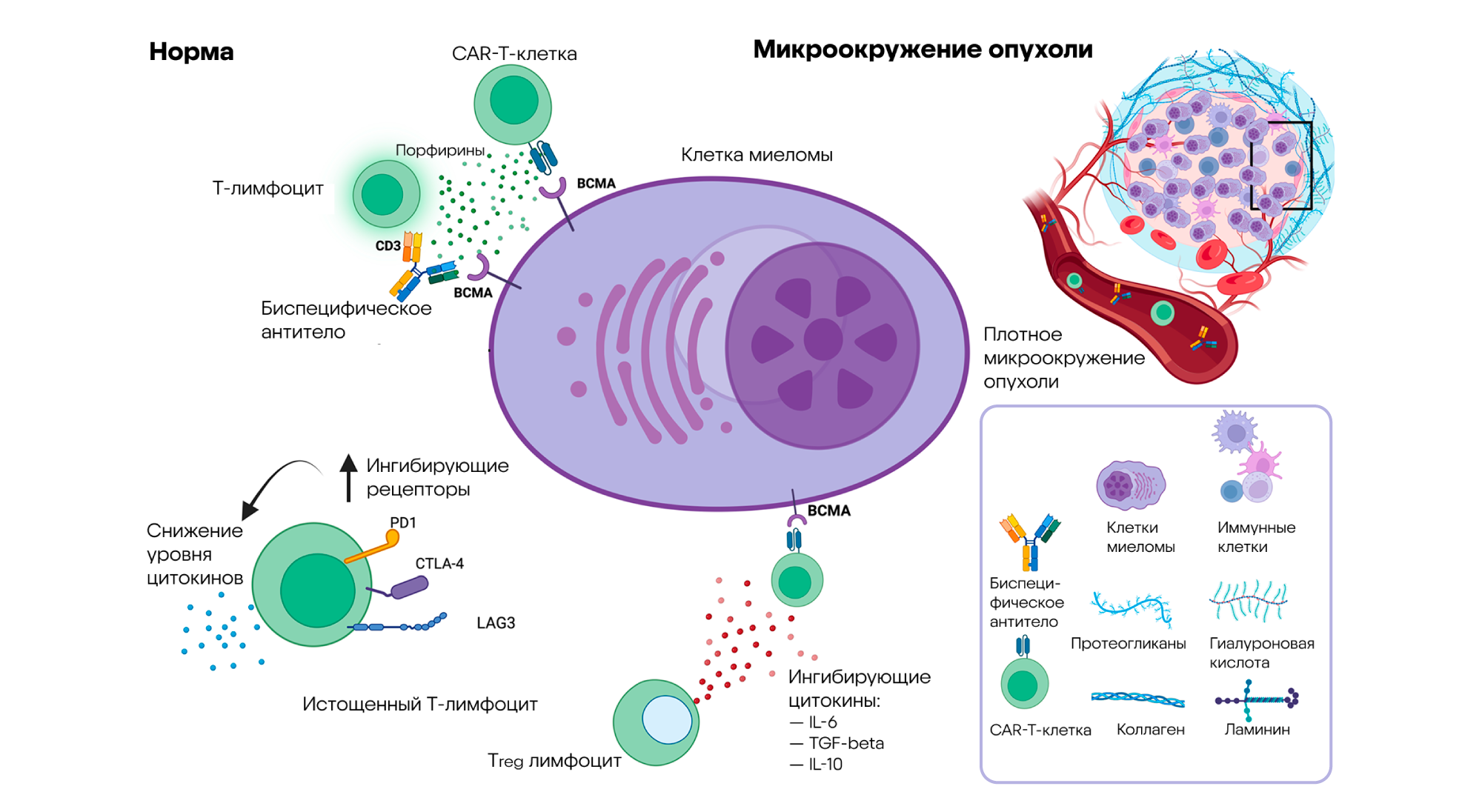
Одна из перспективных мишеней для лечения множественной миеломы — BCMA. Это белок, обнаруженный на поверхности миеломных клеток, что делает его основной мишенью для терапии, направленной на атаку и уничтожение клеток опухоли. Некоторые методы лечения, связанные с нацеливанием на BCMA, уже показали значительный успех в клинических испытаниях. К ним относятся методы лечения с помощью CAR-T-клеток, конъюгатов антител с лекарственными препаратами (ADC) и биспецифических антител. Источник: адаптировано из MDPI
Найдена перспективная мишень для лечения мантийноклеточной лимфомы
Мантийноклеточная лимфома — агрессивный тип неходжкинской лимфомы, связанный с плохим прогнозом и ограниченными вариантами лечения. Главная проблема при этом заболевании — нарушение работы генов, регулирующих рост и выживание опухолевых клеток. Чтобы открывать новые возможности для разработки более эффективной терапии мантийноклеточной лимфомы, важно понимать молекулярные механизмы, управляющие этой патологией. Именно поэтому ученые из Испании решили сфокусироваться на «внутренней кухне», приводящей к развитию заболевания. В результате удалось выяснить, что ключевую роль в активации онкогенных программ транскрипции при этом виде лимфомы играет комплекс, состоящий из транскрипционного фактора SOX11 и хроматин-ремоделирующего белка SMARCA4. Исследователи показали, что взаимодействие SOX11 и SMARCA4 усиливает экспрессию генов, способствующих росту и выживанию опухолевых клеток, тем самым поддерживая развитие болезни. Эти данные были получены с помощью комплексных молекулярных и функциональных анализов опухолевых образцов и моделей мантийноклеточной лимфомы.
Открытие комплекса SOX11:SMARCA4 как центрального регулятора онкогенной транскрипции открывает новые перспективы для разработки препаратов, способных блокировать это взаимодействие и тем самым подавлять рост лимфомы. Возможно, в будущем это позволит разработать более точечные и эффективные методы лечения мантийноклеточной лимфомы, что улучшит прогноз для пациентов с этим агрессивным заболеванием. — The SOX11:SMARCA4 complex is a driver of oncogenic transcriptional programs in mantle cell lymphoma.
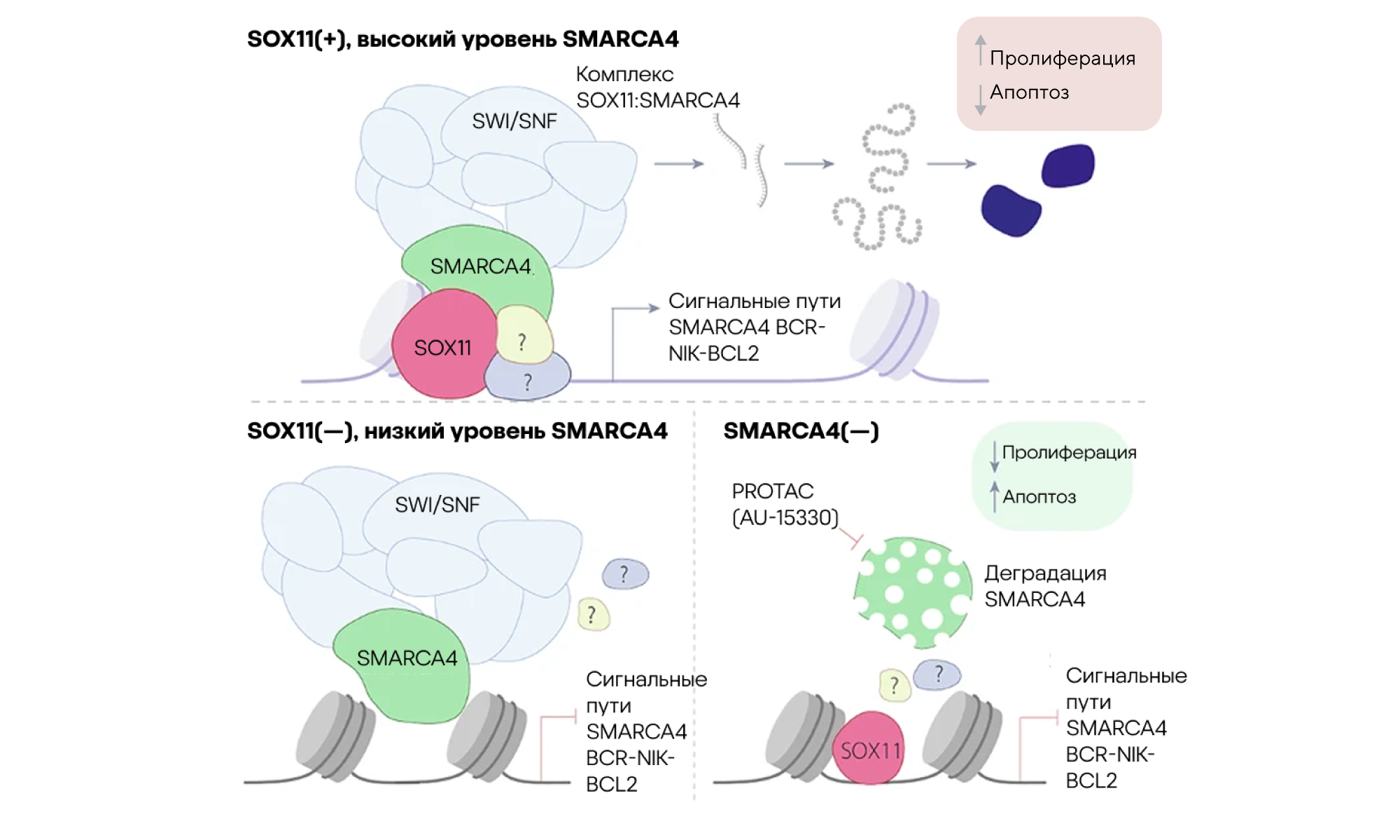
Объектом исследования стали транскрипционный фактор SOX11 и белок SMARCA4: так, экспрессия гена, кодирующего белок SMARCA4, напрямую регулируется SOX11, и повышение экспрессии коррелирует с ухудшением прогнозов болезни у пациентов с мантийноклеточной лимфомой. Специфичный для SMARCA4 «деградатор» PROTAC AU-15330 значительно снижал связывание SOX11 со специфическими регуляторными областями и уменьшал активацию сигнальных путей BCR, NIK и BCL2. Более того, деградация SMARCA4 значительно снижала пролиферацию и индуцировала апоптоз SOX11-позитивных клеток MCL, что делает AU-15330 перспективным для терапии пациентов с возможным рецидивом после применения современных таргетных методов лечения мантийноклеточной лимфомы. Источник: адаптировано из Blood Cancer Journal
Новый подход для борьбы с колоректальным раком
Колоректальный рак остается одной из ведущих причин смертности от злокачественных новообразований во всем мире. Поэтому ученые продолжают разрабатывать всё более эффективные и специфичные методы терапии, способные избирательно уничтожать опухолевые клетки. Так, известна одна из перспективных мишеней против колоректального рака — белок B7-H3, который часто сверхэкспрессирован на поверхности опухолевых клеток при колоректальном раке и связан с прогрессией болезни и устойчивостью к лечению. Однако до недавнего времени было непонятно, как «выключить» этот белок.
В недавнем исследовании ученые из Китая продемонстрировали эффективность химерных антигенных рецепторов (CAR-T-клетки), направленных против B7-H3. Эти клетки обладают выраженным цитотоксическим эффектом в экспериментальных моделях — как в органоидах, полученных от пациентов с колоректальным раком, так и в тканевых ксенотрансплантатах печени. Эти модифицированные CAR-Т-клетки эффективно распознают и уничтожают опухолевые клетки, при этом минимально воздействуя на здоровые ткани, что свидетельствует о высокой специфичности и потенциале для клинического применения.
Полученные результаты открывают перспективы для создания новых иммунотерапевтических подходов, способных улучшить выживаемость пациентов с метастатическим колоректальным раком, особенно при поражении печени — важной и частой мишени метастазирования. CAR-T-терапия против B7-H3 может стать важным дополнением к существующим методам лечения, повышая их эффективность и снижая риск рецидива. — The pronounced cytotoxic effects of chimeric antigen receptor T cells targeting B7-H3 in organoids and liver xenografts derived from colorectal cancer patients.
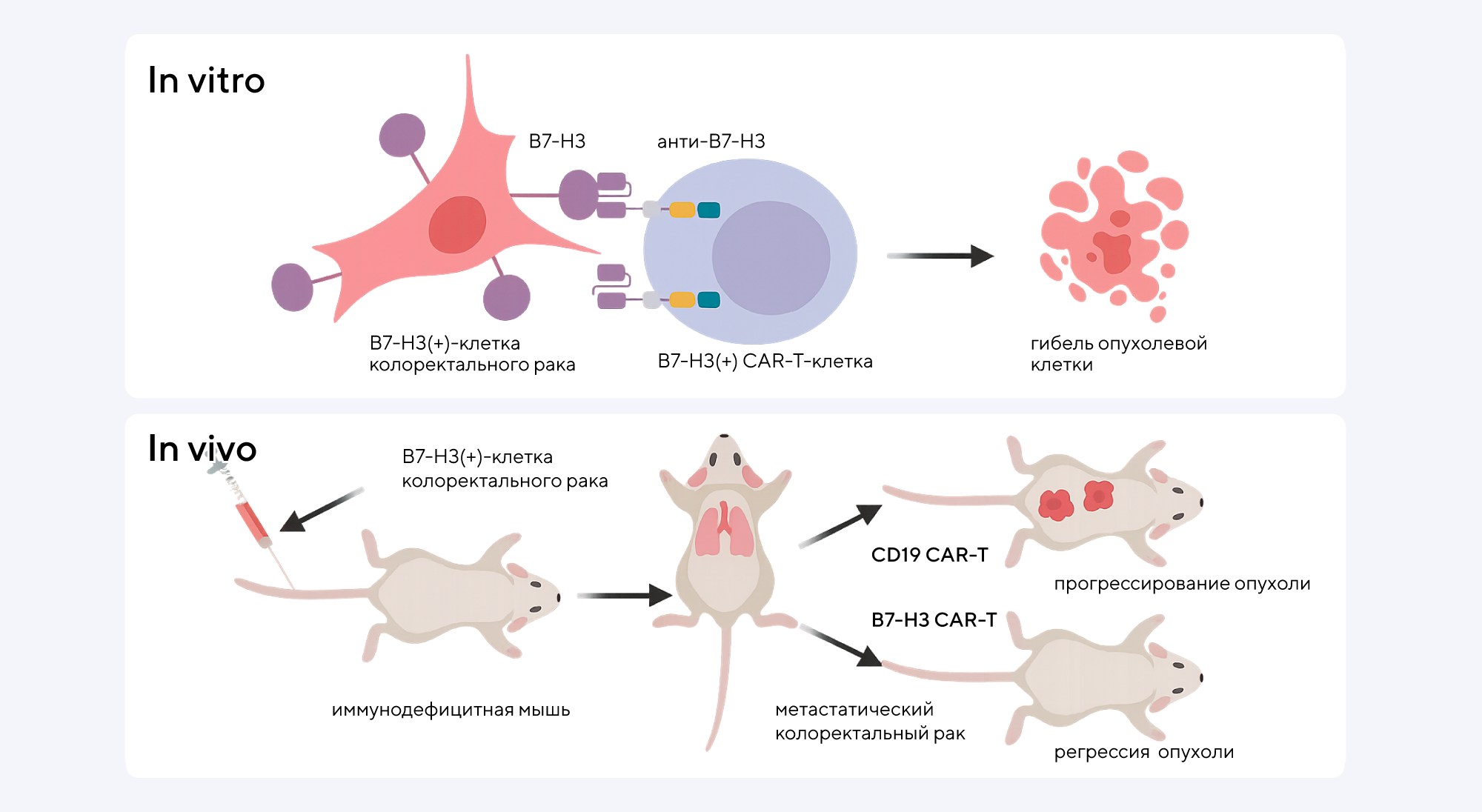
Исследователям удалось разработать CAR-T-клетки, нацеленные против B7-H3 (B7-H3 CAR-T), и оценить их противоопухолевую активность in vitro и in vivo. Источник: адаптировано из British Journal of Cancer