
Научный дайджест #28: меняем правила игры в диагностике опухолей
Можно ли найти одиночные опухолевые клетки, которые «затаились в тени» после основного курса лечения множественной миеломы? Оказывается, да — их можно детектировать с помощью секвенирования РНК (RNA-seq). Этот метод позволяет выявлять остаточные клетки миеломы с поразительной чувствительностью. О том, как может измениться подход к диагностике и лечению злокачественных новообразований благодаря этому открытию, а также о других значимых событиях в молекулярной онкологии — читайте в новом выпуске нашего дайджеста!
Как РНК-секвенирование помогает при множественной миеломе
Множественная миелома — злокачественное заболевание крови, при котором опухолевые клетки накапливаются в костном мозге и вызывают поражение костной ткани. Для успешного лечения миеломы важно точно определить уровень минимальной остаточной болезни (МОБ), то есть то небольшое количество злокачественных клеток, которые остаются после терапии и способны вызвать рецидив.
В новом исследовании ученые использовали технологию секвенирования РНК (RNA-seq) для выявления МОБ с высокой чувствительностью. С помощью этого метода можно детектировать даже минимальные признаки опухоли на молекулярном уровне, что значительно превосходит традиционные подходы с точки зрения точности и прогностической ценности. Авторы продемонстрировали, что RNA-seq позволяет эффективно отслеживать наличие и динамику МОБ у пациентов с множественной миеломой на протяжении всего лечения. Эти результаты открывают возможность раннего и точного выявления минимальной остаточной болезни для повышения эффективности лечения множественной миеломы и улучшения прогноза пациентов. — Using RNA-seq for detecting MRD in multiple myeloma: high sensitivity and prognostic value.
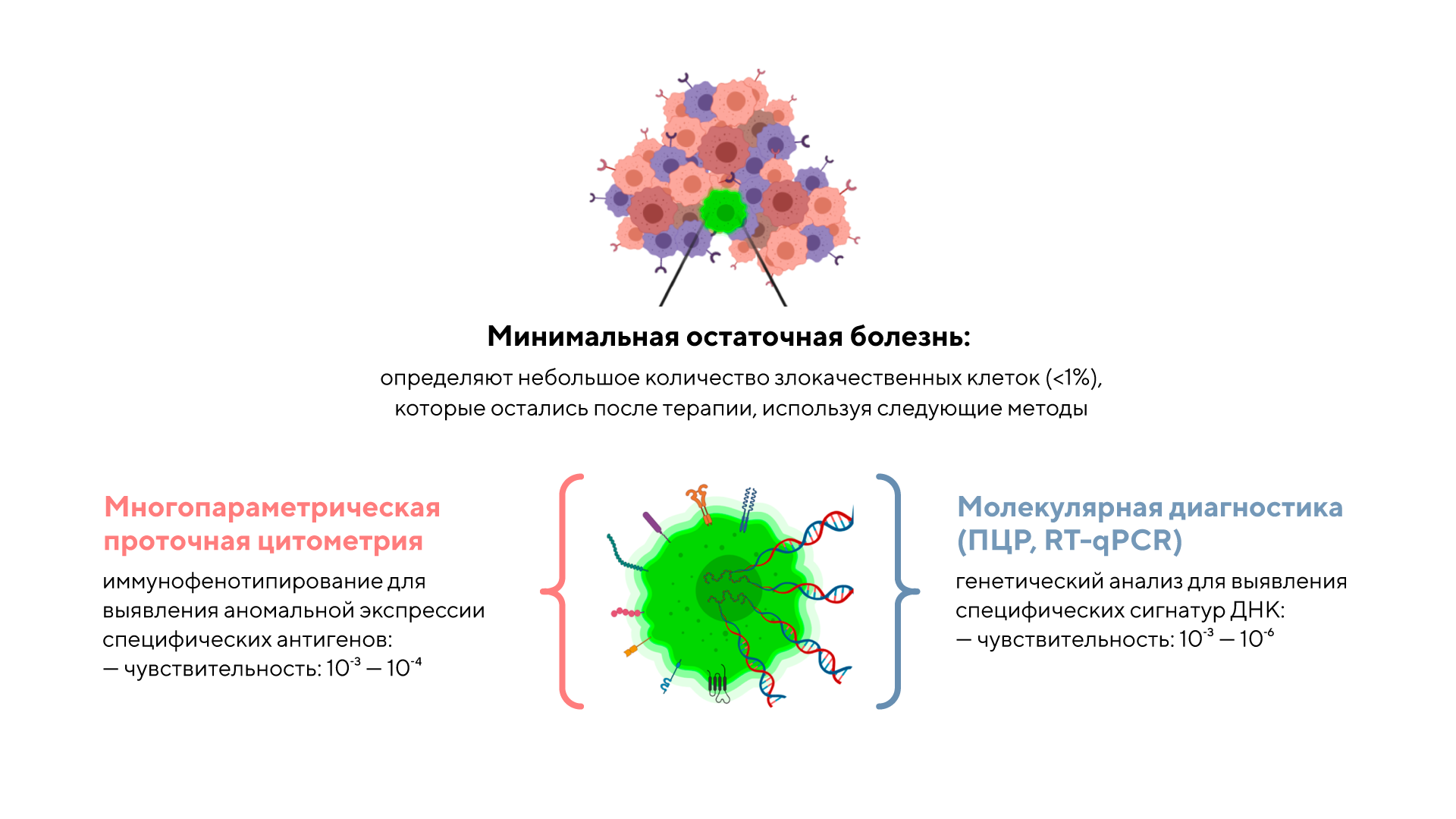
Взаимодополняющие иммунофенотипические и молекулярные подходы к мониторингу МОБ в гематологии. Источник: адаптировано из MDPI
Иммунные ловушки в лечении резистентной глиобластомы
Мультиформная глиобластома — одна из наиболее частых и агрессивных форм опухолей мозга, известная высокой устойчивостью к терапии и плохим прогнозом. Чтобы понять причины этой терапевтической устойчивости, ученые провели масштабный генетический скрининг для выявления онкогенов, которые изменяют иммунный ответ опухоли и способствуют развитию резистентности к лечению.
В исследовании применяли различные генетические методы, в том числе CRISP и РНК-интерференцию, что позволило раскрыть молекулярные механизмы взаимодействия опухолевых генов с иммунной системой. В ходе скрининга удалось выявить ключевые гены, которые оказывают влияние на важные иммунные пути, подавляя антивирусный и противоопухолевый иммунитет, что снижает эффективность терапии и способствует прогрессированию заболевания. На основе этих данных можно разрабатывать новые целевые подходы и комбинированные виды терапии, способные преодолеть иммунные «ловушки» и повысить успешность лечения резистентной разновидности глиобластомы. — Defining treatment-resistant brain cancer: Genetic screening to identify oncogene-driven immunomodulation and therapy resistance.
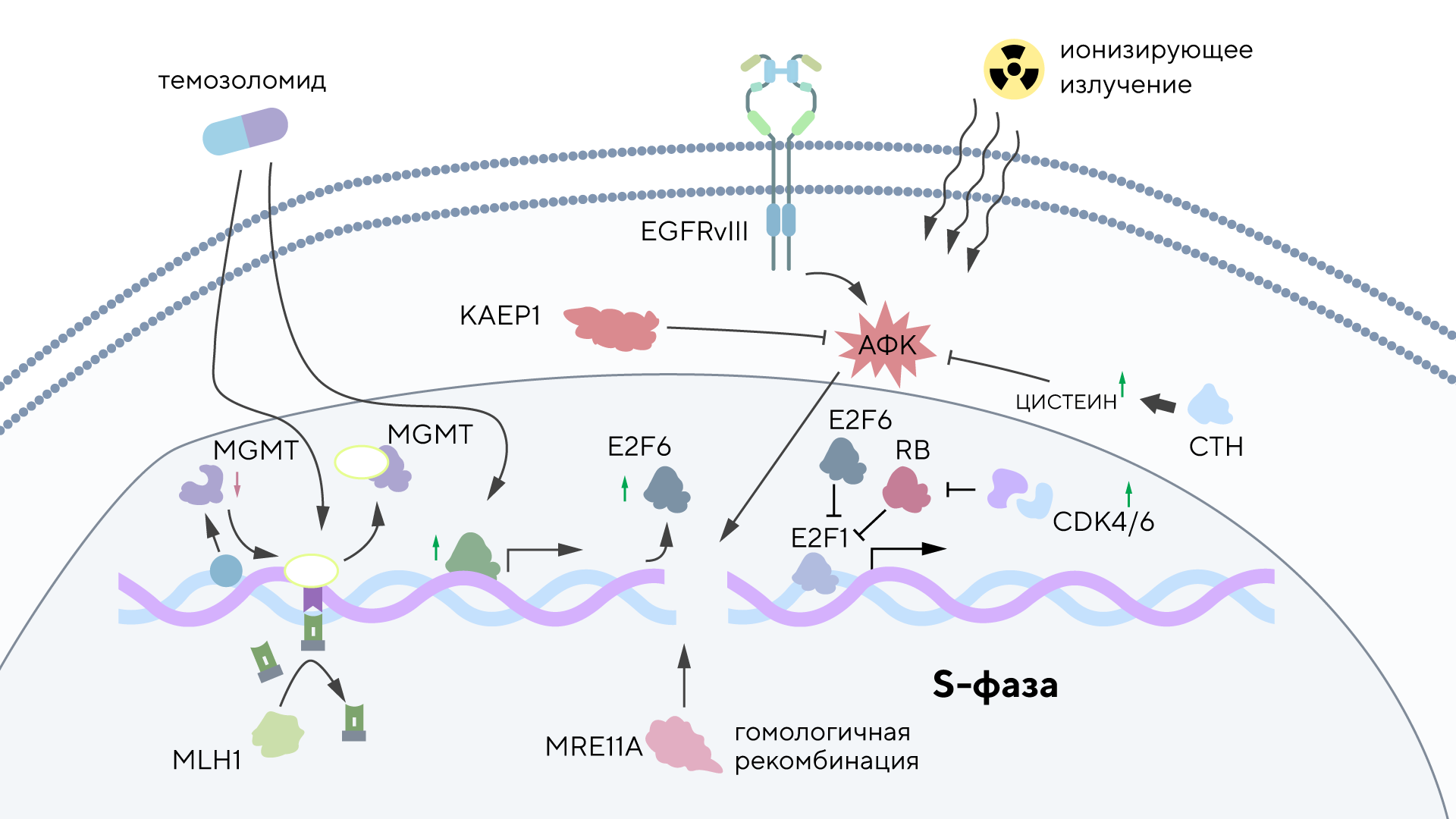
Карта молекулярных функций генов, которые отвечают за метаболизм, регуляцию клеточного цикла и репарацию ДНК. Гены были выявлены с помощью скрининга в модели резистентной глиобластомы. Источник: Cancer Gene Therapy
Какая мишень способна помочь в лечении острого лимфобластного лейкоза
Т-клеточный острый лимфобластный лейкоз (T-ALL) — агрессивное онкологическое заболевание, связанное с быстрым ростом злокачественных T-лимфоцитов. В недавнем исследовании выяснилось, что одним из важных регуляторов развития этого состояния является белок SATB1. Этот белок влияет на активность гена TXNIP — важного опухолевого супрессора, способного подавлять инвазию и инфильтрацию опухолевых клеток.
В исследовании ученые показали, что SATB1 регулирует экспрессию TXNIP, сдерживая агрессивное поведение опухолевых T-клеток и снижая их способность проникать в ткани. Это эффективно тормозит развитие лейкоза и его метастазирование. Такие результаты открывают перспективы для разработки терапевтических стратегий лечения пациентов с острым лимфобластным лейкозом, сокращая риск рецидивов и улучшая прогнозы выживаемости. — SATB1 regulates TXNIP inhibiting invasion and infiltration in T-cell acute lymphoblastic leukemia.
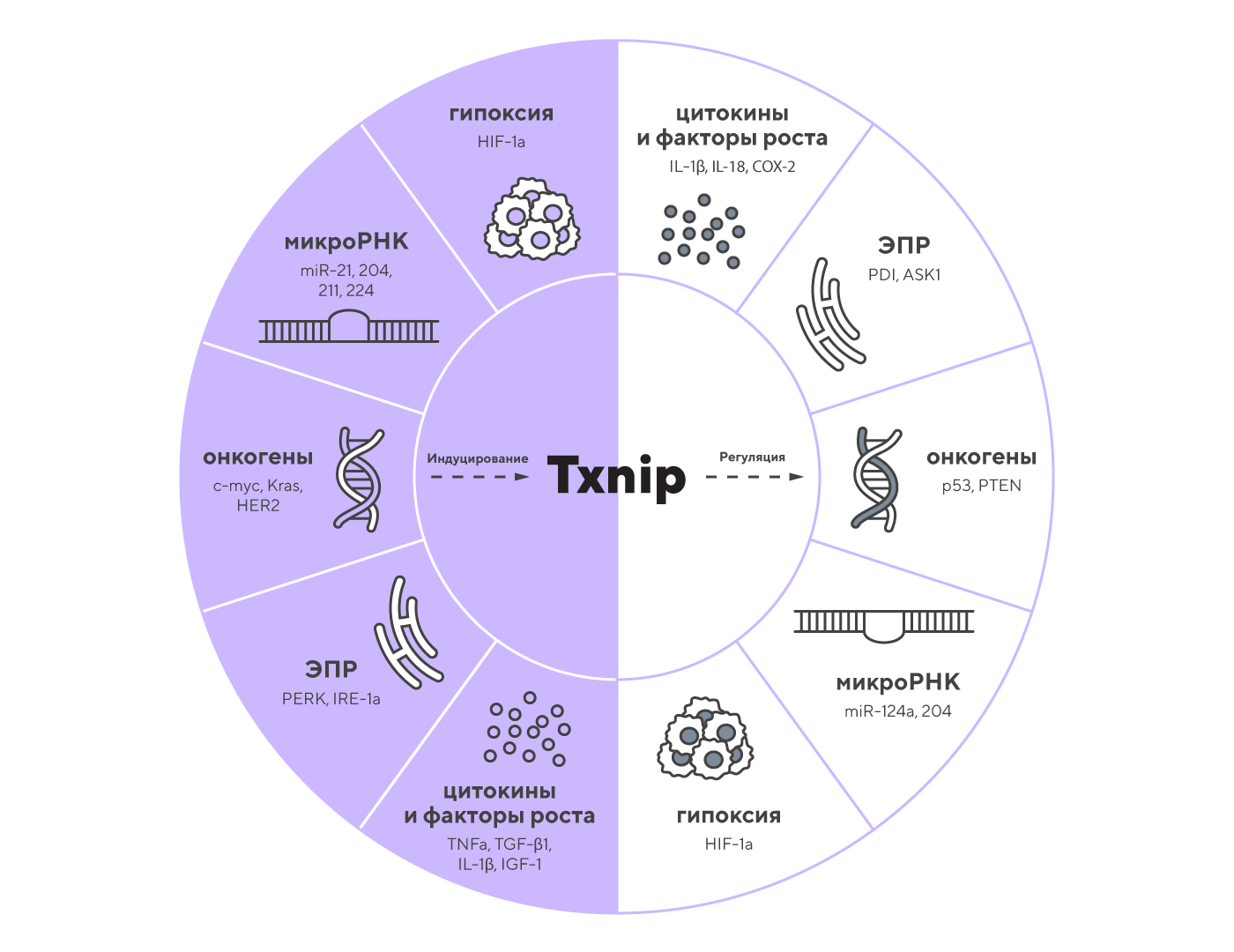
Ген TXNIP кодирует белок, взаимодействующий с тиоредоксином, который считается одним из ключевых регуляторов клеточного окислительно-восстановительного гомеостаза. Однако TXNIP выполняет гораздо более широкий спектр дополнительных функций — от регуляции метаболизма глюкозы и липидов до остановки клеточного цикла и воспаления. Источник: British Journal of Cancer
Как бороться с лекарственной устойчивостью при раке головы и шеи
Рак головы и шеи — одна из наиболее агрессивных форм злокачественных новообразований. Сложность лечения этого заболевания связана с высокой частотой развития устойчивости к стандартной химиотерапии, в частности к препарату цисплатину. Эта устойчивость значительно снижает эффективность лечения и ухудшает прогноз для пациентов. В поисках механизмов преодоления лекарственной резистентности ученые обратили внимание на молекулу ATP7B (ATPase copper transporting beta), которая участвует в транспортировке меди внутри клеток.
Удалось выяснить, что ATP7B играет ключевую роль в регуляции внеклеточных везикул — маленьких пузырьков, которые клетки выделяют для межклеточного взаимодействия и выведения токсинов. Оказалось, что, контролируя работу этих везикул, ATP7B способствует развитию устойчивости опухолевых клеток к цисплатину, помогая им выводить препарат и избегать его цитотоксического воздействия. Это открытие проливает свет на молекулярные механизмы, лежащие в основе сопротивляемости химиотерапии, и может стать фундаментом для создания новых стратегий лечения. — ATPase copper transporting beta contributes to cisplatin resistance as a regulatory factor of extracellular vesicles in head and neck squamous cell carcinoma.
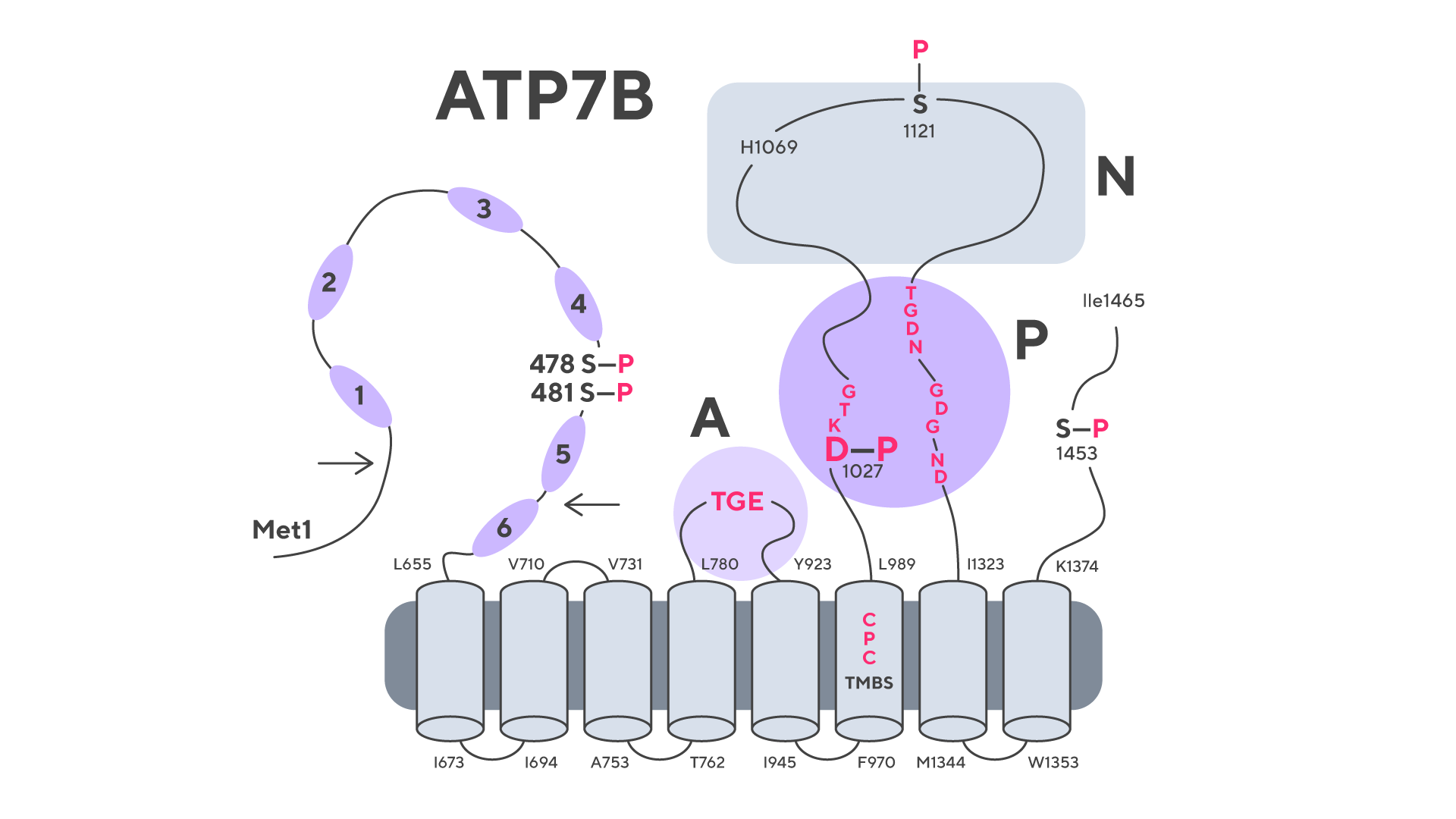
Двумерная модель сворачивания последовательности белка ATP7B. Источник: ReseachGate
Как аденовирус, «вооруженный» SMAD4, усиливает действие химиотерапии
Немелкоклеточный рак легкого (НМРЛ) — одно из наиболее распространенных и смертельно опасных заболеваний, которое часто плохо поддается лечению. Ученые ищут новые способы повысить эффективность химиотерапии и добиться более стойкого подавления опухоли при НМРЛ.
В недавнем исследовании ученые использовали онколитический аденовирус, «вооруженный» геном супрессора опухолей SMAD4, который избирательно заражает и уничтожает опухолевые клетки при НМРЛ. Ключевой механизм действия вируса — подавление сигнального пути Wnt/β-катенина, известного своей ролью в росте и выживании опухолевых клеток. Использование этого вируса в сочетании с традиционной химиотерапией усиливает противоопухолевый эффект, препятствуя развитию резистентности к лечению. Получается, что комбинированная терапия с SMAD4-экспрессирующим онколитическим вирусом потенциально может значительно улучшить результаты лечения пациентов с НМРЛ. — SMAD4-armed oncolytic adenovirus therapy potentiates the chemotherapy effects in NSCLC through suppression of the Wnt/β-catenin pathway.
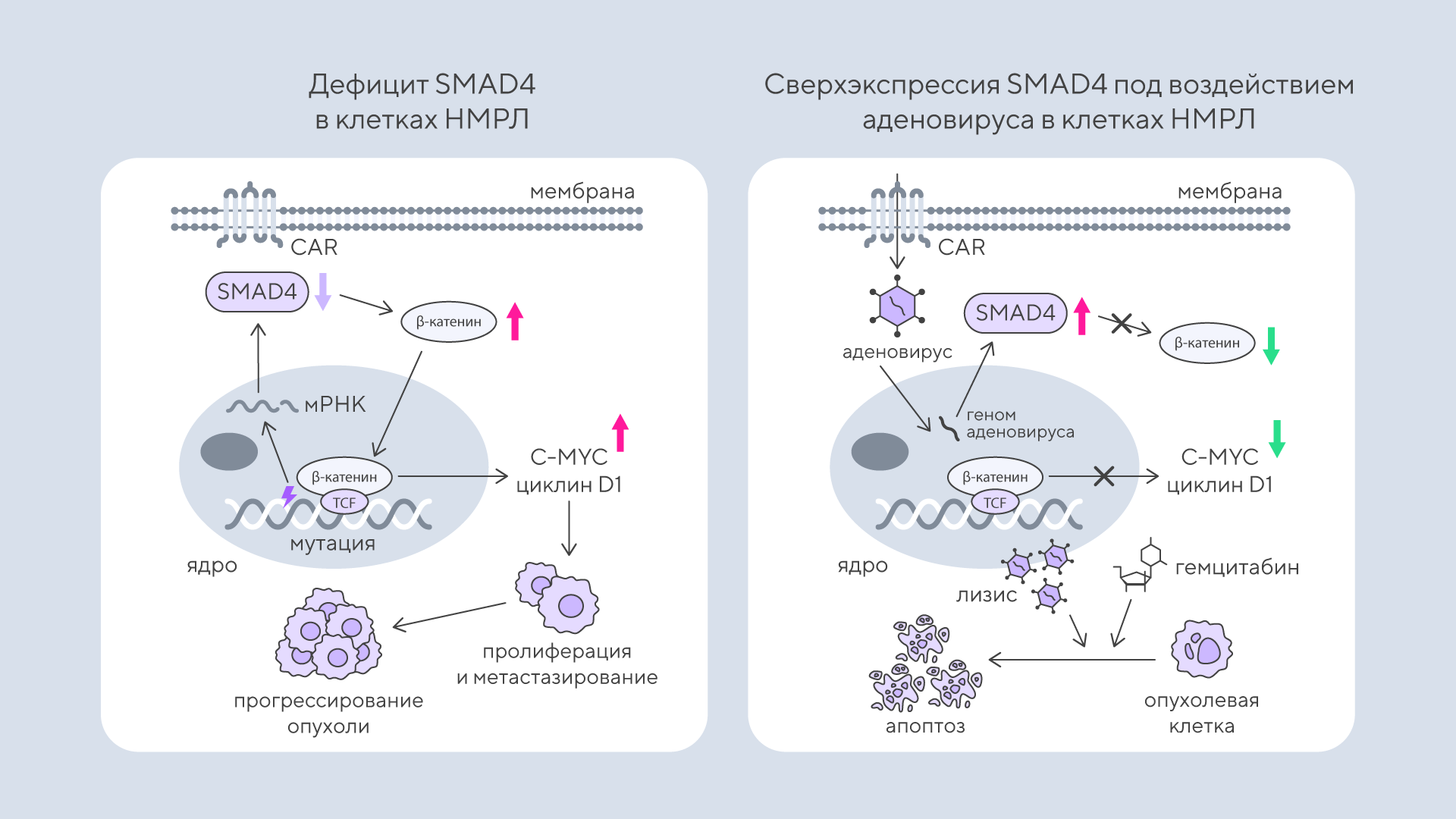
Схема исследования. Ученым удалось показать, что сочетание онколитического аденовируса, кодирующего SMAD4, с гемцитабином обеспечивало более эффективное подавление опухоли по сравнению с монотерапией НМРЛ. Источник: Cancer Gene Therapy