Клиническая разработка на примере Тенексиа®: планируем маршрут терапии
При разработке любого лекарственного препарата важно учесть все возможные вопросы: как именно он будет применяться, какую схему использовать для лечения пациентов и в какой дозировке его рекомендовано назначать. В этой статье расскажем о том, как проходила клиническая разработка оригинального препарата Тенексиа® для терапии ремиттирующего рассеянного склероза.
Разрабатываем ПЭГ-интерфероны для лечения рассеянного склероза
Один из потенциальных белков, который может использоваться для терапии рассеянного склероза, — это интерферон β. Его получают из клеток млекопитающих, потому что по своему составу и свойствам он похож на интерферон β у людей. Но широкое использование препаратов на основе обычного интерферона β ограничено, так как этот белок слишком быстро выводится из организма и обладает высокой иммуногенностью. Эти недостатки можно устранить, если использовать пегилированные молекулы интерферона, которые обладают пролонгированным действием.
Зачем пегилировать интерферон?
В молекуле ПЭГ-интерферона молекула белка связана с полиэтиленгликолем (ПЭГ), водорастворимым полимером. Благодаря химическим свойствам «довеска» в виде ПЭГ интерферон приобретает высокую гидрофильность, то есть растворимость в воде. Молекула белка с ПЭГ в воде превращается в объемный шарик, который обладает двумя важными преимуществами: хорошо проходит сквозь мембраны в клетках и надежно защищен «водяным щитом» от воздействия других белков (антител и системы комплемента), которые в обычных условиях нейтрализуют все, что попадается им на пути. Таким образом, благодаря ПЭГ интерферон становится более биодоступным и менее уязвимым к преждевременному разрушению в организме.
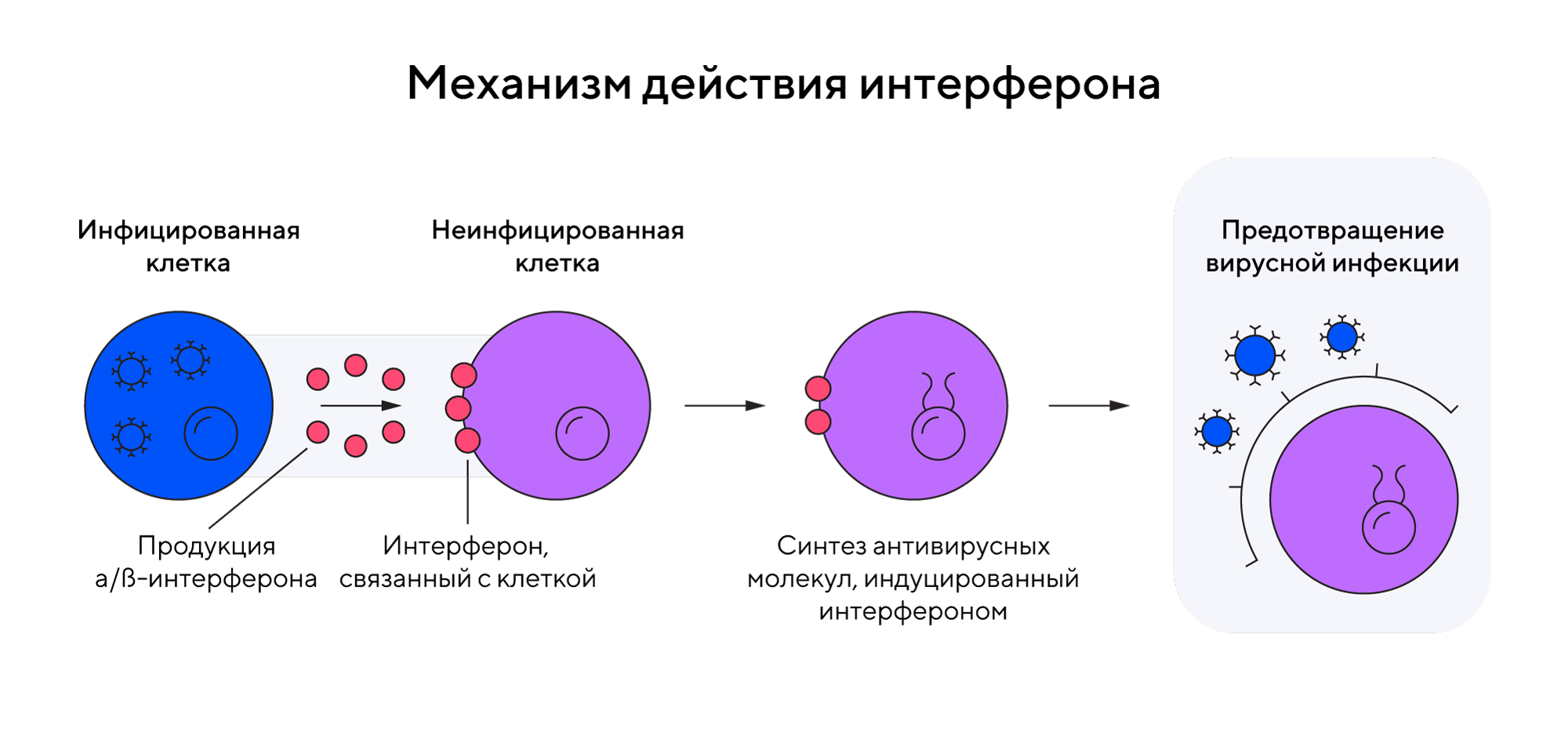
Основное преимущество пегилированного интерферона β — менее частый режим терапии: пациентам достаточно двух инъекций в месяц, в отличие от обычного интерферона, который нужно вводить чаще, как правило, через день.
Внедряем адаптивный дизайн
В продуктовом портфеле компании уже были лекарства против рассеянного склероза, причем целых пять, что позволяло обеспечивать терапией пациентов с разными формами заболевания. Но среди них не было ни одного оригинального — все они были биоаналогами или дженериками. Поэтому пегилированный интерферон стал первым оригинальным препаратом BIOCAD в портфеле ПИТРС (препаратов, изменяющих течение рассеянного склероза) и первым, в котором решили применить адаптивный дизайн.
При проведении клинических исследований мы строго соблюдаем закрепленные стандарты. Перед началом терапии составляют протокол — особый документ, без которого нельзя получить разрешение на проведение исследования.
Обычно клинические исследования состоят из трех фаз. Сначала лекарство проверяют среди группы здоровых добровольцев. Затем последовательно проводятся клинические исследования второй и третьей фазы с участием пациентов с целевым заболеванием. Исследования различаются по численности участников и могут отличаться по изучаемым параметрам.
Однако в некоторых случаях эту систему изменяют — и применяют адаптивный дизайн исследования.
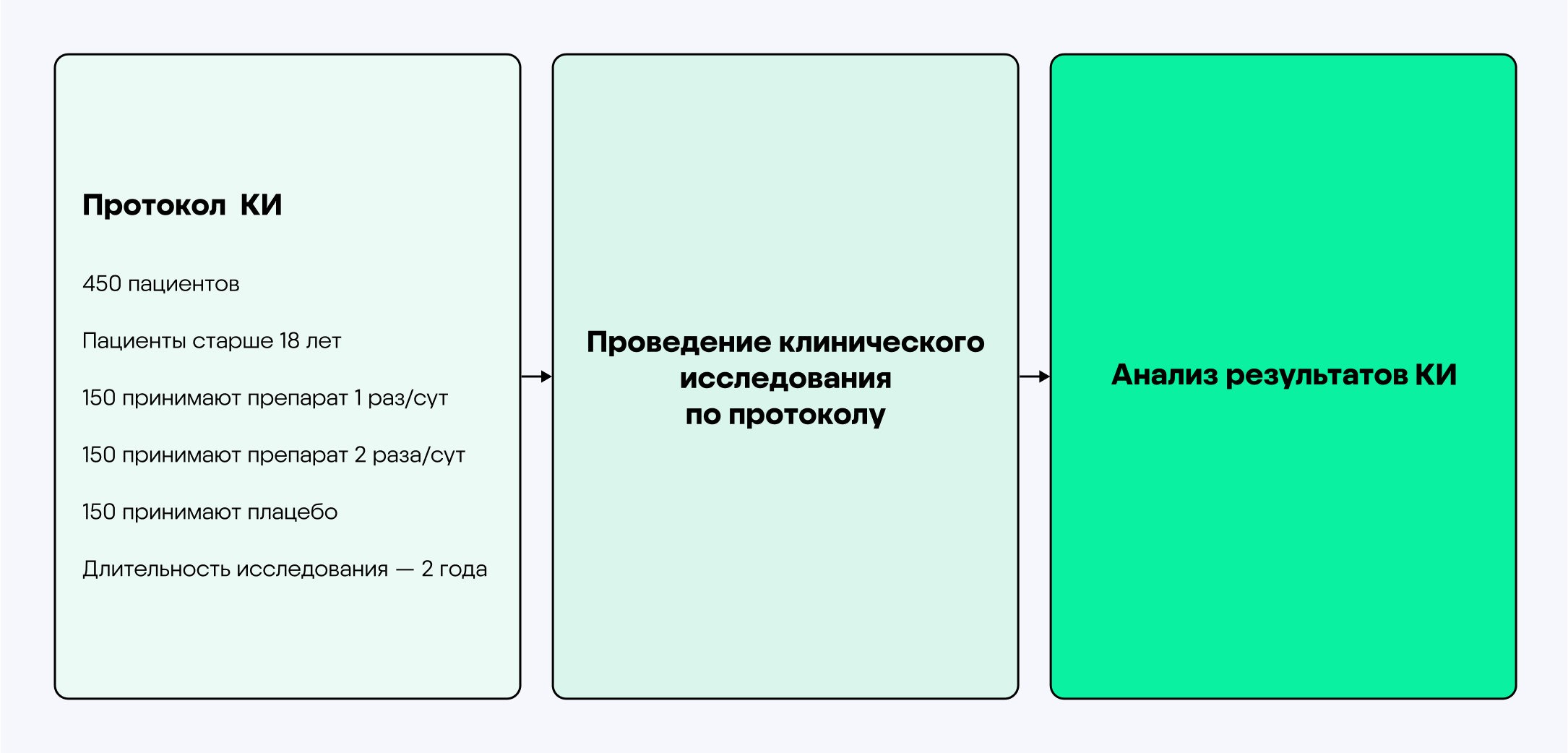
Пример схемы традиционного дизайна клинического исследования1
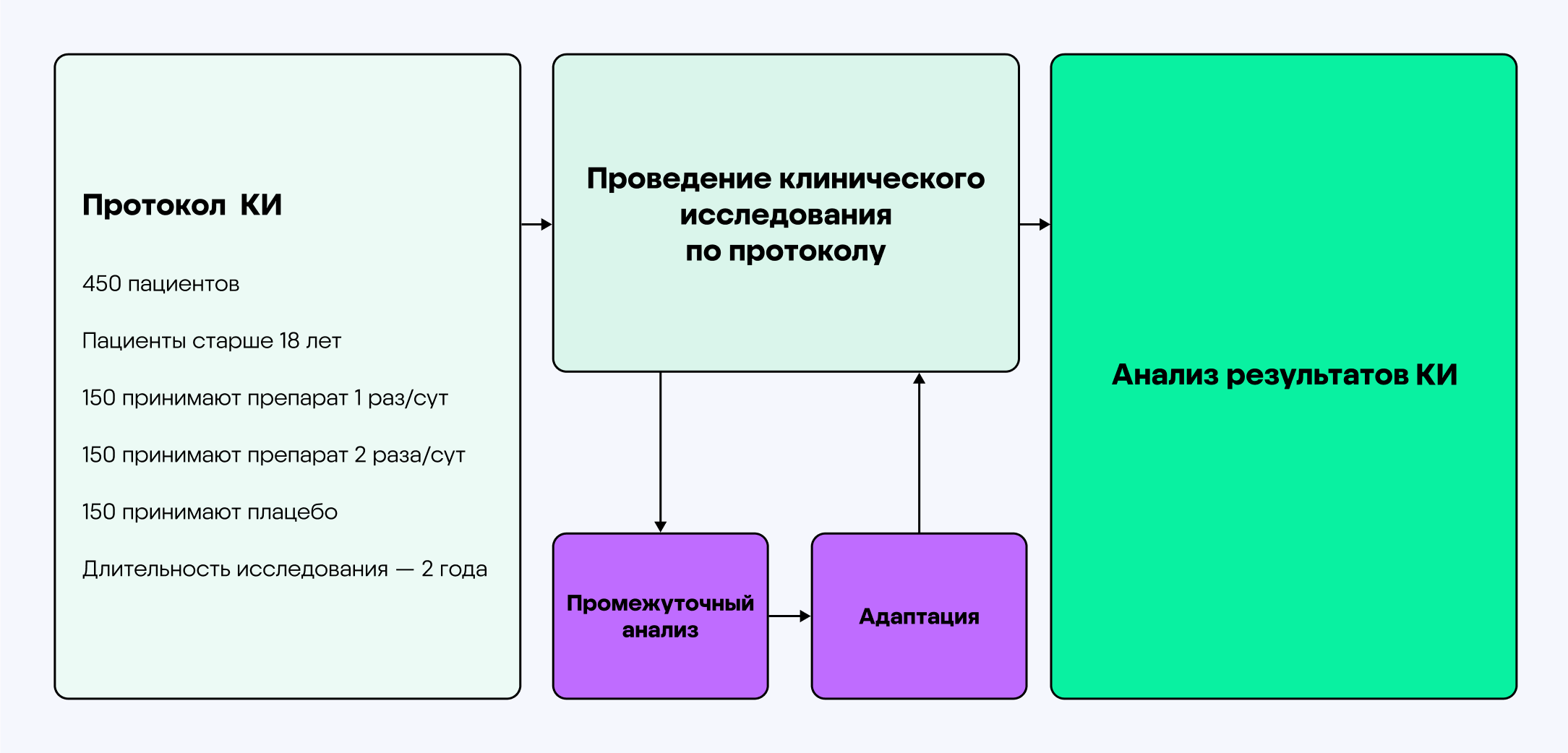
Пример схемы адаптивного дизайна клинического исследования1
В случае Тенексиа® адаптивность состояла в том, чтобы совместить вторую и третью фазы клинического исследования для пациентов с рассеянным склерозом. Этот подход позволил сократить время исследования препарата для более быстрой регистрации и дальнейшего доступа на рынок.
Разработка началась успешно: почти сразу удалось пегилировать интерферон, после чего препарат отправили на первую фазу клинических исследований, а затем начался следующий этап. Он был сложным, поскольку мы решили объединить два последовательных исследования в одно, охватывающее вторую и третью фазы, и добавить в него элементы первой фазы. В частности, нужно было подготовить большое количество промежуточных отчетов и передать их регулятору, чтобы нашей компании дали «зеленый свет» на дальнейшие этапы клинического исследования второй и третьей фазы.
В клиническом исследовании Тенексиа® участвовали не менее 399 пациентов. На самом деле количество участников — тех, кто подписал информированное согласие на участие в исследовании и участвовал в скрининге, — изначально было намного больше, просто часть пациентов не соответствовала всем критериям включения в исследование. В результате удалось завершить набор пациентов за девять месяцев — и это был рекордно короткий срок для такого количества участников.
За кадром: какие пациенты стоят за клиническими исследованиями
Интерферон β-1а применяют для лечения рассеянного склероза, и эта нозология определила портрет участников, точнее, участниц клинического исследования. Пожалуй, главная особенность — возрастная группа пациентов. Рассеянный склероз — это болезнь молодых людей 30–35 лет. Средний возраст отобранных участников для КИ Тенексиа® составил 30 лет, при этом 70% из них были женщины.
Здесь возникает первая особенность клинического исследования Тенексиа® — пациентки с рассеянным склерозом любят устраивать себе «летние каникулы». Причина, которая побуждает женщин делать перерыв в лечении, — побочные эффекты от инъекций. После введения препарата может развиваться гриппоподобный синдром, который по своим симптомам напоминает простуду: может быть повышение температуры тела, ломота в теле, озноб. Помимо этого, после укола могут оставаться следы. Это могут быть кровоизлияния, в редких случаях может развиваться атрофия подкожно-жировой клетчатки на месте укола, на коже появляется «впадина», как будто в этом месте не хватает ткани. Поэтому молодые женщины, которые летом хотят хоть немного позагорать и поносить короткие платья, устраивают отдых от инъекций. В этом плане пегилированные интерфероны имеют преимущество: их нужно вводить всего раз в две недели, а не через день, что повышает приверженность пациентов к терапии и уменьшает количество тяжелых местных реакций.
Второй нюанс тоже определяется портретом пациентов: многие из них — женщины детородного возраста. Часто бывает, что после старта клинических исследований состояние участниц улучшается, и они беременеют. Здесь хочется отметить, что эта особенность характерна не только для Тенексиа®, но и для многих неврологических исследований. Конечно, таких пациенток выводят из исследований, но, согласно правилам фармаконадзора, все равно продолжают за ними наблюдать и собирать обратную связь от врачей-исследователей — вплоть до момента рождения ребенка и как минимум в течение полугода после рождения, при условии наличия согласия.
Как проходили клинические исследования
Проведение клинических исследований Тенексиа® характеризовалось рядом особенностей. Среди них — одновременное внедрение и анализ множества опросников для пациентов. Рассеянный склероз — это тяжелое заболевание, поэтому при его изучении важно учитывать самые разные параметры, включая двигательные, чувствительные и когнитивные функции пациентов.
Также фишкой проекта стало внедрение новой роли — «центральных специалистов». Обычно в клиническом исследовании за состоянием пациентов наблюдает лечащий врач, который диагностирует динамику лечения. Но в ходе терапии случаются острые состояния, связанные с обострениями болезни. Для диагностики такого состояния мнения всего лишь одного врача может быть недостаточно. Поэтому в каждом центре присутствовал еще один врач, который не контактировал с пациентом и не собирал его жалобы. Его главной задачей было заочно оценить неврологическую симптоматику пациента по эпикризу. Однако на этом в BIOCAD не остановились — и внедрили независимую неврологическую комиссию из трех врачей. Задача комиссии — обследовать пациента и оценить его состояние, чтобы подтвердить или опровергнуть клиническое обострение.
Еще одно достижение нашей компании — в том, что для оценки эффективности препарата Тенексиа® использовали магнитно-резонансную томографию головного мозга. И это были не стандартные исследования на базе медцентра — BIOCAD удалось привлечь независимого специалиста, эксперта по лучевой диагностике. Благодаря этому удалось сделать переоценку большого количества показателей исследования. Такой шаг стал важным усовершенствованием, которое может повлиять на доказательство гипотезы клинического исследования.
Доказательство гипотез стало интересным, но сложным вызовом в клиническом исследовании Тенексиа®. Трудность нашего подхода заключалась в ступенчатом доказательстве различных гипотез, которое мы проводили в соответствии с Европейскими стандартами EMA.
Мировые регуляторные стандарты для защиты прав пациентов
Главный документ, который регулирует проведение клинических исследований — стандарт GCP (Good Clinical Practice), или рекомендации по надлежащей клинической практике. Это руководство не только описывает права участников и меры по безопасности, но и ставит своей задачей улучшать качество самих исследований. Одно из ключевых положений GCP — то, что «права, безопасность и благополучие субъекта исследования имеют первостепенное значение и должны превалировать над интересами науки и общества».
За соблюдением принципов GCP следят регуляторные органы — FDA (United States Food and Drug Administration) в США и EMA (European Medicine Agency) в Европе. В целом стандарты качества, безопасности и эффективности, которых придерживаются оба регулятора, одинаковы. Они используют похожие методы оценки новых лекарств, рассматривают одинаковую доказательную базу качества, безопасности и эффективности и имеют общие конечные цели. Однако в силу культурных и исторических различий между США и Европой, некоторые процессы у них устроены по-разному.
FDA — это скорее глобальная организация по защите прав потребителей, которая занимается не только лекарствами, но и продуктами питания или косметикой. Поэтому в США большинство лекарств и биопрепаратов обязательно должны пройти проверку в FDA, иначе их просто не выпустят на рынок. В Евросоюзе другой порядок: здесь процессы одобрения разделяют по уровням. Так, перед ЕМА обязаны отчитываться только компании-разработчики определенных категорий, в том числе биологических препаратов и лекарств от конкретных заболеваний. Любые другие продукты вне этого списка тоже могут подаваться в ЕМА, но уже добровольно.
Еще одна особенность, отличающая американских и европейских регуляторов, — разные системы анализа. В FDA в процессе принятия решения об одобрении или отклонении препарата важно провести качественный анализ, чтобы оценить возможные риски и пользу, — Benefit-Risk Framework. В EMA используют количественный анализ, при котором решение принимается с учетом множества «за» и «против» от различных экспертов.
В России рынок клинических исследований начал развиваться позже, чем в Европе и США, лишь в начале 2000-х годов. Тогда в нашей стране начали появляться офисы международных, а затем и отечественных CRO — контрактных исследовательских организаций для проведения клинических исследований. Особенность проведения КИ в России заключается в том, что уже одобренные международными регуляторами зарубежные препараты должны проходить дополнительные клинические испытания в РФ. Российские регуляторные органы заявляют, что это должно повысить качество препаратов, которые выходят на отечественный рынок. Разумеется, этого этапа не будет, если будущий препарат разрабатывает российская компания — как это и было в случае Тенексиа®.
Получается, что на российском поле клинических исследований работают три участника: заказчик исследования (например, фармкомпания), отечественные или международные CRO и медучреждения, где проводят КИ. Соблюдение стандартов GCP и одобрение проведения КИ контролирует Министерство здравоохранения, а фармаконадзор — Росздравнадзор. Чтобы лучше разобраться в статистике и анализе российского рынка КИ, можно обратиться к бюллетеням, которые ежегодно публикует Ассоциация организаций по клиническим исследованиям (АОКИ).
Протокол клинического исследования Тенексиа® стал «золотым стандартом» в BIOCAD благодаря адаптивным элементам, которые продолжают внедряться в другие наши протоколы. При разработке новых проектов мы часто обращаемся к этому исследованию, чтобы изучить использованные подходы.
Вызовы и сложности: проверяем и выверяем дизайн исследования
Перед запуском клинического исследования BIOCAD собрал экспертов и врачей, чтобы подробно рассказать им о проекте. В течение двух дней участники обсуждали дизайн исследования, его особенности и практические моменты. Например, в рамках этого обсуждения прошел большой семинар, где сотрудники BIOCAD активно общались с медицинскими специалистами, помогая им лучше понять международные стандарты для двойных слепых исследований.
Препарат Тенексиа® стал моим первым проектом в BIOCAD, где я была куратором проекта. На тот момент я была медицинским экспертом и работала в компании всего полтора года, поэтому было тяжело — хотя бы потому, что было трудно вот так сразу взяться за протокол с таким сложным адаптивным дизайном. Мне предстояло найти и изучить огромное количество руководств, статей, научной литературы. Помогал нетворкинг.
Человеческий фактор: зачем нужен двойной слепой метод
При разработке дизайна клинического исследования важно продумать каждую деталь, в том числе выяснить, с чем связан положительный эффект лекарства — с реальной силой действия или с эффектом самовнушения («эффектом плацебо»). Для этого пациентов делят на две группы: одним дают новое лекарство, а другим — «пустышку». При этом распределение пациентов на группы происходит не по какому-то принципу, а случайно, рандомизированно.
Однако здесь есть другой риск: если пациент заранее будет знать, что он получает (или не получает) настоящее лекарство, эффект плацебо может сработать в обратном направлении. Более того, врач тоже не должен знать, в какую группу попали его пациенты, иначе он будет ожидать (или не ожидать) признаков выздоровления. Поэтому в ходе клинических исследований применяется двойной слепой метод: ни врачи, ни пациенты, ни команда компании-разработчика не знают, получают ли пациенты реальный препарат или плацебо.
Сложностью проведения клинического исследования Тенексиа® стала минимизация рисков «разослепления», чтобы ни врачи, ни участники заранее не узнали, с чем они работали. Особенностью проекта была разная частота применения контрольного и сравниваемого препаратов, что потребовало разработки различных методов для обеспечения «слепоты». Важным аспектом также стало решение вопросов маркировки, чтобы минимизировать вероятность различий в идентификации препаратов. Для этого в BIOCAD создали унифицированную систему упаковки и нумерации, что позволило обеспечить последовательность и корректность введения.
Есть еще одна интересная деталь, связанная с этим клиническим исследованием. При рассеянном склерозе у пациентов ухудшаются функции верхних конечностей: нарушается чувствительность, возникает чувство онемения или мурашек. Чтобы оценить выраженность этих симптомов, применяют тест «9 колышков»: человеку предлагают вставить колышки в специальные отверстия, а затем вынуть их по одному той же самой рукой. Для того чтобы глубже погрузиться в детали клинического исследования, сотрудники BIOCAD проходили этот тест на себе, оценивая, сколько времени это у них займет. Впоследствии это помогло лучше интерпретировать результаты пациентов, которые также проходили данный тест.
Подводя итоги, хочется отметить: несмотря на все сложности, с которыми пришлось столкнуться, этот проект еще раз доказал способность нашей компании разрабатывать свои собственные оригинальные препараты и проводить клинические исследования в соответствии с принятыми международными стандартами.
