Генная терапия: как наука меняет наши гены и лечит то, что казалось неизлечимым
В 1990 году четырехлетняя Ашанти-Де Сильва стала первым человеком, получившим генотерапевтическое лечение — единственный шанс победить смертельно опасный иммунодефицит. Болезнь, вызванная генетическим дефектом, разрушала ее иммунную систему. Врачи решились на эксперимент, который дал удивительный результат: вместо жизни в стерильном пузыре девочка постепенно выздоровела. Эта история положила начало эпохе генной терапии1.
Что такое генная терапия?
Генетические заболевания возникают из-за нарушений в ДНК человека. Эти нарушения могут быть вызваны изменениями в генах или хромосомах, передаваться по наследству от родителей к детям или возникать спонтанно. Наследственные генетические заболевания в зависимости от механизма наследования подразделяются на несколько типов, основными из которых являются аутосомно-доминантный, аутосомно-рецессивный и сцепленный с полом (Х-сцепленный и Y-сцепленный). Спонтанные генетические нарушения возникают в результате мутаций, которые происходят случайным образом, в процессе репликации ДНК или под воздействием факторов окружающей среды и не передаются по наследству от родителей. Эти мутации могут возникать как в отдельных генах, так и во множестве генов или целых хромосомах, приводя к широкому спектру нарушений.
Если в организме человека присутствуют такие изменения, это может привести к нарушениям в регуляции экспрессии различных генов, а также к изменению структуры и функций жизненно важных белков, что вызывает тяжелые заболевания, например муковисцидоз, иммунодефициты или мышечную атрофию. Раньше эти диагнозы были приговором, но наука научилась «чинить» сломанные гены. Такое лечение называется генной терапией.
Генная терапия не затрагивает все клетки организма — изменения происходят только в определенных клетках-мишенях внутри организма пациента или вне его тела.
Стратегии генной терапии
По методу доставки генетического материала в организм пациента существует два подхода. Генная терапия in vivo подразумевает введение генетического материала непосредственно в организм пациента. Проникая в клетки-мишени, препарат целенаправленно изменяет количество целевых белков. При ex vivo терапии у пациента берут клетки-мишени и в лаборатории проводят их генетическую модификацию, доставляя терапевтический ген. Часто это делается с помощью вирусных векторов. Далее модифицированные клетки культивируют до нужного количества и вводят обратно в организм пациента3.
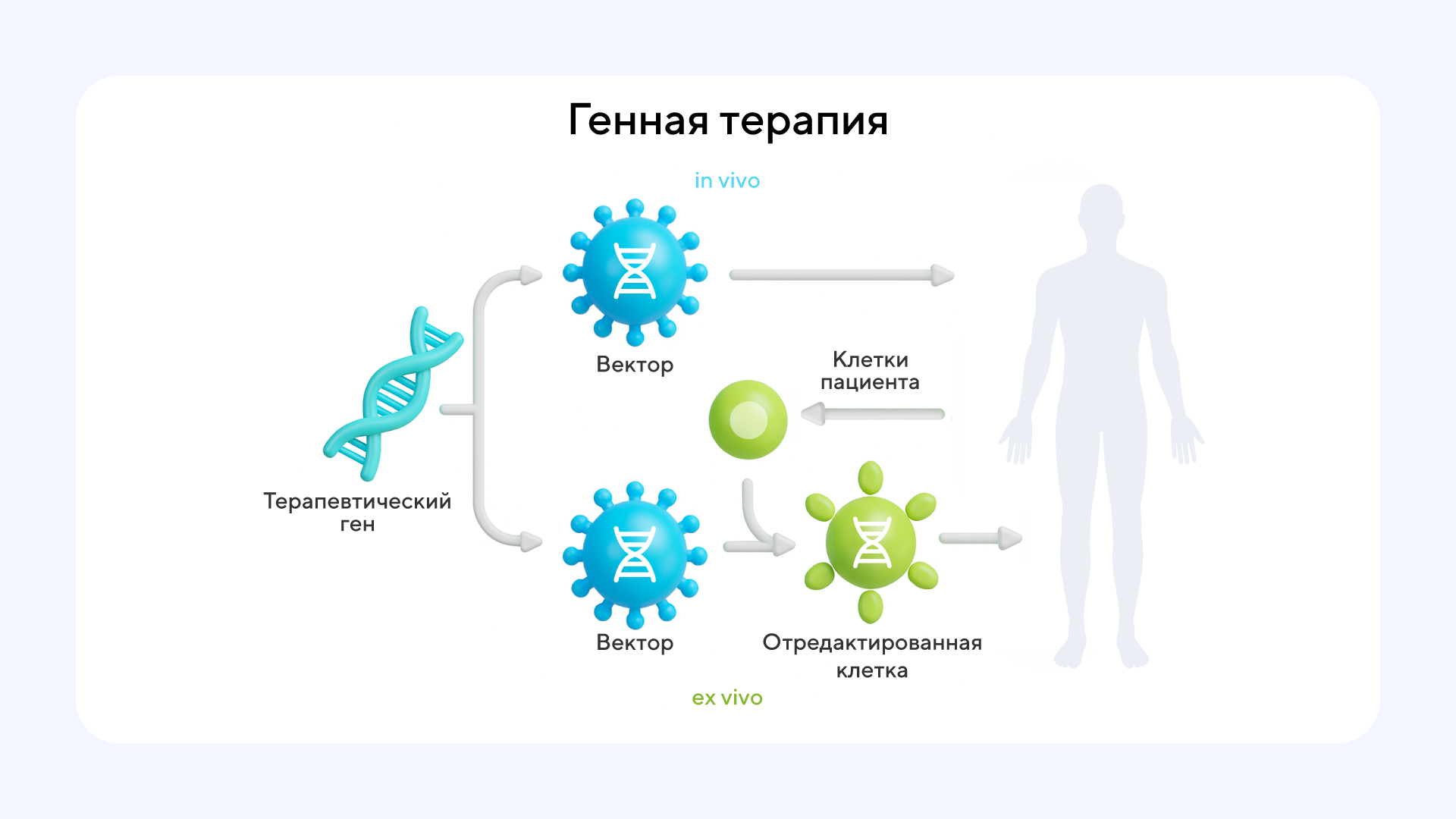
Генная терапия in vivo подразумевает инфузию раствора с определенным количеством терапевтического гена, как правило, заключенного в специальные носители (вирусная и невирусная система доставки), в организм человека. Так лечат гемофилию и спинальную мышечную атрофию (СМА). В терапии ex vivo определенные клетки, например стволовые клетки костного мозга или лимфоциты, берут у пациента, а затем они модифицируются вне организма посредством введения терапевтического генетического материала, после чего их культивируют и трансплантируют пациенту. Технологию используют для лечения некоторых типов рака и наследственных метаболических иммунодефицитов. Источник: Children’s Hospital of Philadelphia
В зависимости от того, какие изменения необходимо осуществить для достижения терапевтического эффекта, генная терапия может быть условно классифицирована по механизму действия4:
- Подавление гена
Этот подход используется для снижения экспрессии генов, которые вызывают патологические изменения, например для лечения наследственного транстиретинового амилоидоза — прогрессирующей невропатии, вызванной мутациями в гене транстиретина. Для этого применяют антисмысловые олигонуклеотиды (ASO) или молекулы, запускающие механизм РНК-интерференции (RNAi), которые связываются с мРНК и блокируют ее трансляцию или способствуют ее разрушению. - Редактирование гена
В этом случае используются инструменты для точечного исправления мутаций, такие как CRISPR/Cas9. Изменяя нуклеотидную последовательность небольшого сегмента направляющей РНК, CRISPR/Cas9 позволяет нацеливаться практически на любой желаемый геномный локус с целью исправления мутаций, вызывающих заболевания, или подавления генов, связанных с развитием заболевания. В 2023 году в Великобритании был одобрен единственный препарат на основе CRISPR/Cas9 — Casgevy® для лечения серповидноклеточной анемии. - Замещение гена
При этом подходе в клетки доставляют рабочие копии дефектных или утраченных генов, обеспечивая синтез нормальных белков. Для этого используют векторы, такие как аденоассоциированные вирусы (AAV), которые транспортируют генетический материал. Этот метод широко применяется при заболеваниях, вызванных потерей функции гена: например, при спинальной мышечной атрофии (СМА) в клетки пациента добавляют рабочий ген SMN1, не изменяя его дефектную копию.
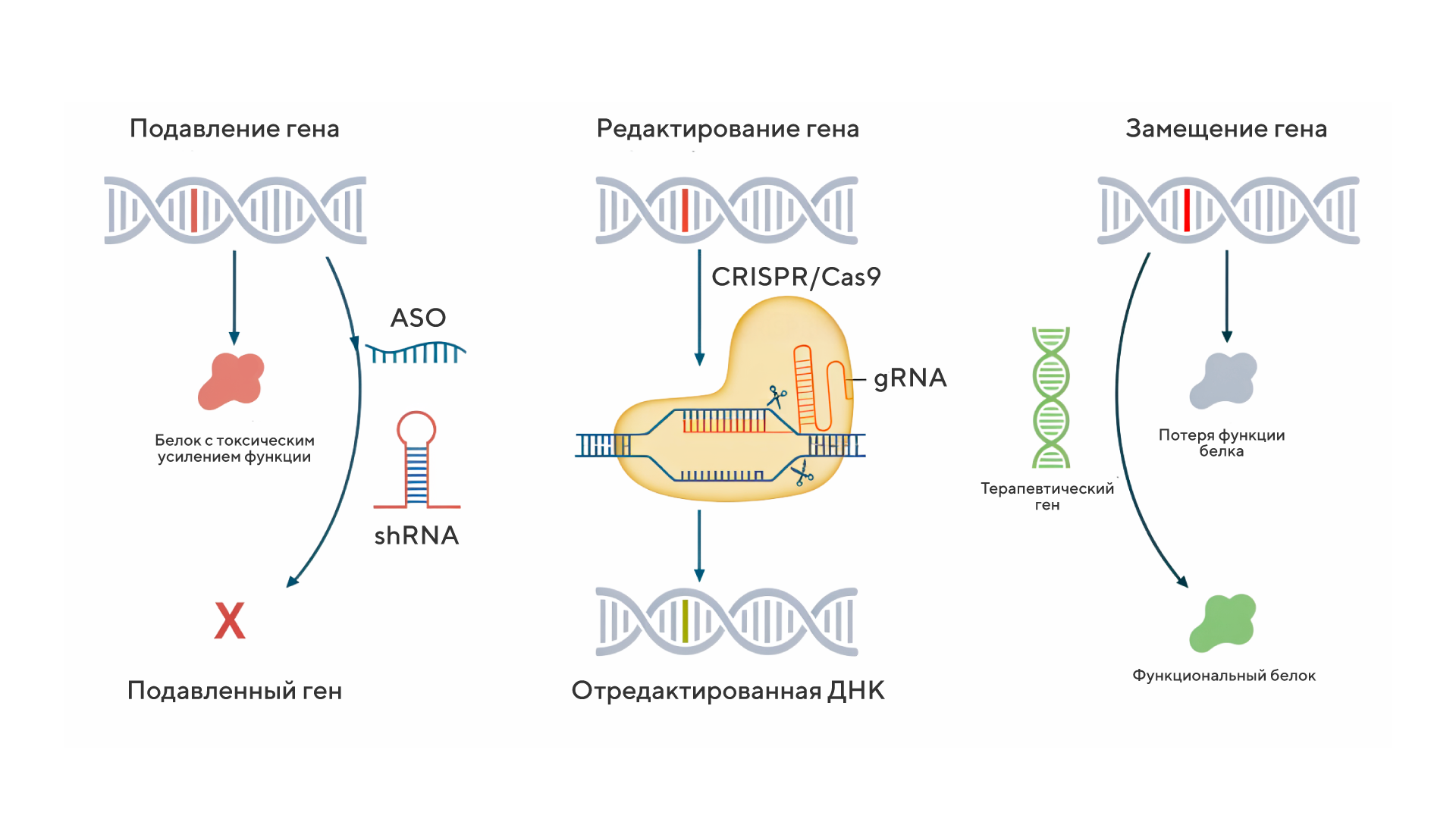
Подавление гена (слева) направлено на снижение экспрессии нежелательных генов, которые могут вызывать или усугублять заболевание, например, для реализации такого подхода могут быть использованы ASO или короткие шпилечные РНК (shRNA). Редактирование гена (среднее) включает в себя коррекцию с помощью модифицированных нуклеаз (CRISPR/Cas9). Направляющая РНК (gRNA), комплементарная определенной последовательности-мишени, которую необходимо модифицировать, объединяется с нуклеазой Cas9, создающей двухцепочечные разрывы ДНК, которые восстанавливаются с помощью механизмов репарации ДНК, а именно гомологично-направленной репарации (HDR) и негомологичного соединения концов (NHEJ). Замещение гена (справа) заключается в доставке генетического материала для замены дефектного гена и восстановления продукции нормального белка. Источник: Nat Rev Neurol
После выбора инструмента его нужно защитить от разрушения, доставить к целевым тканям и снизить риск побочных эффектов. Некоторые инструменты (например, ASO) не требуют дополнительной упаковки, а для переноса генов и систем редактирования могут быть использованы различные системы доставки:
Вирусные векторы — это вирусы, в которых удаляют гены, отвечающие за их патологические свойства (вирулентность), а также изменяют их структуру для снижения иммунного ответа организма5. При этом они сохраняют способность доставлять целевые гены в клетки организма: благодаря удалению «родных» генов, отвечающих за процессы деления и развитие болезней, появляется емкость для вставки целевого терапевтического гена, который нужно доставить в клетку.
По способности встраивать (интегрировать) ген в генетический аппарат клетки вирусные векторы можно разделить:
- На векторы, которые способны встраивать генетический материал в геном клетки-хозяина, обеспечивая длительную экспрессию целевого терапевтического гена, а также репликацию внедренного гена при делении клеток. К такому типу относятся ретровирусные векторы (RV), однако риском при их применении является онкогенез, возникающий за счет процесса, именуемого инсерционным мутагенезом. Ретровирусы γ-типа имеют тенденцию встраиваться в протоонкогены или рядом с ними, что представляет большую опасность. Поэтому в качестве векторов генной терапии, способных интегрировать генетический материал в геном клетки, наблюдается смещение в сторону использования лентивирусных векторов (LV), которые намного безопаснее, поскольку преимущественно интегрируются в интроны, избегая энхансеров и промоторов, что и снижает риск онкогенеза.
- Векторы, которые доставляют генетический материал в клетку, но не встраивают его в геном клетки. Их используют как для ex vivo, так и для in vivo терапии. К таким векторам относятся аденовирусы (AdV), которые способны переносить большие гены в разные ткани, но вызывают иммунный ответ. Наиболее популярны аденоассоциированные вирусы (AAV), которые доставляют терапевтический ген в целевую клетку и оставляют его в форме эписомальной ДНК. С помощью модификаций можно изменять избирательность (тропность) AAV к клеткам, а также модифицировать вирусный геном для увеличения емкости вектора (емкость вектора характеризуется длиной ДНК целевого гена, который может быть помещен в вектор). К этой группе векторов относятся также поксвирусы и вирус простого герпеса, но их применение ограничено из-за особых свойств.
Невирусные системы доставки — полимеры, липиды, пептиды и неорганические частицы6. Многие из них вызывают низкий иммунный ответ и имеют возможность масштабирования, однако их эффективность и долговременность в терапии пока уступают вирусным системам, но в будущем могут стать их альтернативой.
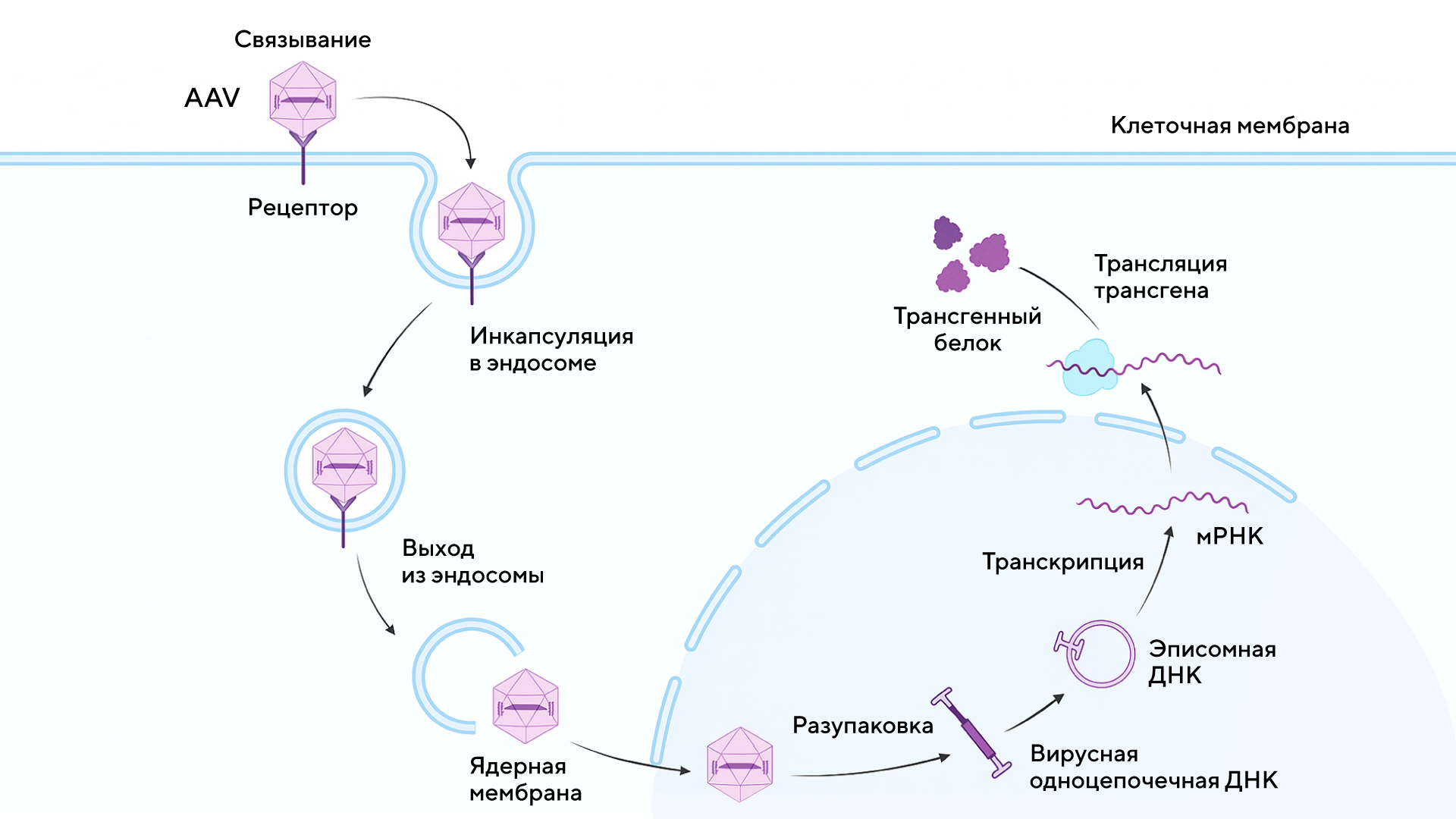
Схема доставки гена аденоассоциированным вектором. Источник: Immunol Rev
Среди вирусных систем доставки для in vivo генной терапии в настоящее время преимущественно применяют векторы на основе AAV и AdV, а для ex vivo терапии наиболее часто применяют LV, реже — RV. Сегодня ex vivo подход успешно применяется для CAR-T и TCR-T терапии.
CAR-T (Chimeric Antigen Receptor T-cell therapy) — способ лечения, при котором в Т-лимфоциты пациента встраивают ген, кодирующий химерный антигенный рецептор (CAR), — искусственную молекулу, которая позволяет клеткам распознавать специфические маркеры на поверхности опухоли и уничтожать ее.
При TCR-T (T-cell receptor therapy) распознаются внутриклеточные антигены, в отличие от CAR-T, нацеленной на поверхностные антигены. Это расширяет возможности лечения, позволяя бороться с более широким диапазоном опухолей, включая те, где трудно найти подходящие мишени. Благодаря этому TCR-T является перспективным направлением в иммунотерапии рака.
Что лечит генная терапия?
Генотерапевтические препараты могут стать спасением не только от редких наследственных заболеваний, но и помочь в борьбе с онкологией и нейродегенеративными расстройствами. Диагнозы, раньше звучавшие как приговор, теперь воспринимаются как вызов. Какие болезни перестали считаться неизлечимыми?
- Тяжелый комбинированный иммунодефицит (SCID) — группа редких наследственных заболеваний, при которых иммунная система практически отсутствует. С лекарства от ADA-SCID началась история генной терапии. Сейчас в случаях, когда невозможно найти подходящего донора костного мозга, в Европе применяют Strimvelis® — препарат, доставляющий ген фермента ADA с помощью ретровирусного вектора в стволовые клетки, которые после переноса пациенту восстанавливают функции иммунной системы7.
- Спинальная мышечная атрофия (СМА) — наследственное заболевание, при котором дети теряют способность двигаться и дышать. Раньше дети со СМА редко доживали до двух лет, но все изменила Золгенсма® — препарат генной терапии однократного применения, доставляющий в клетки здоровую копию гена SMN1, упакованную в аденоассоциированный вирусный вектор (AAV9). Препарат стал прорывом: у детей, прошедших лечение, улучшилась моторика и дыхательная функция.
- Наследственная слепота — ретинальная дистрофия, при которой человек с детства теряет зрение. Препарат Лукстурна®, одобренный FDA в 2017 году, стал первым средством для ее терапии: он доставляет работающий ген RPE65 с помощью AAV2 прямо в клетки сетчатки. Лечение требует хирургического вмешательства, а эффект длится не менее пяти лет (по имеющимся на текущий момент данным), но это первый шаг к реальному восстановлению зрения8.
- Раковые заболевания крови — представляют собой группу злокачественных заболеваний кроветворной системы. Терапия с помощью CAR-T изменила подход к лечению рака крови. Когда все существующие методы оказывались бессильны, появились препараты Kymriah® и Yescarta® на основе модифицированных Т-клеток пациента9. Kymriah® применяется для терапии острого лимфобластного лейкоза (ОЛЛ), крупноклеточной В-клеточной лимфомы и фолликулярной лимфомы. Yescarta®, одобренный для применения в США и странах Евросоюза, предназначен для лечения пациентов с крупноклеточной В-клеточной лимфомой и фолликулярной лимфомой. У детей с острой лимфобластной лейкемией Kymriah® дал полную ремиссию в 86% случаев, а применение Yescarta® для лечения диффузной крупной B-клеточной лимфомы показало эффективность в 47% случаев по данным клинических испытаний.
Генная терапия становится частью клинической практики и открывает путь к выздоровлению пациентам с заболеваниями, ранее считавшимися неизлечимыми.
Риски и ограничения
Несмотря на успехи в лечении наследственных заболеваний, генная терапия остается сложной и неоднозначной. Главный вызов — долгосрочная безопасность: исследователи не знают, насколько длительным будет эффект от лечения и как вмешательство в гены отразится на пациентах спустя годы.
Организм тоже может препятствовать успеху терапии: вирусные векторы способны вызвать иммунный ответ, что снижает эффективность лечения и делает его опасным: в 1999 году от таких последствий умер 18-летний Джесси Гелсингер. Сейчас подобные случаи — редкость. При этом повторное введение таких препаратов представляет собой сложную задачу, главным образом из-за иммунного ответа на вектор и образования нейтрализующих антител. Это может значительно снизить эффективность последующих введений и вызвать нежелательные побочные эффекты. Однако исследователи ведут активную работу для преодоления этих ограничений. Тем не менее полностью исключить риски пока невозможно, а стоимость лечения остается высокой.
Миллионы за здоровье
Высокая стоимость генной терапии обусловлена сложностью технологии10. Препараты выпускаются в ограниченных количествах, требуют дорогого сырья и нередко — отдельных производственных линий. Разработка обходится в сотни миллионов долларов, значительная часть которых уходит на клинические испытания и соблюдение строгих регуляторных норм.
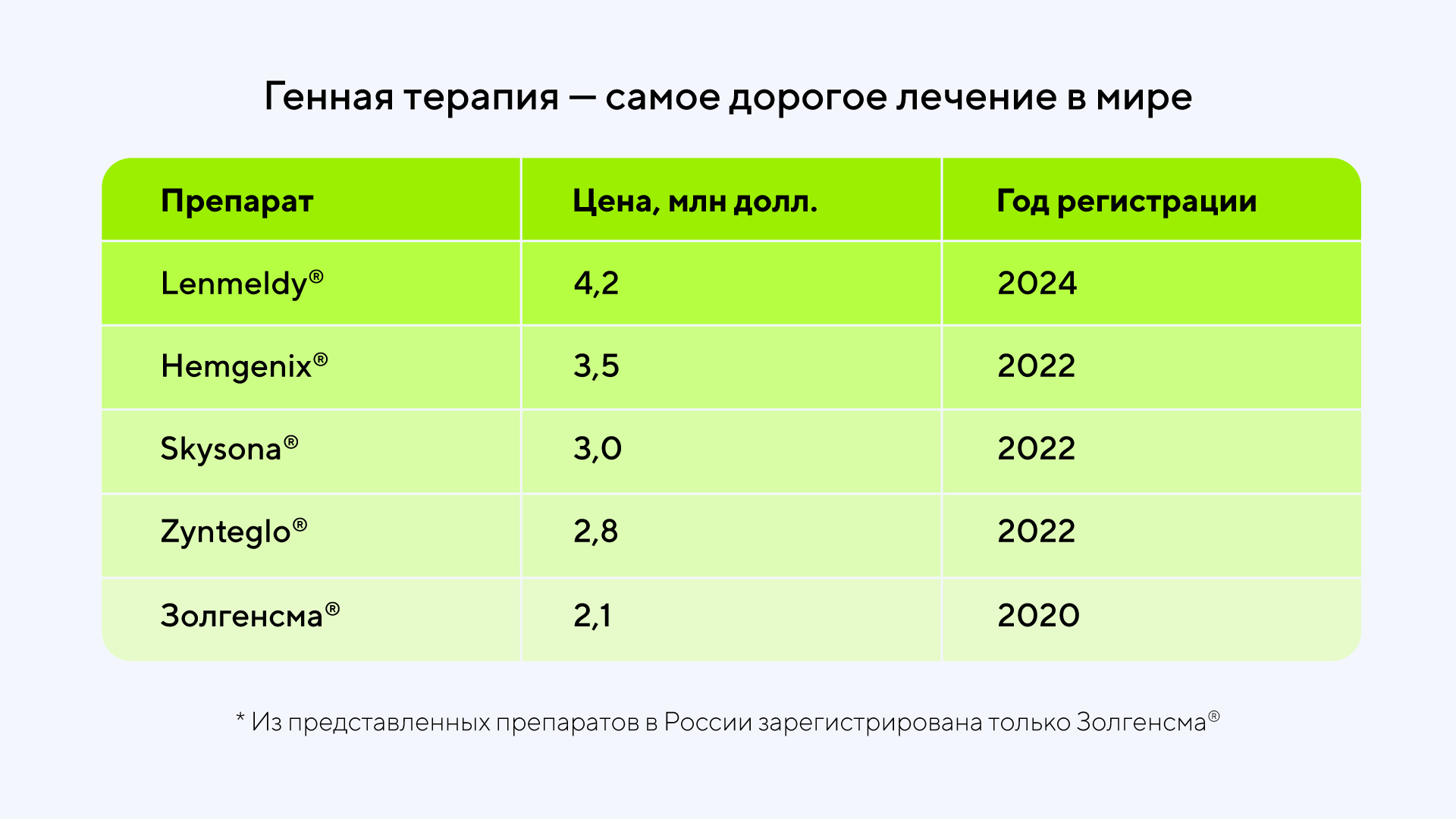
Генная терапия устраняет причину заболевания, поэтому цена формируется из потенциальной пользы: одна доза лекарства может заменить пожизненные процедуры. Однако для повышения доступности препаратов нужны новые подходы к разработке и производству.
Разработка продолжается
Сегодня список потенциальных болезней для лечения генной терапией растет: ученые разрабатывают лекарства от диабета, ВИЧ, наследственных иммунодефицитов, болезней крови и нейродегенеративных патологий.
Например, при диабете 1-го типа рассматривается возможность индукции производства инсулина не только β-клетками поджелудочной железы, но и другими клетками организма, при ВИЧ — удаление участков генома ВИЧ из ДНК инфицированных клеток при помощи системы CRISPR/Cas9, а к терапии СМА ищут новые эффективные подходы.
Терапия становится более персонализированной. CRISPR и другие инструменты редактирования позволяют точечно устранять мутации и подбирать особое лечение11. Идет работа над технологиями контролируемой экспрессии генов, важных для лечения онкологии и аутоиммунных заболеваний.
Цель развития генной терапии — точно устранять причины заболеваний, соблюдать этические ориентиры и обеспечивать долгосрочную безопасность.
Перспективы развития
Генная терапия постепенно выходит за пределы лечения редких заболеваний и нацеливается на массовые патологии. Особый интерес вызывают расстройства нервной системы, где главная задача — безопасно доставить лекарство к мозгу12. Российские ученые тоже разрабатывают генные лекарства: CAR-T для лечения рака и аутоиммунных заболеваний, новые подходы к регенеративной медицине и применяют терапию против хронической ишемии. Компания BIOCAD активно развивает направление генной терапии: первый в России препарат для лечения гемофилии B находится на этапе рассмотрения заявления на регистрацию, а препараты для лечения СМА и гемофилии А проходят клинические испытания. Главная задача исследователей — разработка точных технологий редактирования генов и создание безопасных векторов с целью сделать лечение безопасным и управляемым.
За сложными терминами стоят простые человеческие истории тех, кто пережил тяжелое лечение на пути к нормальной жизни. Генная терапия — это не магия, а долгая и сложная работа врачей и исследователей, которая никогда не останавливается.
Генная терапия от BIOCAD: шаг к свободе от гемофилии B
BIOCAD подал заявление в Минздрав о регистрации первого в России оригинального препарата генной терапии гемофилии B — арвенакогена санпарвовека. Заявление будет рассматриваться по процедуре условной регистрации, предусмотренной правилами ЕАЭС. Это значит, что при соблюдении определенных условий, указанных в нормативных актах ЕАЭС, препарат может быть зарегистрирован быстрее — особенно если речь идет о редких и тяжелых заболеваниях.
Основа заявления — результаты совмещенной I–II фазы клинического исследования SAFRAN, и они уже сейчас внушают оптимизм.
Результаты, которые мы видим, впечатляют. В случае регистрации препарат может дать пациентам принципиально новый способ справляться с болезнью. Но важно помнить: даже после получения регистрационного удостоверения нас ждут дополнительные этапы — контроль серий, включение в программы возмещения. Это занимает от года до трех.
Препарат представляет собой одноразовую инъекцию рекомбинантного вирусного вектора, который доставляет ген фактора IX — именно его не хватает пациентам с гемофилией B. После введения препарата организм пациента начинает вырабатывать недостающий фактор IX. Если все сработает так, как мы рассчитываем, это может на годы освободить человека от постоянных уколов.
Над этой разработкой мы работаем уже более 7 лет. Все началось в 2016 году с создания GeneNEXT — платформы BIOCAD для создания in vivo и ex vivo генной терапии. В 2018 мы начали разработку препарата для генной терапии гемофилии B, завершили стадию ранней разработки к 2021 году, а затем перешли к доклиническим и клиническим исследованиям.
Сегодня мы продолжаем наблюдение за участниками исследования еще минимум 5 лет, и параллельно идет набор пациентов на III фазу — исследование MAGNOLIA.
Это большой шаг не только для нас, но и для всей российской биотехнологии. Генная терапия — это уже не фантастика, а реальная возможность менять качество жизни. Мы верим, что это направление станет одной из точек роста и поможет нам быть первыми там, где это особенно важно.
