
Болезнь Девика и системная склеродермия: как работают препараты для лечения редких заболеваний
В конце февраля во всем мире отмечается День редких заболеваний. Это еще один повод задуматься о людях, которые столкнулись с тяжелыми и порой неизученными болезнями.
В этой статье расскажем, что это за заболевания и как работает инновационная терапия, разработанная учеными BIOCAD.
Иммунные клетки и система «свой-чужой»
В вагоне метро, среди гула и стука колес, раздался тихий чих. Незримое облако микрочастиц взметнулось в воздух, разнося по замкнутому пространству вирусы. И вот они уже вдыхаются пассажирами, оседают на слизистых оболочках носа и ротоглотки, проникают в клетки и берут их под свой контроль. Вирус взламывает программу клетки. Все, что она теперь должна делать, — помогать ему размножаться и распространяться. Если бы этот процесс шел бесконтрольно, вирус постепенно захватил бы все клетки организма и привел к его гибели. Но этого не происходит благодаря иммунной системе.
Пораженная вирусом клетка не только меняет свою функцию, но и внешне преобразуется. На ее поверхности появляются молекулы, сигнализирующие об инфекционном заражении. Лимфоциты — клетки иммунной системы — способны распознавать эти сигналы и уничтожать чужеродные агенты1.
Существует несколько групп лимфоцитов, которые обеспечивают развитие иммунного ответа1.
🔹 Т-клетки киллеры (CD8+)
Уничтожают клетки, пораженные вирусом, предотвращая дальнейшее распространение инфекции.
🔹 В-клетки
Вырабатывают антитела, которые связываются с вирусами и блокируют их способность проникать в новые клетки, а также способствуют уничтожению пораженных вирусом клеток.
🔹 Т-клетки хелперы (CD4+)
Регулируют иммунный ответ, координируя взаимодействие между различными иммунными клетками для обеспечения эффективной защиты организма.
Лимфоциты умеют отличать чужеродные частицы, клетки и микроорганизмы, при этом не атакуя собственные ткани. Это возможно благодаря строгой системе распознавания «свой-чужой», которая формируется в процессе развития иммунологической толерантности.
Молодые Т- и В-лимфоциты образуются в костном мозге, но до полного созревания не отправляются на миссию по защите организма. Они должны пройти этап тщательного отбора. Во время созревания клетки, которые способны реагировать на собственные ткани, отбраковываются и уничтожаются. В результате в кровоток поступают только зрелые и проверенные лимфоциты, обладающие точным механизмом распознавания «своих» и «чужих»2.
Восстание иммунитета
Нарушение формирования иммунологической толерантности приводит к появлению аутореактивных клеток, способных запускать иммунный ответ против собственных нормальных тканей. Это может привести к хроническому воспалению и необратимому повреждению жизненно важных органов.
К факторам риска, способствующим сбоям в работе иммунной системы, относят:
- генетическую предрасположенность — некоторые индивидуальные генетические варианты повышают риск аутоиммунных реакций;
- инфекционные заболевания — вирусы и бактерии могут провоцировать агрессию иммунной системы против собственных тканей;
- факторы окружающей среды — стресс, вредные химические вещества, ультрафиолетовое излучение, курение и алкоголь повышают риск появления аутореактивных клеток2.
При нарушении иммунологической толерантности В-клетки продуцируют антитела, которые повреждают здоровые клетки, а также активируют Т-клетки, усиливая их атаку на собственные ткани2.
Редкие аутоиммунные заболевания
Заболевания, которые развиваются вследствие нарушения работы иммунной системы и развития иммунного ответа против собственных клеток, называются аутоиммунными. Врачи насчитывают порядка 150 заболеваний, которые могут встречаться у человека. Самые частые из них, такие как ревматоидный артрит, целиакия, псориаз, диагностируются примерно у 1% населения, что эквивалентно 1 000 случаев на 100 000 человек. Все они значительно ухудшают качество жизни, повышают риск сопутствующих тяжелых заболеваний и со временем могут приводить к инвалидизации.
Однако наряду с этими распространенными заболеваниями существуют и редкие, которые встречаются у менее чем 10 человек на 100 000 населения, что в 100 раз реже, чем ревматоидный артрит3. Заболевания, которые возникают у менее 0,01% популяции, называются редкими, или орфанными. Они часто имеют неблагоприятное течение, приводят к тяжелым нарушениям здоровья и значительному снижению качества жизни пациентов. Из-за редкости и схожести с другими патологиями диагностика таких заболеваний представляет определенную сложность. Кроме того, ограниченное количество пациентов затрудняет изучение механизмов развития орфанных заболеваний и проведение клинических исследований для разработки новых лекарственных препаратов4.
К числу редких аутоиммунных заболеваний относятся, например, болезнь Девика (оптиконевромиелит) и системная склеродермия.
Болезнь Девика, или оптиконевромиелит
В 1894 году французский невролог Эжен Девик описал 16 пациентов, у которых из-за воспаления зрительного нерва (nervus opticus) развилась потеря зрения. Однако этим заболевание не ограничилось, и уже в течение нескольких недель у пациентов происходили нарушения подвижности и чувствительности ног и рук, что указывало на развитие поражения спинного мозга. Это состояние Девик назвал оптиконевромиелитом5.
Долгое время болезнь Девика рассматривалась как форма рассеянного склероза, однако в 2004 году у этих пациентов обнаружились специфические антитела к аквапорину-4 (AQP4)6. Это открытие позволило выделить оптиконевромиелит в отдельное заболевание. Сегодня выявление антител к AQP4 является важным диагностическим критерием для постановки диагноза.
Аквапорин-4 (AQP4) — это белок, отвечающий за транспорт воды в клетках головного и спинного мозга. При болезни Девика В-клетки по неизвестной причине начинают вырабатывать антитела против AQP4. В результате развития каскада иммунопатологических реакций происходит повреждение нервных клеток и нарушение их функционирования. Клетки, содержащие AQP4, распределены в нервной системе неравномерно. Их наибольшее количество находится в зрительном нерве, стволе мозга и спинном мозге, которые из-за этого наиболее подвержены аутоиммунному поражению6.
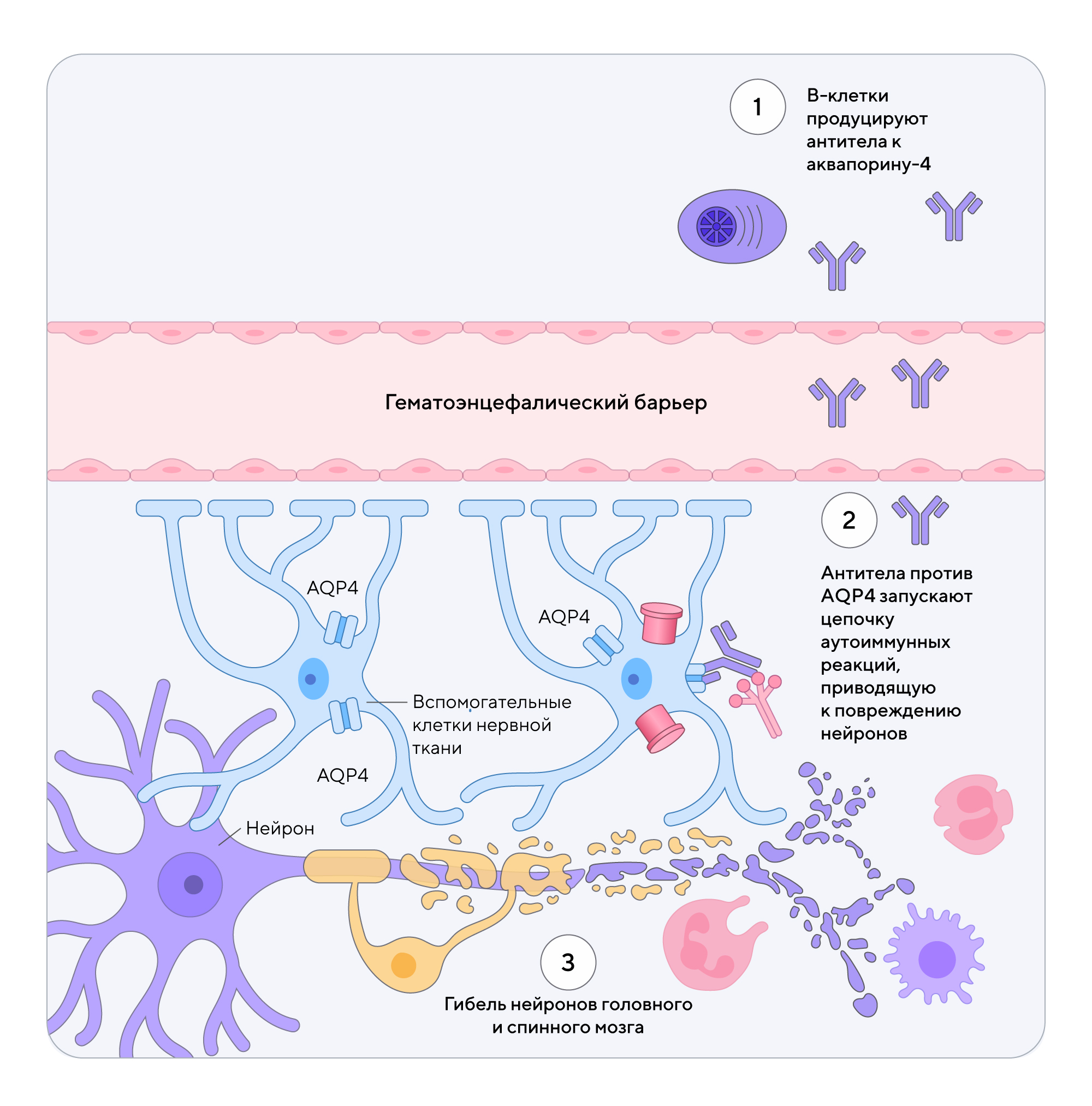
Механизм развития аутоиммунного поражения при оптиконевромиелите7
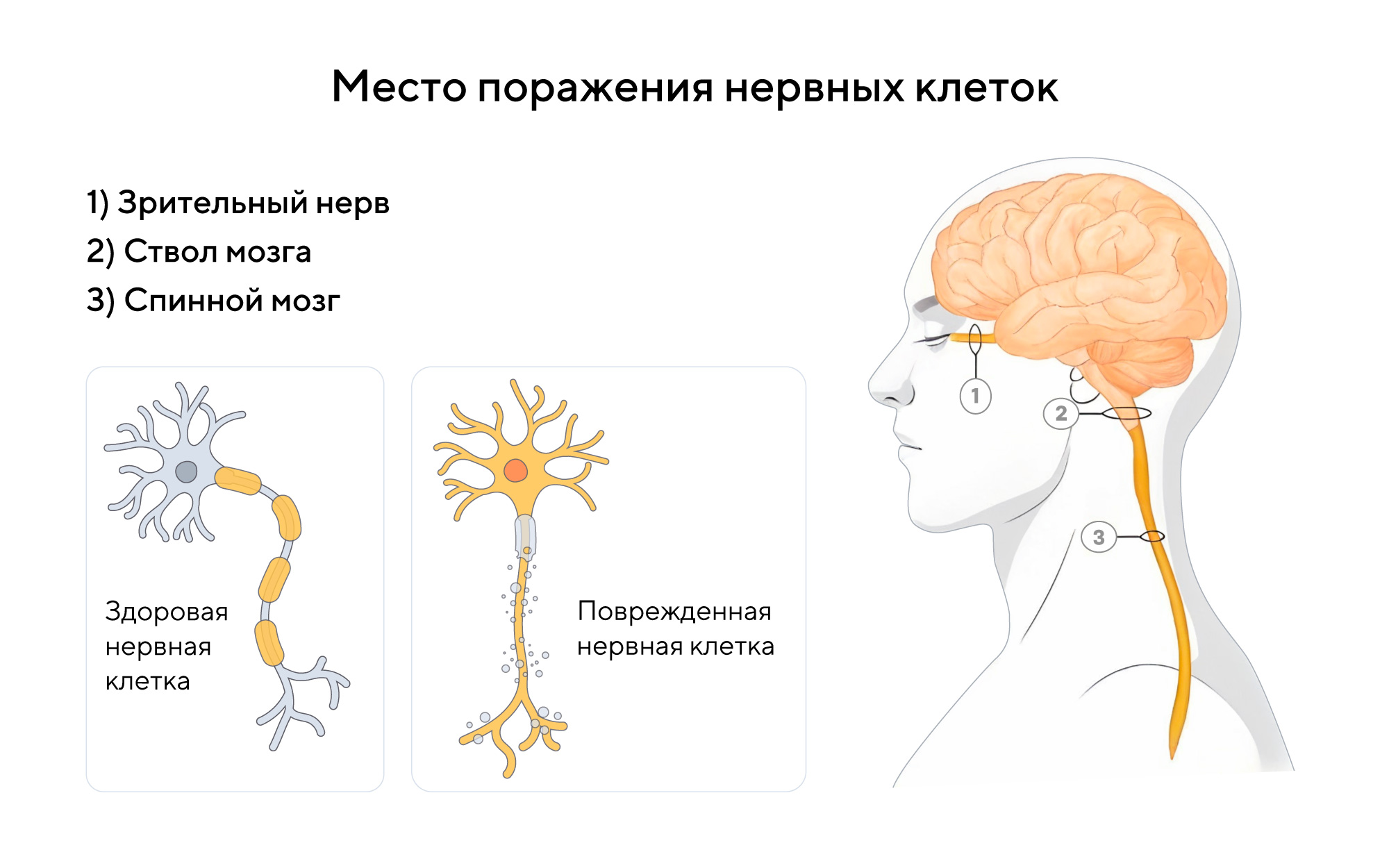
Оптиконевромиелит отличается от других заболеваний сочетанием признаков поражения зрительного нерва, ствола мозга и спинного мозга
🔹 Поражение зрительного нерва
Воспаление зрительного нерва (неврит) проявляется снижением остроты зрения, болью в глазах, а в тяжелых случаях приводит к слепоте8.
🔹 Поражение спинного мозга
В спинном мозге расположены нервные клетки и проводящие пути, отвечающие за сбор чувствительной информации от тела и передачу сигналов к мышцам для обеспечения движения. Поэтому воспаление и повреждение спинного мозга может привести к снижению силы или полной потере двигательной функции в ногах, а в тяжелых случаях и в руках. Кроме того, могут возникнуть нарушения чувствительности или аномальная чувствительность, проявляющаяся жжением, зудом или онемением8.
🔹 Поражение ствола мозга
Ствол содержит центры, контролирующие жизненно-важные функции организма, ядра черепных нервов, а также проводящие пути, соединяющие кору головного мозга со спинным мозгом. Его поражение может вызывать нарушение жевания, патологические движения глаз, расстройства координации и походки, устойчивую тошноту, рвоту и икоту8.
Распространенность оптиконевромиелита в мире составляет от 0,3 до 4,4 случаев на 100 000 человек. В 80% случаев им заболевают женщины. Заболевание чаще всего развивается в возрасте от 30 до 40 лет9. По оценкам врачей, в России может быть от 600 до 6 139 пациентов, страдающих оптиконевромиелитом10.
Системная склеродермия
Системная склеродермия — это аутоиммунное заболевание, поражающее соединительную ткань11. Соединительная ткань присутствует практически во всех частях тела, она формирует каркас внутренних органов, участвует в питании клеток, составляет основу кожи, костей, связок и суставов12. Заболевание приводит к нарушению структуры соединительной ткани, развитию фиброза и нарушению функции органов, которые она образует.
В нашем организме постоянно работают антигенпрезентирующие клетки, например макрофаги, которые поглощают и «переваривают» старые, «ненужные» и подозрительные клетки. После «уборки» они представляют фрагменты (антигены) «переваренных» клеток Т-лимфоцитам. В норме существуют механизмы, препятствующие активации Т-лимфоцитов и дальнейшему развитию иммунного ответа на собственные ткани. У пациентов с системной склеродермией этот процесс нарушен, вследствие чего происходит активация иммунной системы.
В ответ на сигнал от антигенпрезентирующих клеток Т-лимфоциты секретируют цитокины, вызывающие продукцию B-лимфоцитами специфических аутоантител. Вырабатываемые антитела направлены против эндотелиальных клеток, выстилающих внутреннюю поверхность кровеносных сосудов. В результате этого процесса нарушается функционирование мелких сосудов, что приводит к ухудшению кровоснабжения тканей13.
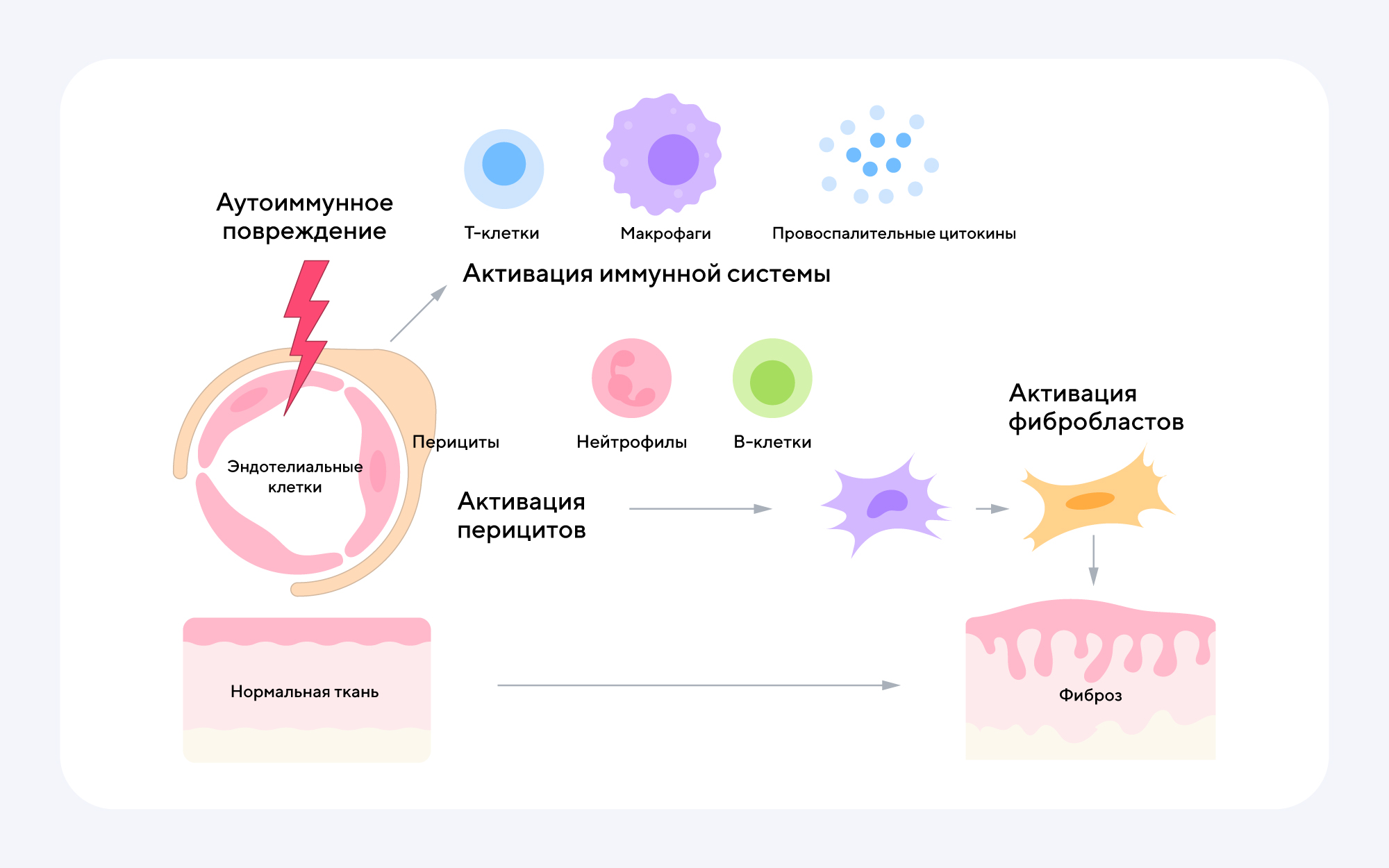
Патогенез развития системной склеродермии13
Одним из характерных ранних признаков заболевания является синдром Рейно — патологическое сужение сосудов, проявляющееся побледнением, потерей чувствительности и ощущением холода в кончиках пальцев или носа при воздействии низких температур. По мере прогрессирования заболевания сосудистые нарушения усугубляются, ткани начинают испытывать недостаток кислорода и питательных веществ, что приводит к образованию трофических язв на пальцах. В тяжелых случаях развивается некроз тканей, значительно возрастает риск присоединения инфекции. При глубоком поражении сосудов и стойком нарушении кровообращения возможен некроз концевых фаланг пальцев, что приводит к ампутации14.
Иммунная реакция против клеток сосудов сопровождается также повышенным образованием провоспалительных и профибротических цитокинов, которые активируют фибробласты и тем самым запускают фиброз13. В норме фибробласты играют важную роль в поддержании структуры тканей. Они же восстанавливают ткани в случае их повреждения. Например, после глубокого пореза кожи именно фибробласты помогают стягивать рану и формируют рубец. Однако при длительном воспалении их активность становится избыточной. Они начинают изменять межклеточное пространство, увеличивая в нем количество волокон, что приводит к развитию рубцевания и фиброза в здоровых, неповрежденных участках тела15. Из-за этого кожа становится грубой, утолщается, что ограничивает подвижность суставов и снижает качество жизни пациента. Если фиброз развивается в области рта, происходит уменьшение его размера, что затрудняет прием пищи и может привести к нарушению питания. Наиболее опасны фиброзные изменения внутренних органов. Приблизительно у 40% пациентов с системной склеродермией происходит интерстициальный фиброз легких, когда дыхательные альвеолы, обеспечивающие газообмен, заменяются на соединительную ткань. Это ухудшает дыхательную функцию и нарушает кровообращение. Легочный фиброз и сопутствующие сердечно-сосудистые нарушения часто становятся причиной летального исхода у пациентов с системной склеродермией14. Кроме того, заболевание часто поражает органы ЖКТ, почки и является одной из причин развития сердечно-сосудистых заболеваний.
Таким образом, повышенная активность В-лимфоцитов и выработка ими антител к собственным клеткам является одним из основных механизмов развития системной склеродермии. Их подавление может прервать развитие патологической реакции и уменьшить проявления заболевания.
Распространенность системной склеродермии в мире составляет 10 случаев на 100 000 человек. При этом женщины болеют почти в четыре раза чаще, чем мужчины. Чаще всего заболевание развивается в возрасте от 30 до 50 лет. Системная склеродермия по частоте занимает промежуточное положение между орфанными и распространенными заболеваниями, однако отличается самой высокой смертностью среди аутоиммунных ревматических заболеваний16.
Общее в непохожем
Системная склеродермия и болезнь Девика развиваются в результате глобального сбоя иммунной системы, при котором нарушается толерантность к собственным клеткам организма. Несмотря на различия в клинических проявлениях, обе болезни имеют схожие механизмы развития.
Исследования показали, что В-клетки играют ключевую роль в патогенезе системной склеродермии. Они не только продуцируют аутоантитела, направленные против клеток кровеносных сосудов и фибробластов, но также выделяют воспалительные цитокины, которые стимулируют активность Т-клеток и усиливают воспалительный процесс17.
При оптиконевромиелите В-клетки также занимают центральное место в механизме развития заболевания. Они вырабатывают аутоантитела против аквапорина-4, повреждающие нервные клетки головного и спинного мозга6.
Таким образом, оба заболевания связаны с нарушением работы В-клеток. Поэтому разрабатывается терапия, направленная на подавление их активности.
Терапия на основе моноклональных антител
В 1986 году был разработан первый препарат на основе моноклональных антител, который связывался с рецепторами на поверхности иммунных клеток и подавлял их активность. Это помогало пациентам после трансплантации почек сохранить пересаженный орган, предотвращая его отторжение. С тех пор моноклональные антитела стали одной из самых быстроразвивающихся технологий в производстве лекарственных препаратов18.
Моноклональные антитела получают в лабораторных условиях, но они работают так же, как и естественные антитела в организме. Связываясь с рецепторами на поверхности клеток, они могут:
- блокировать их, мешая клетке получать сигналы, запускающие патологические процессы;
- вызывать гибель клеток, участвующих в развитии заболевания;
- связывать и дезактивировать молекулы, вызывающие воспаление.
Технология разработки моноклональных антител позволяет создать препарат, нацеленный практически на любую молекулу, играющую роль в патогенезе заболевания. Это дает возможность точечно вмешиваться в патологический процесс, прерывая его на различных этапах19.
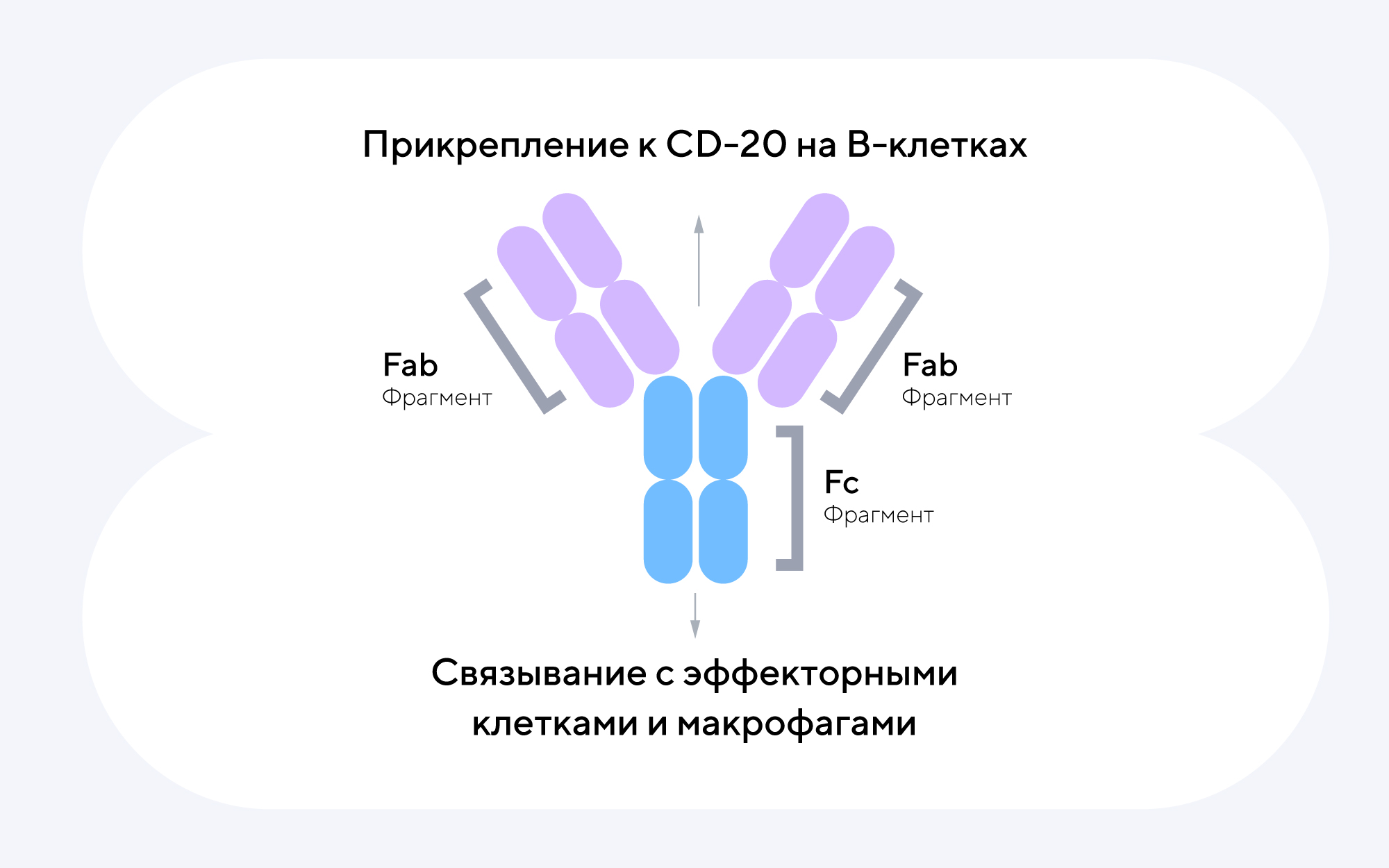
На поверхности В-клеток находится большое количество рецепторов, с помощью которых они взаимодействуют с другими клетками иммунной системы. Ученые обратили внимание на CD20 — мембранный белок, пронизывающий клеточную мембрану В-клеток и участвующий в транспорте ионов хлора. Хотя его точная функция до конца не изучена, важной особенностью CD20 является то, что он присутствует на зрелых В-клетках, но отсутствует на их предшественниках.
Этот факт сделал CD20 ключевой мишенью для моноклональных антител, поскольку их связывание с этим белком вызывает избирательное разрушение зрелых В-клеток, активно участвующих в аутоиммунных процессах. При этом предшественники В-клеток не повреждаются, что позволяет сохранить популяцию здоровых иммунных клеток, необходимых для защиты организма от инфекций20.
Анти-СD20 терапия
Существует несколько препаратов на основе моноклональных антител против CD20, которые применяются для лечения аутоиммунных заболеваний21.
Компания BIOCAD разработала дивозилимаб — моноклональное антитело, нацеленное на CD20. Этот препарат уже используется в терапии рассеянного склероза — аутоиммунного заболевания, поражающего клетки головного и спинного мозга. В настоящее время проводятся клинические исследования, изучающие эффективность дивозилимаба при системной склеродермии и болезни Девика.
Связываясь с CD20 на поверхности зрелых В-клеток, дивозилимаб способен вызывать их гибель с помощью трех различных механизмов:
- Активации эффекторных иммунных клеток, которые разрушают мембрану В-клеток, вызывая их гибель.
- Запуска системы комплемента — циркулирующих в крови белков, которые при активации образуют мембраноатакующий комплекс и повреждают мембрану В-клеток.
- Активации фагоцитов — иммунных клеток, способных поглощать и уничтожать В-клетки.
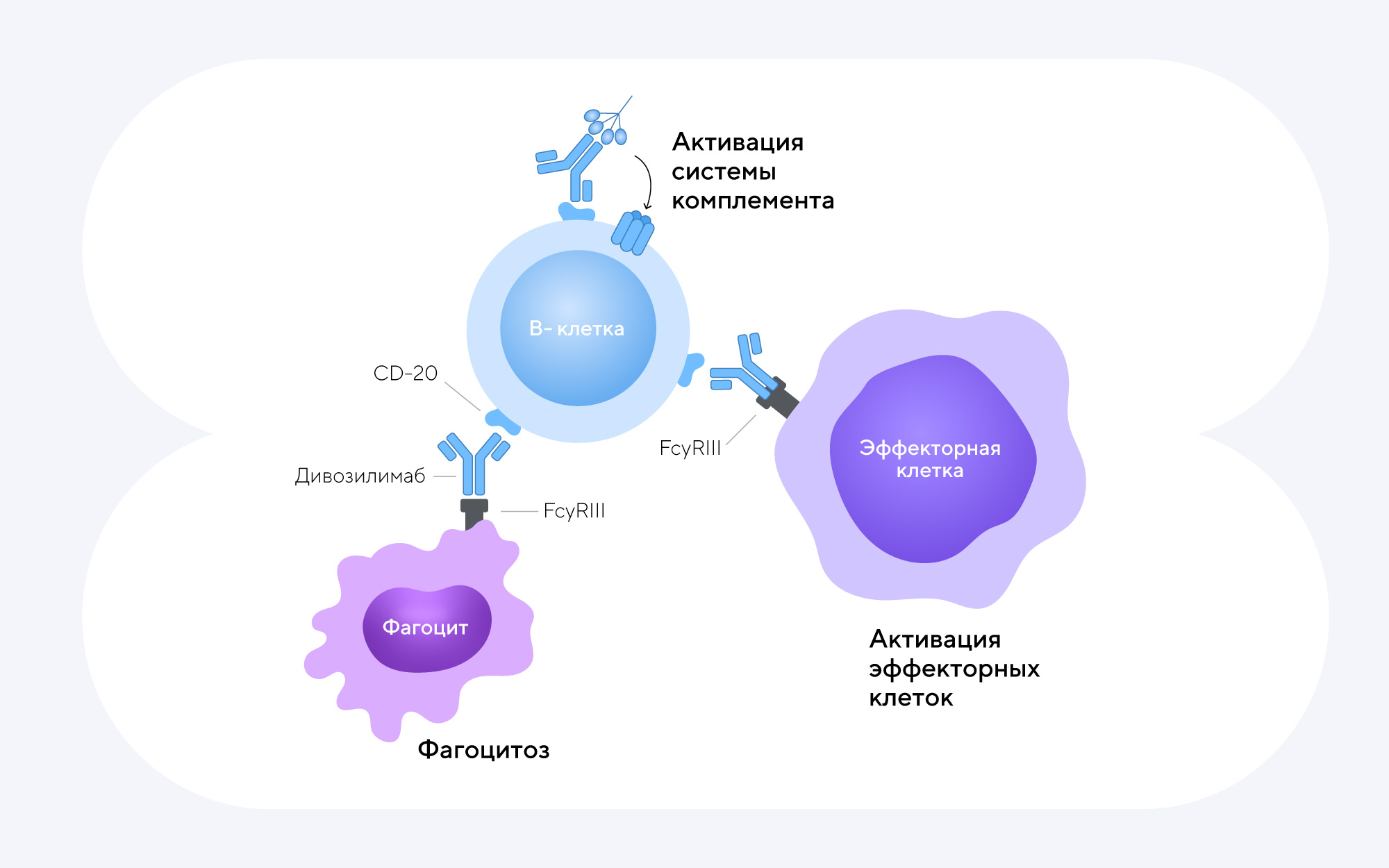
Механизм действия дивозилимаба
Дивозилимаб относится к самому последнему, третьему поколению анти-CD20 моноклональных антител. Чтобы повысить безопасность и эффективность лечения, ученые BIOCAD воплотили в лекарственной молекуле ряд решений:
- Антитело было гуманизировано. По своей структуре дивозилимаб максимально приближен к естественным антителам, циркулирующим в организме человека. Благодаря этому иммунная система распознает его как «своего», что снижает вероятность выработки нейтрализующих антител, которые могли бы уменьшить эффективность лечения. Это повышает стабильность и продолжительность действия препарата.
- Fc-фрагмент дивозилимаба не содержит углевода фукозы, что позволяет ему лучше связываться с эффекторными клетками иммунной системы и макрофагами. Это усиливает процесс уничтожения аутоиммунных В-клеток, повышая эффективность терапии.
Редкие лекарства
Большинство редких заболеваний по-прежнему не имеют одобренных вариантов лечения22. Разработка эффективной терапии остается сложной задачей по нескольким причинам:
- Причины и механизмы развития орфанных заболеваний сложно изучать. Из-за этого не всегда понятно, на какие мишени можно нацелить терапию.
- Количество людей с установленным диагнозом исчисляется сотнями или даже десятками. Из-за этого возникают сложности с проведением клинических исследований, без которых невозможно обеспечить пациентов препаратами с доказанной эффективностью. Затраты на поиск мишеней, разработку препарата и проведение клинических исследований могут быть огромными и потребовать привлечения большого количества высококвалифицированных специалистов.
Поэтому создание препарата для лечения редких заболеваний — это высший пилотаж, который может показать фармацевтическая компания. BIOCAD активно работает над тем, чтобы каждый пациент с системной склеродермией и оптиконевромиелитом имел возможность получить современное лечение, соответствующее высоким стандартам медицинской помощи.