
Симптом «неподвижного позвоночника»: как продвинулась наука в терапии болезни Бехтерева
Истории изучения Болезни Бехтерева уже больше ста лет, но добиться существенных прорывов в ее лечении удалось совсем недавно. В этом обзоре разберемся, кто стоит за историей изучения анкилозирующего спондилита, в чем заключалось его лечение на протяжении последних 50 лет и какие перспективы открывают лекарственные препараты с новыми механизмами действия.
Что такое болезнь Бехтерева
Болезнь Бехтерева (анкилозирующий спондилит, или рентгенологический аксиальный спондилоартрит) — это системное воспалительное заболевание, при котором собственный иммунитет разрушает скелет и суставы. В результате развиваются отеки, деформация и постепенное окостенение тканей суставов, что снижает подвижность пациентов.
Развитие заболевания связано с нарушениями в иммунной системе, когда иммунные клетки неправильно распознают собственные ткани и начинают их атаковать — этот процесс называется аутореактивностью. В результате развивается воспаление, возникающее прежде всего в позвоночнике (спондилит) и в крестцово-подвздошных суставах (сакроилеит). Между костными структурами формируются сращения, что ограничивает подвижность. Со временем это приводит к анкилозу — хроническому сращиванию суставов. В результате подвижность значительно ограничивается, появляется быстрая утомляемость и становится трудно держать спину ровно. В некоторых случаях у людей из-за спондилита воспаляются глаза и кровеносные сосуды, в частности аорта1, 2.
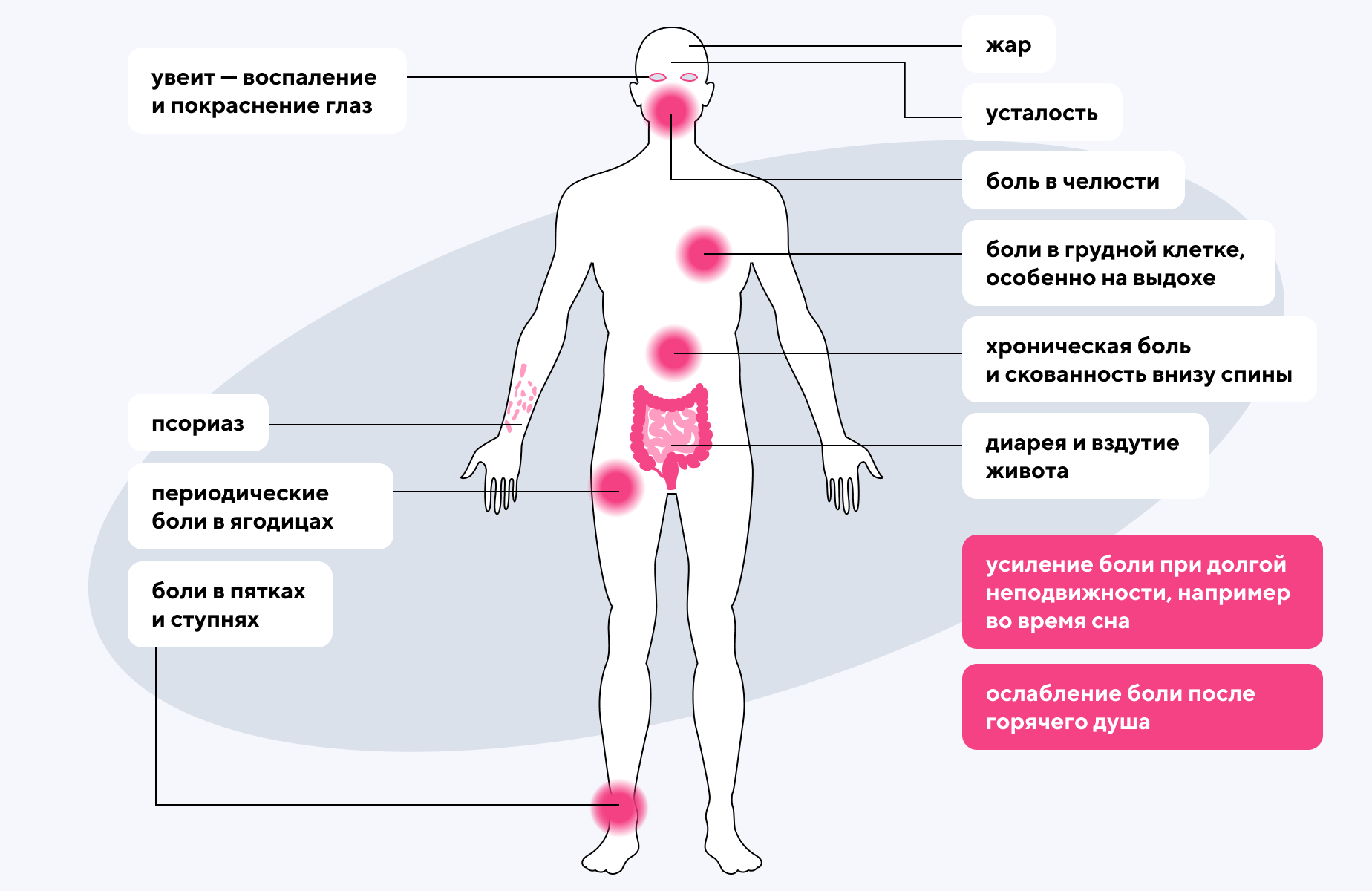
Описание возможных симптомов болезни Бехтерева
Как называют болезнь в разных странах
Болезнь, при которой происходит поражение позвоночника, в России традиционно связывают с именем русского невролога и психиатра В. М. Бехтерева. В своих работах он называл анкилозирующий спондилит «одеревенелостью позвоночника с искривлением», так же озаглавлена и одна из его статей. Чуть реже встречается другое название — «болезнь Штрюмпеля — Бехтерева — Мари», а в странах восточной Европы — просто «болезнь Мари — Штрюмпеля», в честь немецкого и французского неврологов, которые также занимались изучением поражений нервной системы.

Владимир Михайлович Бехтерев — ученый-энциклопедист: невропатолог, психиатр, морфолог, физиолог, психолог, основатель отечественной школы психоневрологов

Симптом «неподвижного позвоночника» и клинические описания болезни представлены в работах современников В. М. Бехтерева. В диссертации Р. Я. Голант (1913 г.) проявления анкилозирующего спондилита названы «формой Бехтерева», а также «формой Штрюмпеля — Мари»3
Однако в англоязычном медицинском сообществе название «болезнь Бехтерева» практически неизвестно. Описание «одеревенелости позвоночника» связывают совсем с другими именами и считают первопроходцами восемь английских врачей, которые изучали симптомы анкилозирующего спондилита еще в начале и середине 19-го века. Это B. Travers (1824), P. M. Lions (1831), B. Brodie (1850), J. Paget (1877), C. Fagge (1879), E. Bradford (1833), H. H. Glutton (1898) и N. Davis-Colley (1885). А самыми первыми задокументированными в литературе описаниями заболевания считается книга по анатомии Риальдо Коломбо (Realdo Colombo, 1559 г.) и работа Бернарда Коннора (Bernard Connor), который в 1695 году опубликовал статью о пациенте с «одеревеневшим» позвоночником. Впрочем, ни одно из этих имен на Западе не прижилось, поэтому публикации по теме на PubMed и в других источниках лучше искать по запросу ankylosing spondylitis.
По современной классификации заболевание носит название «аксиальный спондилоартрит», в котором выделяют две формы: рентгенологическую (или анкилозирующий спондилит, или болезнь Бехтерева) и нерентгенологическую (по мнению большинства специалистов, являющуюся ранней стадией аксиального спондилоартрита).
Способы диагностики: как это было
Если до начала 20-го века пациентов с анкилозирующим спондилитом выявляли по «неподвижному позвоночнику» при осмотре, то со временем инструменты диагностики расширялись.
В 1920-е годы в медицинскую практику входит рентгенография. Этот метод до сих пор широко применяют, чтобы посмотреть состояние скелета и обнаружить симптомы поражения позвоночника и суставов.
Следующей важной вехой в диагностике болезни стало открытие явления ядерного магнитного резонанса (ЯМР), которое сделали американские физики в 1946 году. Через 30 лет на основе этого метода ученые разработали метод магнитно-резонансной томографии (МРТ), благодаря которому мы видим изображения органов тела в трехмерных проекциях.
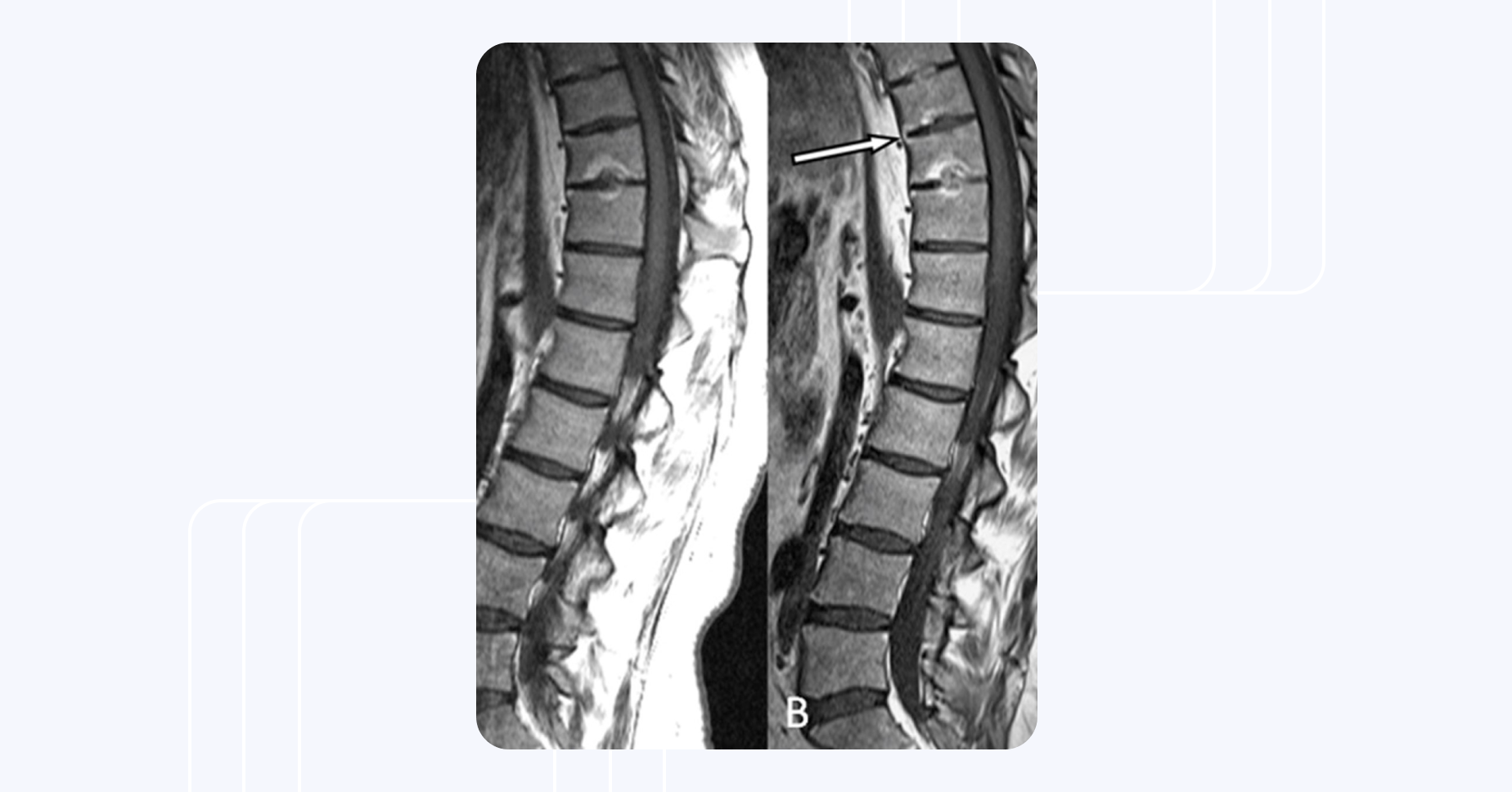
МРТ грудопоясничного отдела пациента с анкилозирующим спондилитом. На правом снимке, сделанном спустя три года после первого (слева), видно сращение позвонков (отмечено стрелкой) и прогрессирование структурного повреждения позвоночника4.
Кроме визуального анализа поражения опорно-двигательного аппарата, проводится лабораторная диагностика для оценки выраженности воспаления — например, повышение уровня С-реактивного белка и скорости оседания эритроцитов.
Известно, что у подавляющего большинства пациентов развитие анкилозирующего спондилита связано с генетическими особенностями, в частности носительством гена HLA-B275. Носителями HLA-B27 являются 5–8% населения планеты, что связано с высокой предрасположенностью к развитию анкилозирующего спондилита. Анализ крови на HLA-B27 стал доступным благодаря молекулярно-генетическим методам и в настоящее время используется для постановки диагноза аксиального спондилоартрита.
Лечение: от снятия симптомов к устранению первопричины
Грязелечение и массаж: на заре лечения
Долгое время главным в лечении болезни были не лекарства, а поддерживающая терапия, направленная на восстановление подвижности суставов. Для этого врачи назначали сеансы физиотерапии и лечебную физкультуру с упором на растяжку и поддержание осанки. В странах с грязевыми курортами, например в Чехии и Венгрии, пациентам рекомендовали грязелечение. Считалось, что грязь имеет противовоспалительные свойства. В более сложных ситуациях применяли и хирургическое вмешательство, например стабилизацию позвоночника с помощью штифтов. Эти методы продолжают применять и сейчас, чтобы предотвратить неправильное положение позвоночника и облегчить последствия болезни.
Золото и радиация: первые эксперименты
В начале 20-го века утвержденного протокола лечения ревматических заболеваний еще не существовало. Это было время экспериментов, когда только предпринимались первые попытки терапии. Одна из них — использование препаратов золота, которое уже продемонстрировало небольшой успех в лечении ревматоидного артрита. Однако в случае анкилозирующего спондилита эта ставка не сыграла — золото оказалось неэффективным. На замену золоту пришли инъекции радиоактивного тория Х или радона, который образуется в результате распада радия. Вся эта радиоактивная терапия активно использовалась во время Второй мировой войны для лечения туберкулеза и анкилозирующего спондилита. Пациенты, включая детей и подростков, получали гигантские дозы радиации (224Ra), что со временем приводило к существенному увеличению частоты онкологии. Несмотря на эти катастрофические последствия, лечение пациентов с анкилозирующим спондилитом с помощью пониженных доз радия продолжалось в западногерманских больницах вплоть до 1980–90-х годов.
Глюкокортикоиды и нестероидные противовоспалительные препараты (НПВП): стратегия облегчения симптомов
Во второй половине 20-го века, после Второй мировой войны, на фоне новых медицинских открытий произошел всплеск интереса к ревматологии. Примерно в это же время начинают применять лекарственные средства. Так, в 1949 году был открыт терапевтический эффект кортизона — синтетического глюкокортикоида, который эффективно снимает болевые ощущения и блокирует воспалительные процессы. Также в качестве первой линии терапии использовали нестероидные противовоспалительные препараты (НПВП), например фенилбутазон, ибупрофен и напроксен. Принцип их действия заключается в уменьшении воспаления и снижении боли за счет подавления циклооксигеназ — ферментов, которые способствуют выработке простагландинов. Причина возникновения боли при многих ревматических заболеваниях — это как раз простагландины, которые повышают чувствительность клеточных рецепторов к медиаторам боли.
Долгое время НПВП оставались единственным вариантом лечения, хотя более половины пациентов не получали должного клинического эффекта6. Несмотря на широкое применение, все эти методы лечения анкилозирующего спондилита оставались преимущественно симптоматическим: важно было хотя бы отчасти облегчить те хронические воспалительные симптомы, которые сильнее всего влияют на качество жизни пациентов. Но НПВП, к сожалению, не лишены побочных эффектов: на фоне их длительного приема может воспаляться слизистая желудка и кишечника, что потенциально приводит к гастриту, язвам и кровотечениям. Также имеется неблагоприятное влияние на почки. Учитывая, что НПВП при анкилозирующем спондилите нужно принимать очень долго, чуть ли не на протяжении всей жизни, их негативный эффект существенно снижает качество жизни пациентов6.
На уровне молекул: проблеск надежды
Вторая волна интереса к ревматологии пришлась на 1970-е годы, когда была обнаружена взаимосвязь между развитием болезни и фактором гистосовместимости HLA-B277. Выяснилось, что он присутствует у большинства пациентов (95%) с анкилозирующим спондилитом. Но это не означает, что у всех людей с геном, кодирующим HLA-B27, обязательно должна рано или поздно развиться болезнь «неподвижного позвоночника»8. В конечном счете аутоиммунные заболевания, включая болезнь Бехтерева, определяются случайными молекулярными перестройками и особенностью аутореактивных Т-лимфоцитов — об этом расскажем дальше. Но до открытия лечения, ассоциированного с HLA-B27 и репертуаром Т-клеточных рецепторов, оставалось еще много лет.
Биологические препараты: эффективность в действии
Со временем лечение совершенствовалось, и в конце 1990-х годов на смену классическим НПВП пришли противоревматические биологические препараты, которые модифицируют течение болезни, в частности приостанавливают воспаление и процесс новообразования костной ткани. Это становится возможным благодаря тому, что они блокируют ключевые элементы иммунного воспаления — цитокины9.
Первыми появились блокаторы фактора некроза опухоли альфа (ФНО-α); из них в России зарегистрированы пять препаратов: инфликсимаб, адалимумаб, голимумаб, цертолизумаба пэгол и этанерцепт. В дальнейшем появились другие антицитокиновые препараты — ингибиторы интерлейкина 17 (ИЛ-17) и янус-киназ10.
Молекулярный «виновник» болезни
Считается, что биологические препараты более эффективны. Они обладают селективностью и воздействуют строго на определенный цитокин, но иммунопатологический процесс при спондилоартрите многогранен и данные препараты могут не оказывать должного эффекта у некоторых пациентов11. Оптимальным вариантом было бы устранение самых начальных, первопричинных изменений в иммунной системе, запускающих череду патологических процессов. Для этого важно разобраться в молекулярных особенностях воспалительного процесса при аксиальном спондилоартрите и анкилозирующем спондилите в частности.
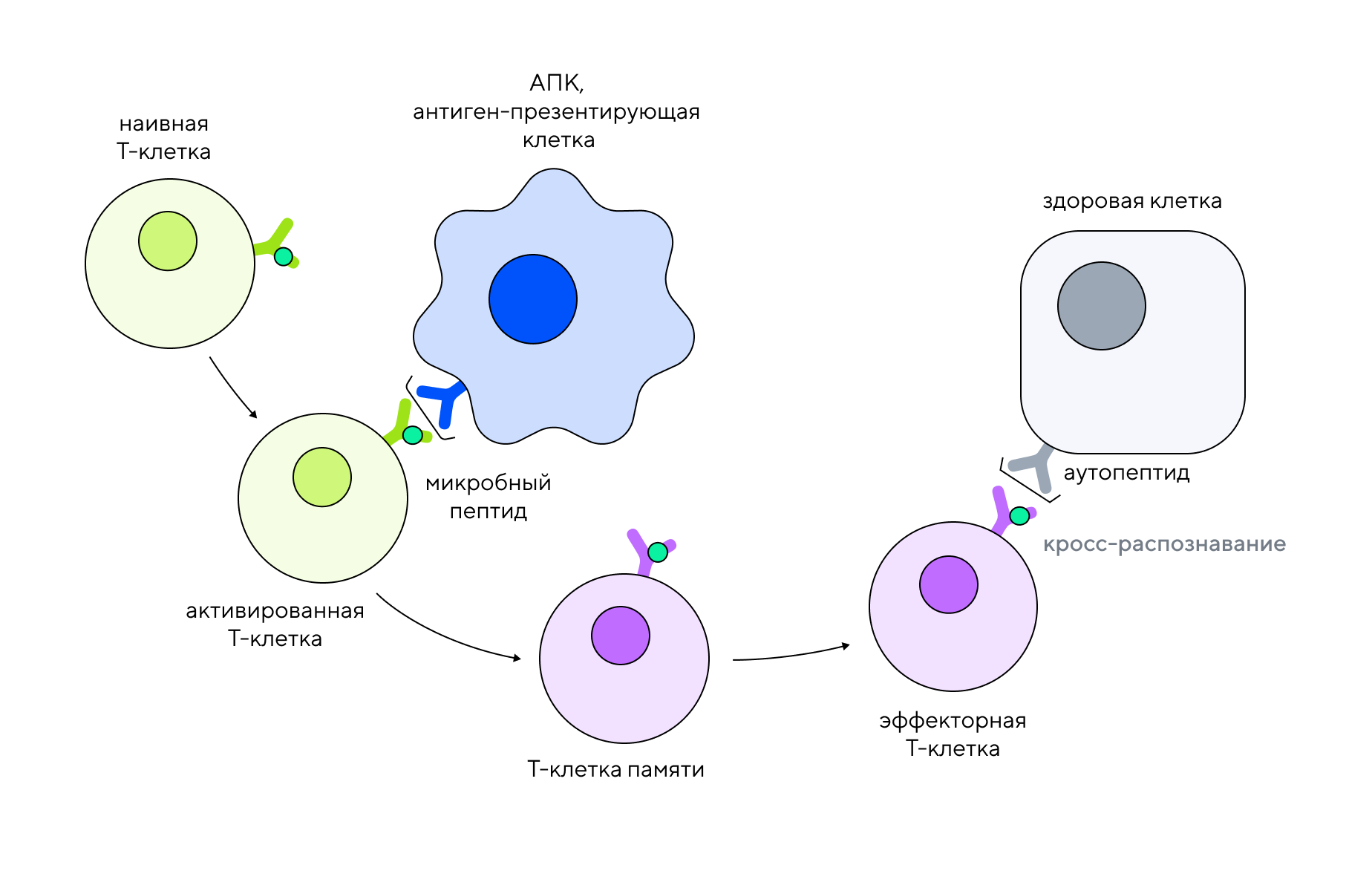
Механизм воспалительного процесса при аксиальном спондилоартрите и анкилозирующем спондилите
Механизм развития анкилозирующего спондилита
Важные участники иммунитета — Т-лимфоциты. Среди них есть группа CD4+, которые регулярно мониторят организм на наличие «чужаков», и CD8+, которые уничтожают зараженные или измененные клетки. Чтобы распознать «чужака» или поломку в собственных клетках организма, Т-лимфоцитам нужен особый Т-клеточный рецептор, TCR (T-cell receptor). Именно TCR взаимодействует с главным комплексом гистосовместимости (МНС — Major Histocompatibility Complex) — «паспортом» клетки, выставленным на ее поверхности. По сути, МНС — это представительство всех белков, которые присутствуют внутри клетки. Нормальные клетки, в которых все хорошо, представляют на своей поверхности только собственные белки. Если же клетка инфицирована, на ее поверхности вместе с собственными белками будет представлен еще и микробный белок в комплексе с HLA-B27. Когда необученная наивная Т-клетка сталкивается с этим комплексом, она активируется и запускает синтез провоспалительных факторов, чтобы запустить процесс борьбы с инфекцией. Часть таких активированных Т-лимфоцитов превращается в Т-клетки памяти. Но если эффекторная Т-клетка «срывается с цепи» и становится гиперреактивной, она может ошибочно атаковать и собственные здоровые клетки, имеющие белок HLA-B27 на поверхности, не связанный с бактериальной инфекцией. Так запускается процесс аутореактивности, в том числе способный приводить к анкилозирующему спондилиту5.
Выше уже упоминался один из молекулярных участников, связанный с болезнью, — молекула HLA-B27, представленная на поверхности клеток в связке с главным комплексом гистосовместимости МНС. Несмотря на подтвержденную ассоциацию между наличием гена, кодирующего HLA-B27, и развитием анкилозирующего спондилита, эта взаимосвязь не уникальна: носительство гена HLA-B27 обнаруживают при целом спектре аутоиммунных заболеваний12.
Иммунопатологический процесс при анкилозирующем спондилите связан не столько с молекулой HLA-B27 на поверхности клеток, сколько с особенностями аутореактивных Т-лимфоцитов. Так, в организме каждого человека случайным образом формируется огромное разнообразие Т-клеточных рецепторов (ТCR), способных узнавать практически любые клеточные мишени. Но вот какой конкретно вариант TCR становится аутореактивным и поражает собственные клетки, долгое время оставалось загадкой. Исследователи из разных стран искали ту самую последовательность в TCR, которая станет точечной мишенью и позволит селективно уничтожать молекулярную причину болезни — аутореактивные Т-лимфоциты, вышедшие из-под контроля. Этой мишенью стала последовательность в девятом сегменте вариабельного домена TCR — TRBV9, которая открывает новые перспективы лечения анкилозирующего спондилита13.
Сама по себе эта последовательность не такая уж новая — она была описана еще в 1990-е годы, и уже тогда ее связывали с аутореактивными функциями Т-лимфоцитов при аутоиммунных заболеваниях13. В 2016 году появилась информация о взаимосвязи TRBV9 с развитием анкилозирующего спондилита14. Наконец, в 2018 году об этой же последовательности написали авторы из РНИМУ им. Н. И. Пирогова и ИБХ РАН и подтвердили ее роль в патогенезе болезни Бехтерева15, 16. Это дало толчок к сотрудничеству между РНИМУ им. Н. И. Пирогова и BIOCAD для разработки терапевтического моноклонального антитела, нацеленного против TRBV9. Результатом стал препарат на основе цитотоксического моноклонального антитела — BCD-180, которое специфичным образом узнает и устраняет только целевую группу Т-лимфоцитов, ассоциированных с анкилозирующим спондилитом, и оставляет нетронутыми остальные клетки.
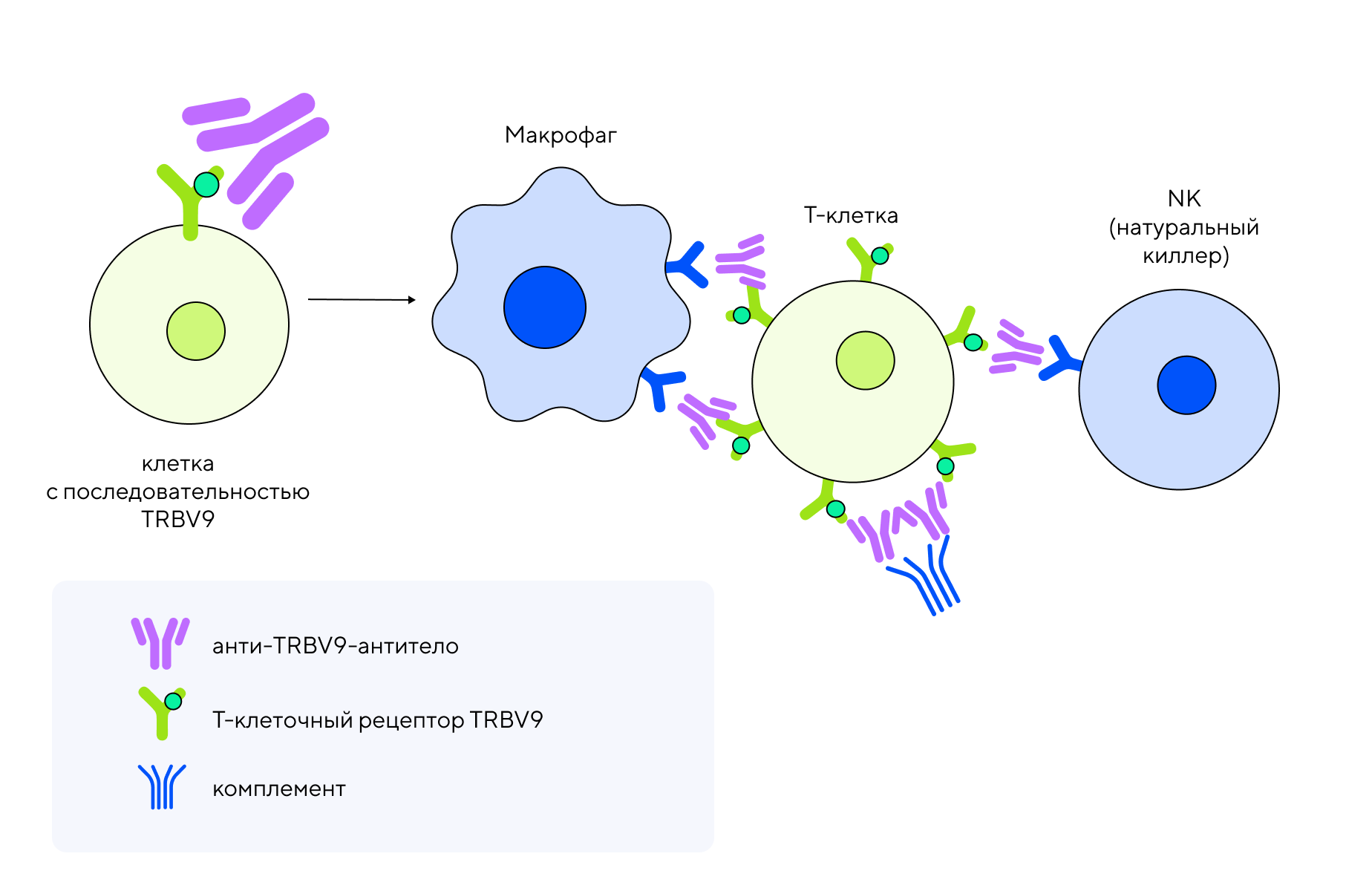
Механизм действия: моноклональное антитело BCD-180 связывается с TRBV9-сегментом рецептора аутоиммунной Т-клетки и как бы «помечает» ее, привлекая другие иммунные клетки или систему комплемента для уничтожения вышедших из-под контроля Т-лимфоцитов.
Но на этом история лечения аутоиммунных заболеваний не заканчивается. Вполне возможно, что новые исследования анти-TRBV9 откроют перспективы лечения других заболеваний, связанных с HLA-B27, например псориатического артрита, неинфекционного увеита, ювенильного идиопатического артрита и воспалительных заболеваний кишечника.