
«Успокоители» иммунитета: за что вручили Нобелевскую премию по медицине — 2025
Иммунную систему можно сравнить с надежным щитом, который эффективно сражается с «врагами» и защищает организм. Однако не все так однозначно: после открытия особого типа клеток — регуляторных Т-лимфоцитов — стало понятно, что иммунитет важно держать «в узде», чтобы он не атаковал собственные ткани. За раскрытие механизмов, которые поддерживают тонкий баланс между защитой от патогенов и «самозащитой», в 2025 году вручили Нобелевскую премию. В этой статье разберемся, чем различаются центральная и периферическая иммунологическая толерантность, как работают регуляторные Т-лимфоциты и какие горизонты открывает их применение в терапии аутоиммунных болезней и злокачественных новообразований.
Как иммунная система находит баланс между своим и чужим
Иммунная система — наш надежный защитник, который ежедневно сталкивается с задачей отличить «своих» от «чужих». Однако этот путь не так прост: иногда «чужими» оказываются даже собственные клетки, которые по каким-то причинам изменили свое поведение и перешли на «темную сторону» — например, после злокачественного перерождения или повреждения. Получается, что, с одной стороны, иммунная система уничтожает как внешних, так и внутренних чужаков, а с другой — не нападает на здоровые ткани организма, защищая нас от аутоиммунного ответа.
Баланс между нападением и выжиданием иммунитета возможен благодаря двум фундаментальным механизмам — центральной и периферической иммунологической толерантности. Центральную толерантность обеспечивают так называемые «первичные» иммунные органы — тимус и костный мозг. Здесь на стадии созревания иммунных клеток происходит «отсеивание» тех лимфоцитов, которые распознают собственные антигены: такие клетки уничтожаются или обезвреживаются, предотвращая опасные аутоиммунные ошибки.
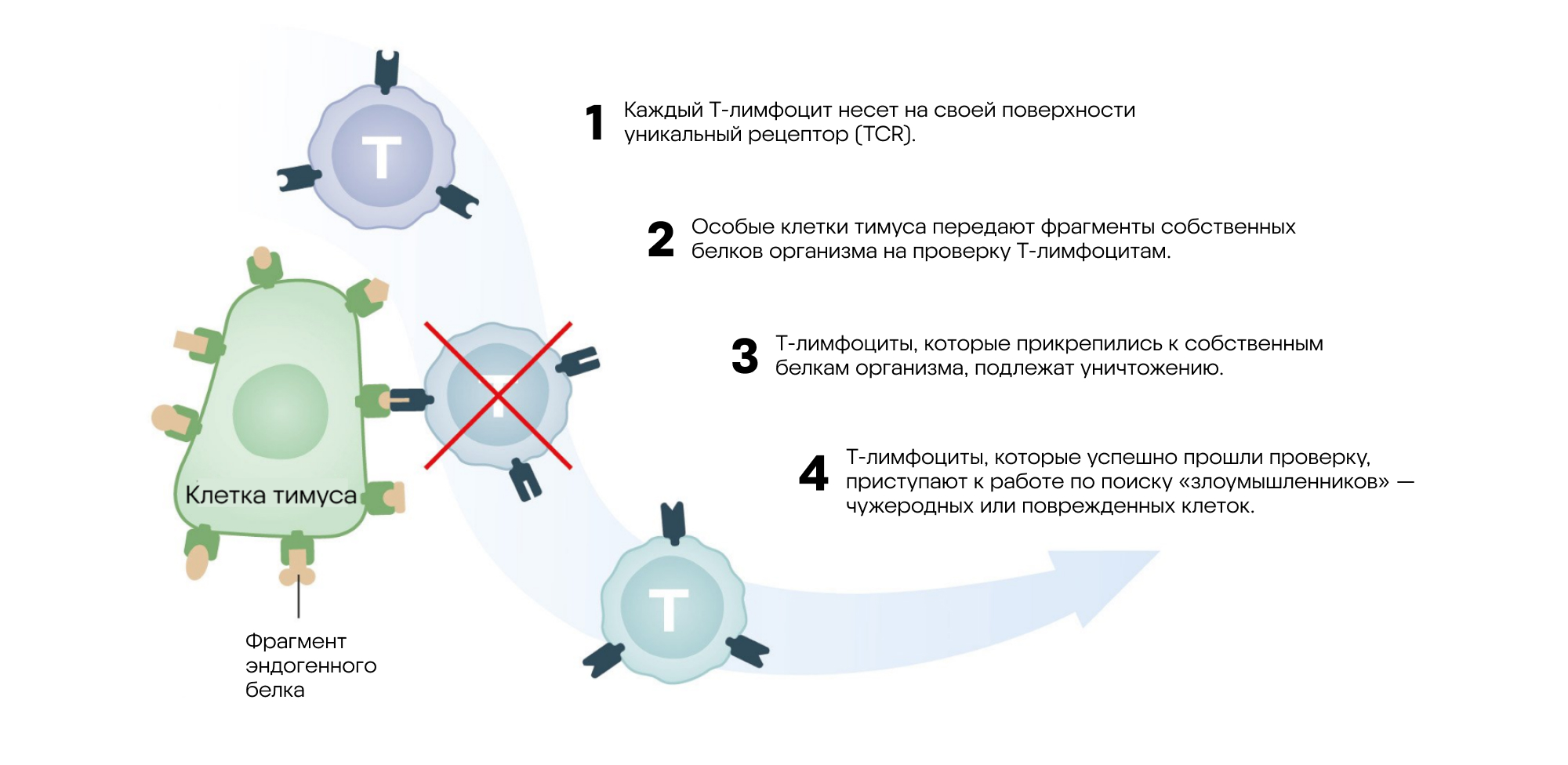
Как происходит уничтожение неправильно работающих Т-клеток в тимусе. В процессе созревания Т-лимфоцитов в тимусе происходит их «тестирование» — способность эффективно распознавать собственные белки организма. В случае если тест будет провален, такая вредоносная Т-клетка уничтожается. На этом принципе основан механизм центральной иммунологической толерантности. Источник: адаптировано из материалов пресс-релиза Нобелевского комитета
Долгое время центральная иммунологическая толерантность считалась единственным защитным механизмом организма. Однако со временем стало ясно, что одного этого недостаточно — хотя бы потому, что не все антигены доступны в тимусе и костном мозге. Поэтому после первичного «обучения» лимфоцитов в первичных иммунных органах подключаются вторичные лимфоидные органы — лимфоузлы и селезенка. С их помощью формируется периферическая толерантность — совокупность механизмов, которые продолжают контролировать активность иммунных клеток в тканях и крови. Среди механизмов периферической толерантности: подавление активации «предателей» — потенциально агрессивных T-лимфоцитов, анергия — неспособность иммунных клеток реагировать на определенные сигналы, а также воздействие регуляторных T-клеток. За открытие последних как раз таки присудили Нобелевскую премию по физиологии и медицине в 2025 году.
Как разные виды Т-лимфоцитов справляются с «врагами»
Т-лимфоциты — ключевые бойцы иммунной системы — обладают уникальной способностью распознавать врагов по «отпечаткам» чужеродных молекул, или антигенов. При этом существует градация Т-лимфоцитов по классам. Первыми из них были открыты две разновидности: Т-хелперы (CD4+) и Т-киллеры (CD8+).
— Т-хелперы регулируют и активируют иммунный ответ, непрерывно патрулируя разные органы и системы организма на предмет наличия «чужих». После обнаружения патогена они «предупреждают» другие иммунные клетки, которые непосредственно приступают к атаке на чужака.
— Т-киллеры непосредственно уничтожают зараженные или злокачественные клетки.
Узнавание «чужаков» Т-лимфоцитами возможно благодаря наличию у них особых клеточных рецепторов (TCR). Эти рецепторы связываются с антигенами, представленными на поверхности других клеток в комплексе с молекулами главного комплекса гистосовместимости (MHC). При этом Т-хелперы узнают антигены на MHC класса II, а Т-киллеры — на MHC класса I.
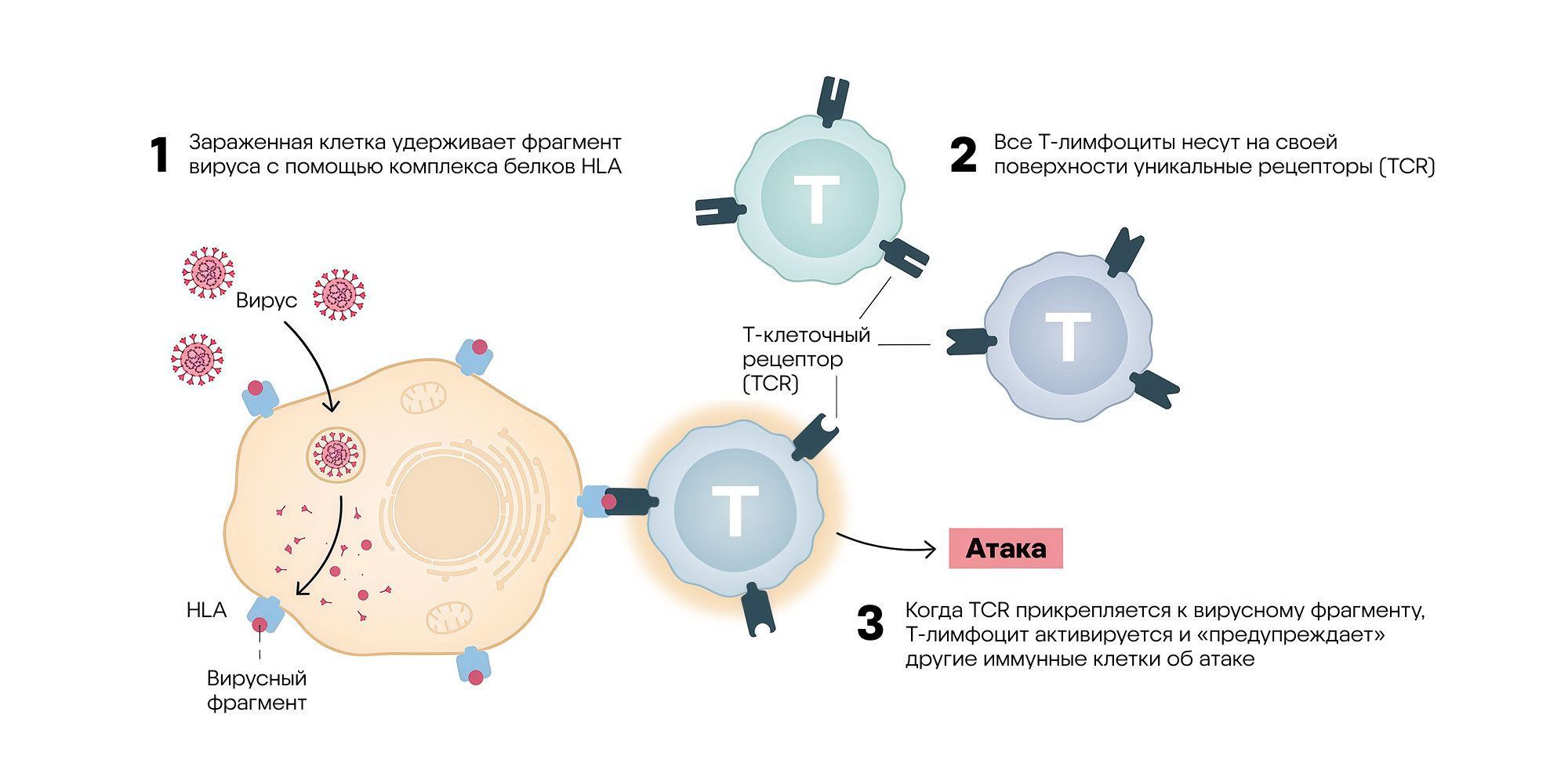
Механизм обнаружения вируса Т-лимфоцитами. Особые антигенпрезентирующие клетки захватывают вирус, нарезают его на части и выставляют фрагменты вирусных белков на своей поверхности с помощью особых белков из группы антигенов лейкоцитов человека (HLA — Human Leukocyte Antigens). В результате Т-лимфоциты, связавшись с антигенпрезентирующей клеткой, «узнают» чужеродные белки и «оповещают» другие иммунные клетки о нападении на организм. Источник: адаптировано из материалов пресс-релиза Нобелевского комитета
Однако, помимо Т-хелперов и Т-киллеров, существуют еще и другие клетки, так называемые регуляторные Т-лимфоциты (Treg) — и об их роли в иммунных реакциях стало известно намного позже. Своим «выходом в свет» они обязаны японскому исследователю (и будущему нобелевскому лауреату) Симону Сакагути. Его эксперименты по введению Т-клеток мышам с удаленным тимусом показали: несмотря на отсутствие этого первичного иммунного органа, аутоиммунные реакции все равно подавлялись. Получается, что в организме существует еще один особый класс клеток, которые служат своеобразным иммунным «модератором». Благодаря этому новому классу клеток, которые назвали «регуляторными», возможно подавление чрезмерной или ошибочной активации иммунитета, а значит, и защита от аутоиммунных атак.
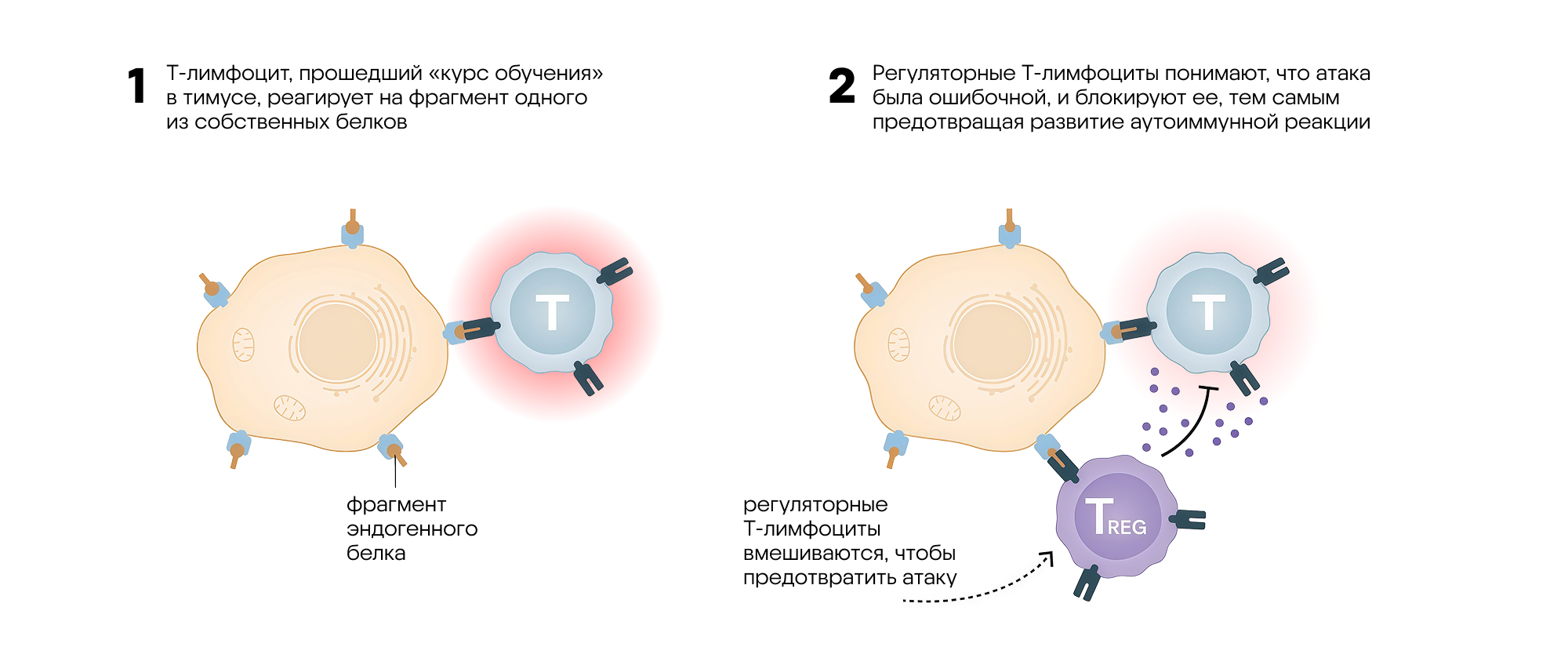
Механизм действия регуляторных Т-лимфоцитов, открытие которого удостоилось Нобелевской премии. Источник: адаптировано из материалов пресс-релиза Нобелевского комитета
О практической важности этого открытия и его терапевтическом применении рассказал Павел Яковлев, вице-президент по ранней разработке и исследованиям BIOCAD.
Помимо механизмов активации иммунитета, ничуть не менее важными являются механизмы его успокоения. Ведь если нашу иммунную систему не остановить, то она может перекинуться и на здоровые ткани, что будет вызывать аутоиммунные болезни, такие как диабет первого типа, болезнь Бехтерева, рассеянный склероз, системная красная волчанка и другие.
От мышей к людям: как открытие дефектного гена раскрывает перспективы лечения аутоиммунных заболеваний
Одновременно с открытием Сакагути в дело вступают два американских исследователя — Мэри Э. Бранкоу и Фред Рамсделл, которые переходят от теории к практике. Их работа была связана с изучением мутации scurfy у мышей, которая, в свою очередь, вызывается поломкой гена FOXP3. Этот ген считается ключевым регулятором активности других генов, влияющих на развитие иммунных клеток. В начале 2000-х годов Мэри Э. Бранкоу и Фред Рамсделл показали, что поломка гена FOXP3 у мышей приводит к тяжелому аутоиммунному заболеванию, когда иммунная система теряет контроль и атакует собственные ткани.
Немаловажно, что похожие мутации в гене FOXP3 у людей вызывают редкое, но смертельно опасное заболевание IPEX (immune dysregulation, polyendocrinopathy, enteropathy, X-linked syndrome). Эта болезнь чаще проявляется у мальчиков — с рождения или в первые месяцы жизни — и характеризуется множественными поражениями: стойкой энтеропатией (воспалением кишечника), аутоиммунными заболеваниями кожи вроде экземы и псориаза, гипотиреозом и даже развитием инсулинозависимого сахарного диабета первого типа.
Получается, что работа Бранкоу и Рамсделла не только выявила генетическую основу регуляторных Т-лимфоцитов, но и подсветила новые терапевтические перспективы, которые направлены на восстановление функции FOXP3 или расширение популяции Treg-клеток.
Стало ясно, почему наш иммунитет не убивает нас, хотя и может выработать реакцию против чего угодно. Недаром Нобелевский комитет отметил, что открытия Сакагути, Бранкоу и Рамсделла сыграли решающую роль в иммунологии. Дальнейшее же изучение работы регуляторной системы уже продвинули и еще значительно продвинут нас в лечении самых тяжелых онкологических и аутоиммунных заболеваний.
Регуляторные Т-лимфоциты можно рассматривать как мощный инструмент для лечения аутоиммунных заболеваний. Уже сейчас развиваются новые способы клеточной терапии, основанные на выделении, размножении и модификации регуляторных Т-клеток пациента с последующим возвращением их в организм для прицельного контроля иммунного ответа — это актуально, например, при трансплантации органов.
В онкологии, напротив, терапевтические решения направлены на снижение влияния Treg, чтобы усилить иммунный ответ против опухолей. Во многих лабораториях активно разрабатываются инженерные технологии, включая создание регуляторных T-клеток с заданной специфичностью, что позволяет модулировать иммунитет с высокой точностью и минимальными побочными эффектами.
В случае аутоиммунных заболеваний, наоборот, недостаток Treg может приводить к развитию болезни. Например, на вторично-прогрессирующей стадии рассеянного склероза истощаются функции регулирующих Т-лимфоцитов, которые в том числе отвечают за сдерживание Т- и В-клеток, атакующих миелиновую оболочку нервных клеток. Для коррекции этих нарушений разрабатывают препараты, подобные дивозилимабу, которые избирательно уничтожают B-клетки. Другой пример — препарат BCD-261, находящийся сейчас на стадии клинических исследований. Механизм действия BCD-261 основан на блокировании провоспалительного цитокина TL1A, который, в частности, приводит к пролиферации неактивных Treg и усиливает воспаление в кишечнике — один из ключевых факторов патогенеза болезни Крона и язвенного колита.
Таким образом, открытия регуляторных Т-лимфоцитов и механизмов периферической иммунологической толерантности прокладывают путь к новым методам терапии, способным поменять подходы к лечению как злокачественных новообразований, так и аутоиммунных болезней.
