Научный дайджест #29: подводим итоги года с самыми яркими открытиями
В последнем дайджесте 2025 года мы подводим итоги научных прорывов, которые произошли в мире молекулярной биологии и медицины. Вас ждет подборка самых интересных открытий и достижений — от лечения редких наследственных заболеваний с помощью методов генетического редактирования и разработки перспективных методов терапии онкологических заболеваний до развития ИИ-моделей.
Генетический прорыв: как сделать персонализированную медицину ближе
Одним из значительных достижений 2025 года стала разработка персонализированной генной терапии, основанной на технологии CRISPR. Первым человеком, который получил доступ к лечению на основе редактирования генома, стал Кей Джей Малдун (KJ Muldoon) — малыш, который родился в августе 2024 года с редким диагнозом, недостатком карбамоилфосфатсинтетазы 1. Из-за мутации в гене CPS1 его организм не способен правильным образом метаболизировать белки. В результате у таких детей в крови накапливаются ионы аммония, которые вредят здоровью, в том числе повреждая печень и мозг. По статистике, примерно половина малышей с таким диагнозом умирает в младенчестве.
Для лечения подобных наследственных заболеваний потенциально могут использоваться методы генной терапии. Однако сложность подхода в том, что от момента старта исследований до выхода продукта-кандидата (если разработка в принципе будет успешной) может пройти несколько лет. Случай лечения недостатка карбамоилфосфатсинтетазы уникален тем, что специалистам удалось преодолеть барьер со временем. Это стало возможным благодаря команде исследователей из Университета Пенсильвании, Детской больницы Филадельфии и биотехнологическим компаниям, в частности Integrated DNA Technologies, которые исправили ошибочную «букву» в геноме из более чем трех миллиардов пар оснований. Результатом стало то, что 25 февраля 2025 года пациент KJ получил первую из трех инфузий — срок составил всего шесть месяцев (вместо запланированных 18)!
Возможно, этот научный прорыв откроет собой новую эру разработки быстрой персонализированной медицины для исправления редких мутаций и спасения людей со сложными генетическими заболеваниями. — The baby whose life was saved by the first personalized CRISPR therapy, Gene-editing therapy made in just 6 months helps baby with life-threatening disease.
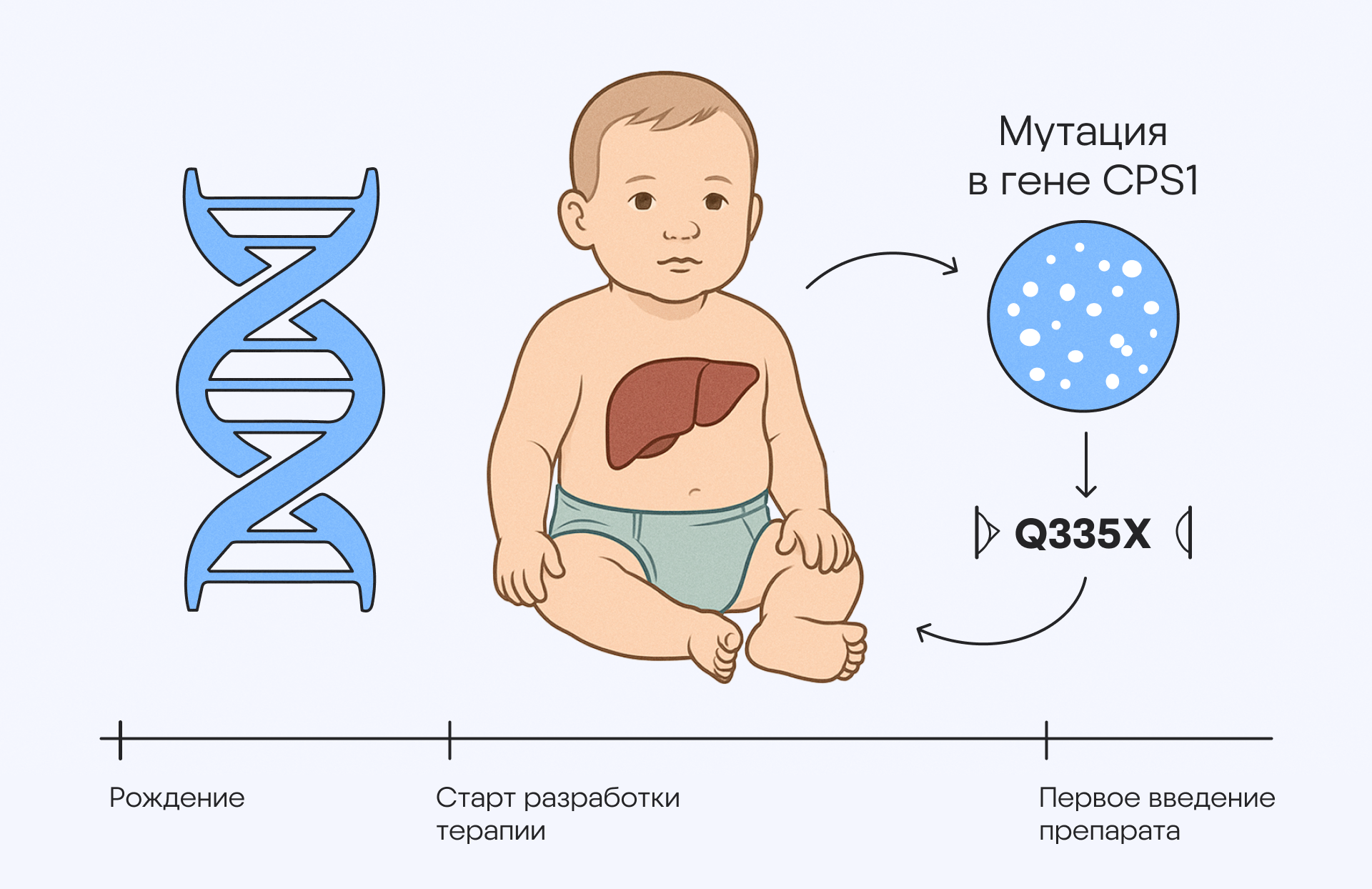
Причина болезни маленького пациента была в том, что в его геноме присутствуют два патогенных укорачивающих варианта гена CPS1, Q335X и E714X. Из-за этой мутации развивается дефицит карбамоилфосфатсинтетазы 1 — редкое и опасное для жизни состояние с ранней детской смертностью. Благодаря быстрой разработке персонализированной терапии удалось своевременно начать лечение. Это удалось сделать с помощью индивидуально подобранного способа редактирования оснований. Источник: адаптировано из TribeMD
Медицинский прорыв: как вывести ксенотрансплантацию на новый уровень
Ксенотрансплантация — это процесс пересадки органов от животных человеку. Цель этого хирургического вмешательства — потенциально помочь решить глобальную проблему дефицита донорских органов. В 2025 году исследования в этой области попали на страницы ведущих научных журналов, причем не в первый раз. Эксперименты с пересадкой органов от генно-модифицированных животных начались после прорывов в генной инженерии, когда появились возможности улучшения совместимости между человеческими и животными генами с помощью технологии CRISPR. Первая пересадка сердца от генно-модифицированной свиньи человеку произошла в 2022 году — это был первый успешный случай, когда 57-летний пациент прожил еще 60 дней после операции.
Однако к 2025 году технологии шагнули вперед: в январе 2025 года хирурги Массачусетской общей больницы пересадили 67-летнему Тиму Эндрюсу почку от свиньи. В орган были внесены 69 генетических изменений с помощью технологии CRISPR, в том числе удалены иммуногенные сахара и добавлены человеческие гены для контроля свертывания крови. Орган, прозванный «Вилма» (Wilma — в честь клички свиньи-донора), проработал почти 9 месяцев, побив предыдущие рекорды по ксенотрансплантации. Отторжение наступило в октябре 2025 года из-за иммунной реакции, поэтому почку пришлось удалить, однако отсутствие немедленной реакции организма пациента подтвердило эффективность выбранного подхода.
Этот прорыв в трансплантологии может позволить установить новый стандарт выживания ксенографтов и ускорить клинические исследования — так, FDA одобрила фазы I–III для компаний eGenesis и United Therapeutics, которые занимаются разработкой с привлечением 50 пациентов. На практике это означает потенциальную надежду на использование органов от генно-модифицированных животных и спасение тысяч человеческих жизней ежегодно. — Longest animal-to-human transplant, Man’s pig kidney fails just shy of setting record.
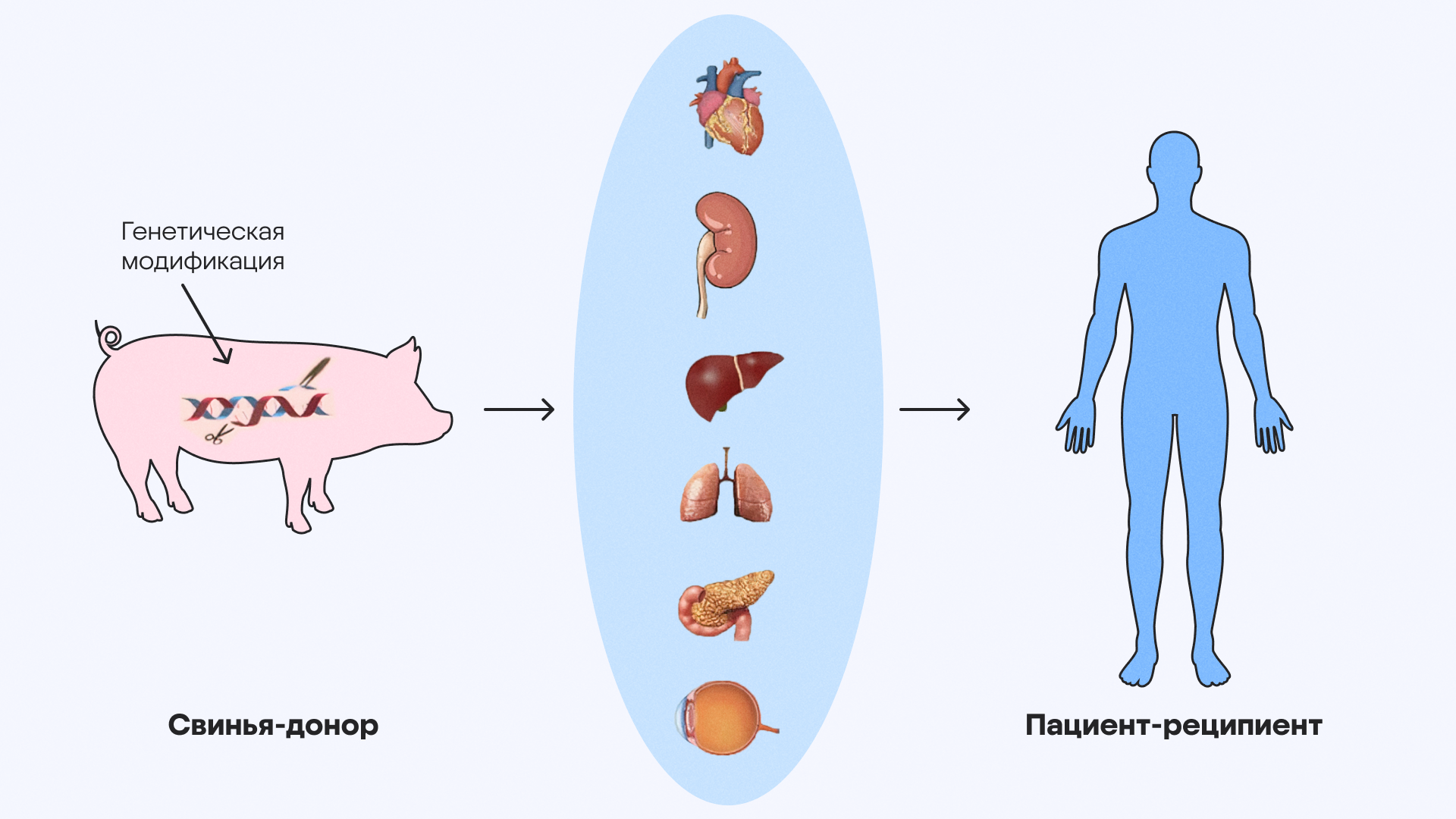
Генно-модифицированные животные потенциально могут использоваться в качестве доноров органов для человека. Источник: адаптировано из Explore Transplant&Living Donation
ИИ-награда года: как создать мощную и дешевую языковую модель
LLM, или большие языковые модели, — мощные системы искусственного интеллекта, для которых активно ищут пути использования в биологии, например для моделирования сложных белковых структур и предсказания их взаимодействий в живых системах. В числе громких прорывов прошлых лет — модели Rosetta и AlphaFold, своеобразные «конструкторские бюро» белков. Однако в 2025 году в роли успешного и перспективного решения отметили китайскую компанию DeepSeek и ее ИИ-модельDeepSeek-R1, выпущенную в январе этого года. Особенность этой модели в том, что она способна осваивать сложные рассуждения исключительно методом проб и ошибок с вознаграждением за правильные ответы — без использования аннотированных человеческих примеров. Прорывом DeepSeek-R1 можно считать хотя бы потому, что модель эволюционировала самостоятельно, а ее разработка обошлась всего в 300 тысяч долларов. — The Chinese finance whizz whose DeepSeek AI model stunned the world, DeepSeek-R1 incentivizes reasoning in LLMs through reinforcement learning.

Основатель компании DeepSeek — Венфенг Лианг — человек, попавший в топ-10 исследователей 2025 года по версии журнала Nature. Разработка компании, модель DeepSeek-R1, потенциально может улучшить методы биоинформатического анализа — от предсказания мутаций в генах, ассоциированных с опухолями, до дизайна белков для терапии аутоиммунных заболеваний. Источник: Nature
Клинический прорыв года: как замедлить болезнь Хантингтона
Болезнь Хантингтона — пока практически неизлечимое нейродегенеративное расстройство, передающееся по наследству. Заболевание возникает из-за мутации в гене HTT, что приводит к синтезу дефектного белка хантингтина. Этот белок накапливается в нейронах мозга и вызывает их гибель, что проявляется неконтролируемыми движениями, снижением когнитивных функций и психическими расстройствами. Особенность этой болезни в том, что часто она развивается у людей среднего возраста — от 30 до 50 лет.
Достижением 2025 года в вопросе лечения болезни Хантингтона можно считать результаты клинических исследований генной терапии от компании UniQure и Университетского колледжа Лондона. Для этого разработали препарат на основе AAV5-вектора, который доставляет в клетки микроРНК, селективно снижающую уровень патологического белка хантингтина. Результаты исследования впечатляют: в фазе III у 75% пациентов, принявших участие в исследовании, замедлились симптомы прогрессирования болезни, при этом моторные и когнитивные функции сохранились практически на нормальном уровне. Это можно считать серьезным достижением: разработка такого лечения открывает путь к другим видам модифицирующей терапии, способной останавливать прогрессирование генетического заболевания у носителей мутантного гена. — ‘Giant step forward’ for Huntington’s — the scientist behind the first gene therapy, Huntington’s disease treated for first time using gene therapy.
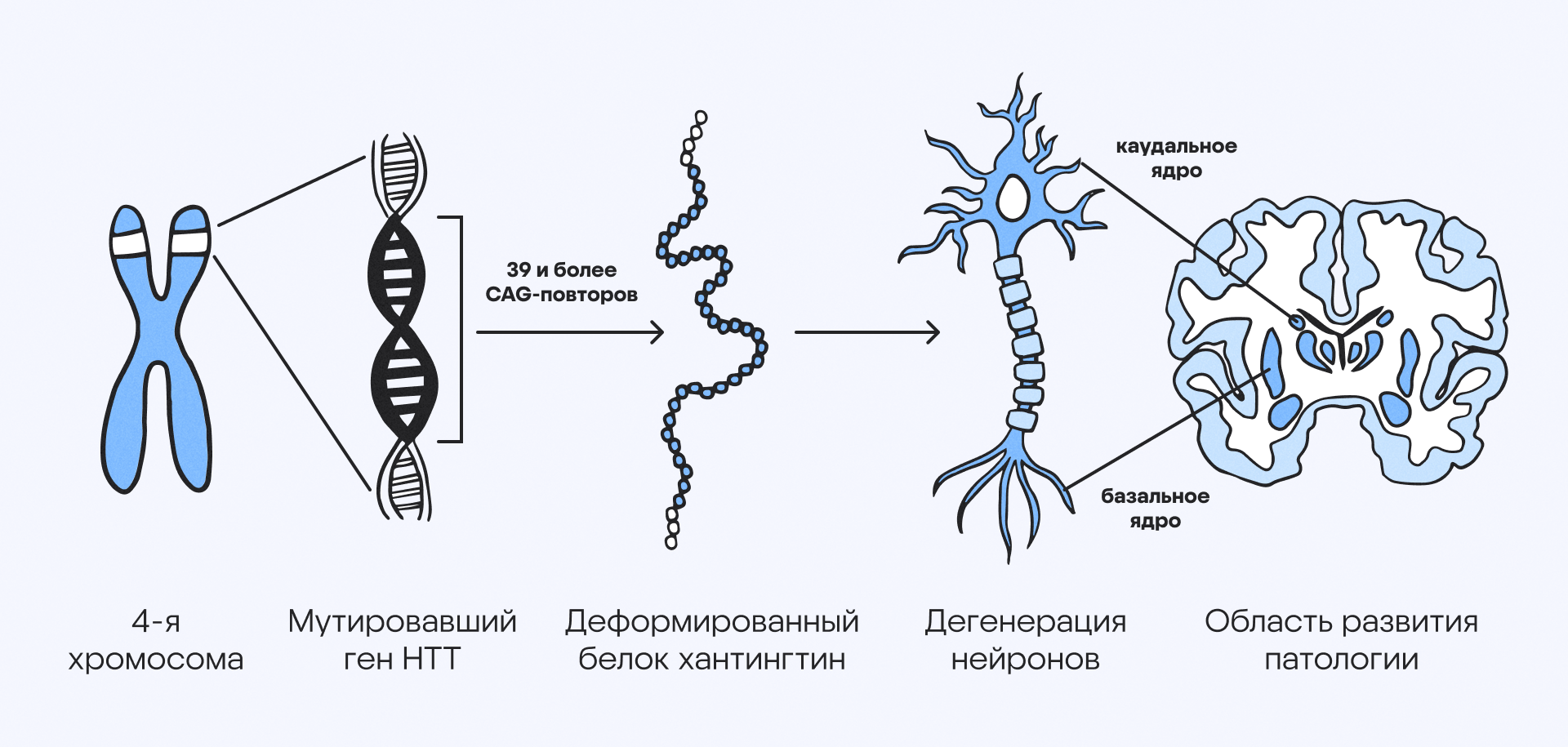
Механизм развития нейропатологии про болезни Хантингтона. Источник: адаптировано из Biospective Imaging
Молекулярная загадка: зачем нейроны «подкармливают» опухоли
В 2025 году вышла удивительная статья о необычном механизме метастазирования рака. Ученые из Университета Южной Алабамы выяснили, что опухолевые клетки способны взаимодействовать с нейронами и получать от них митохондрии — «энергетические станции» клеток. Этот обмен повышает выживаемость опухолевых клеток в стрессовых условиях, например при гипоксии, благодаря чему им удается вполне успешно функционировать и метастазировать. Если же заблокировать этот порочный процесс, например, с помощью ингибиторов MIRO1/2, можно снизить метастатический потенциал опухоли, не затрагивая при этом нормальные ткани.
Это неожиданное открытие меняет онкологическую парадигму, предлагая новые мишени для терапии при метастазировании — от рака мозга до меланомы, — где традиционные методы оказываются бессильны. — Nerve-to-cancer transfer of mitochondria during cancer metastasis, MIRO2-mediated mitochondrial transfer from cancer cells induces cancer-associated fibroblast differentiation.
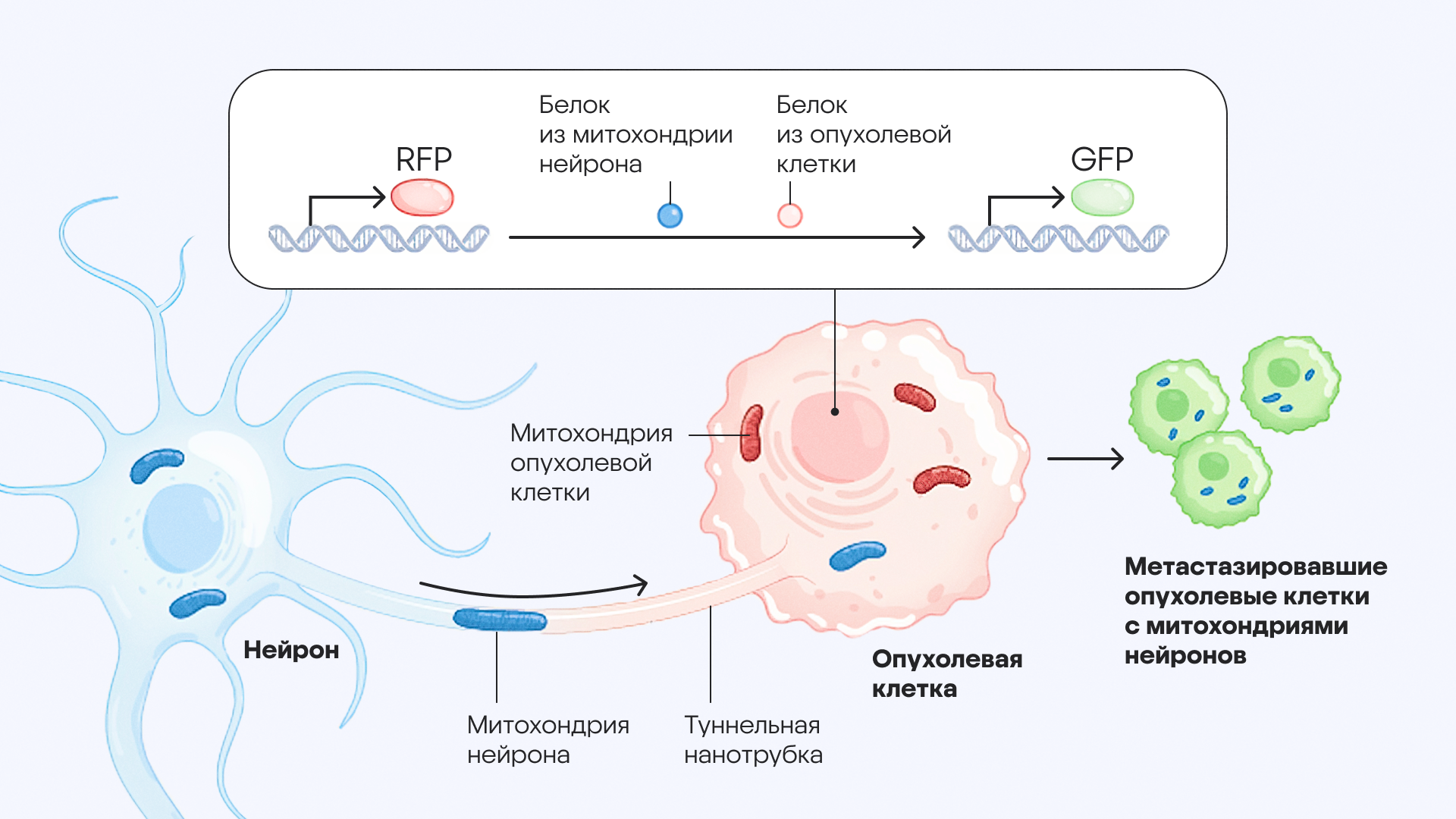
Перенос митохондрий из нейронов в опухолевые клетки способствует распространению злокачественных новообразований. С помощью флуоресцентной системы маркировки MitoTRACER удалось идентифицировать и маркировать опухолевые клетки с проникнувшими в них митохондриями из нейронов. Мышиные опухолевые клетки были модифицированы — в них экспрессировался особый флуоресцентный белок, RFP. В случае если мышиные клетки «приобретали» митохондрии из нейронов — тоже модифицированные, но уже для производства другого флуоресцентного белка, GFP, — клетки-реципиенты переключались с производства RFP на производство GFP. Также в ходе исследования удалось выяснить, как именно опухолевые клетки приобретали митохондрии из нейронов: им на помощь пришли особые трубчатые структуры — туннельные нанотрубки, которые соединяют клетки между собой. Впоследствии опухолевые клетки с митохондриями, полученными от нейронов, способны распространяться в более удаленные участки тела. Источник: адаптировано из Nature
Вакцины против рака: как «разбудить» иммунитет для атаки на опухоль
Обычно вакцинация ассоциируется с профилактическим вводом особых веществ для запуска иммунного ответа против конкретного патогена — например, вируса гриппа или кори. Однако есть и более нестандартные разработки, связанные с созданием вакцин против опухолевых клеток. Такие вакцины называют неоантигенными: они создаются на основе уникальных мутировавших последовательностей (неоантигенов) в опухоли конкретного пациента. Принцип действия заключается в том, что неоантигенные вакцины стимулируют Т-лимфоциты распознавать и уничтожать опухолевые клетки, минимизируя повреждение здоровых тканей. Особенно перспективна эта разработка в отношении сóлидных опухолей, устойчивых к стандартным методам лечения.
Один из перспективных продуктов на основе неоантигенов, который «засветился» в 2024 году, — разработка компании Moderna, где создали вакцину для лечения меланомы. Но прогресс не стоит на месте, и в 2025 году вышла интересная и в какой-то степени прорывная публикация о неоадъювантной вакцине, где ученые комбинировали неоантигены и неоадъюванты — вещества, которые усиливают иммунный отклик. В пилотных экспериментах на мышиных моделях использование такого подхода показало впечатляющие результаты: повысилась активность цитотоксических Т-лимфоцитов (CTL) в 47 раз и произошла полная регрессия опухолей у 80% мышей. В качестве «бонуса» удалось обеспечить мышам долгосрочный иммунитет против рецидивов.
Терапевтический прорыв этого исследования в том, что созданная вакцина работает на разнообразных типах опухолей — от меланомы до рака легкого. Для медицины это потенциально может открыть путь к комбинированной терапии, потенциально повышающей выживаемость пациентов со злокачественными новообразованиями и делая иммунотерапию доступной для большего числа людей. — Eliciting antitumor immunity via therapeutic cancer vaccines.
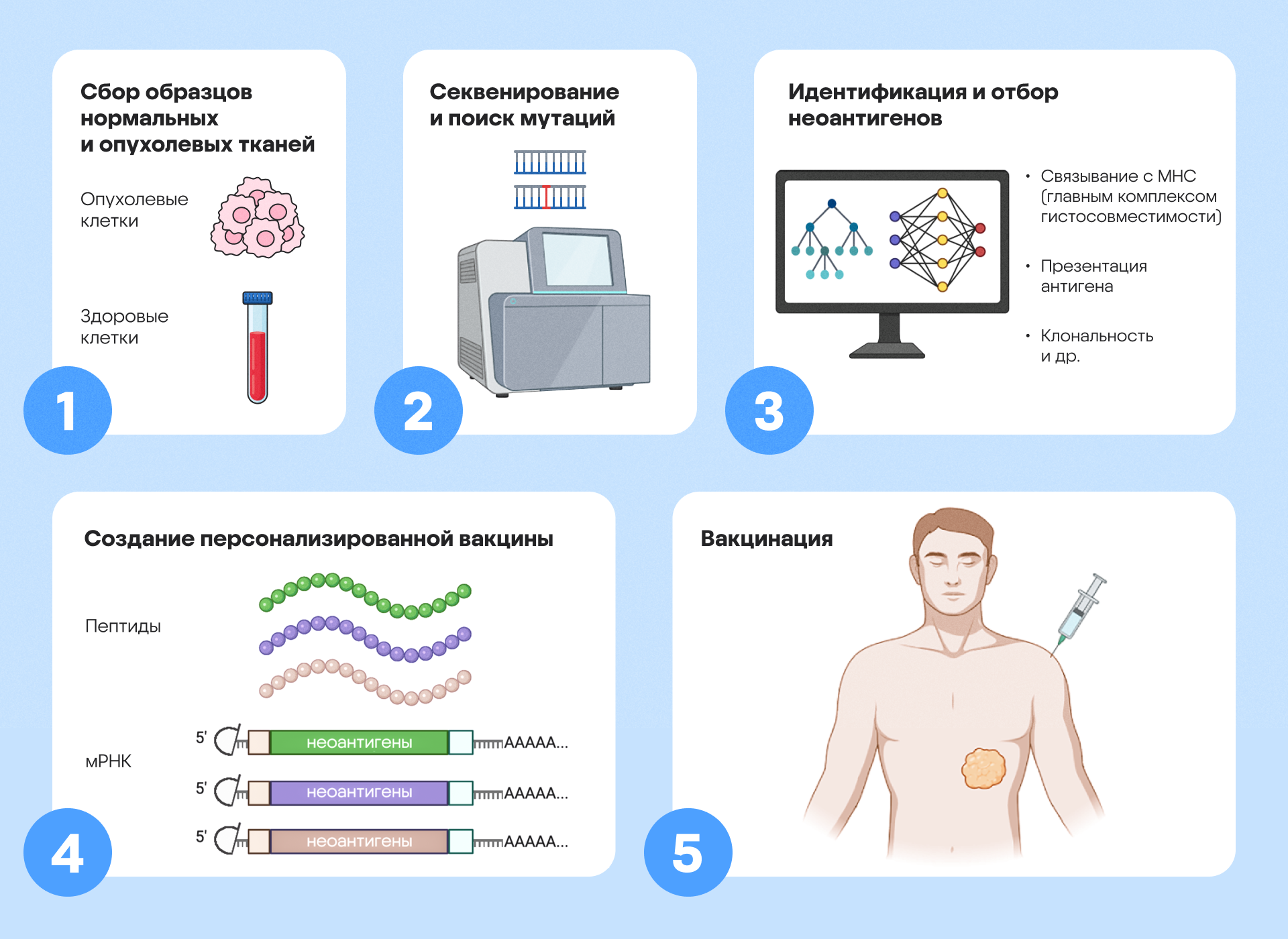
Схема процедуры по разработке персонализированных неоантигенных вакцин. У пациентов берут образцы опухолевой и нормальной ткани (например, периферических мононуклеарных клеток крови) и отправляют их на секвенирование, как правило с помощью NGS — секвенирования нового поколения, — чтобы выявить мутации. Обнаруженные мутации оценивают по ряду критериев, например на предмет связывания с MHC, презентации антигена, уровня транскриптов, клональности. Выбранные неоантигенные эпитопы синтезируют для получения пептидных или мРНК-вакцин для лечения пациентов. Схема адаптирована из Cellular&Molecular Immuology
Как «взломать» резистентность рака легкого с помощью CRISPR
Немелкоклеточный рак легкого (НМРЛ) — один из самых смертоносных видов опухолей, при котором резистентность к химиотерапии часто обрекает пациентов на рецидив. Ключевой фактор устойчивости этого вида рака — гиперактивация транскрипционного фактора NRF2, который защищает опухолевые клетки от окислительного стресса и апоптоза, позволяя им выживать под воздействием лекарств.
Однако не стоит опускать руки: так, исследователи в одной из недавних работ 2025 года разработали и применили комбинированную технологию на основе CRISPR-Cas9 совместно с ингибиторами PD-L1 и химиопрепаратами в мышиных и клеточных моделях. Выяснилось, что такая стратегия позволила избирательно уничтожать сóлидные опухоли, усиливая иммунный ответ и снижая объем метастазирования.
Важность этого исследования в том, что оно демонстрирует эффективность CRISPR в сочетании с комбинированной терапией для лечения сóлидных опухолей, преодолевая барьеры доставки и off-target-эффекты. Это дает надежду на персонализированное лечение разных видов злокачественных заболеваний, потенциально повышая выживаемость пациентов и снижая вероятность возникновения рецидивов. — Functional characterization of tumor-specificCRISPR-directed gene editing as a combinatorial therapy for the treatment of solid tumors.
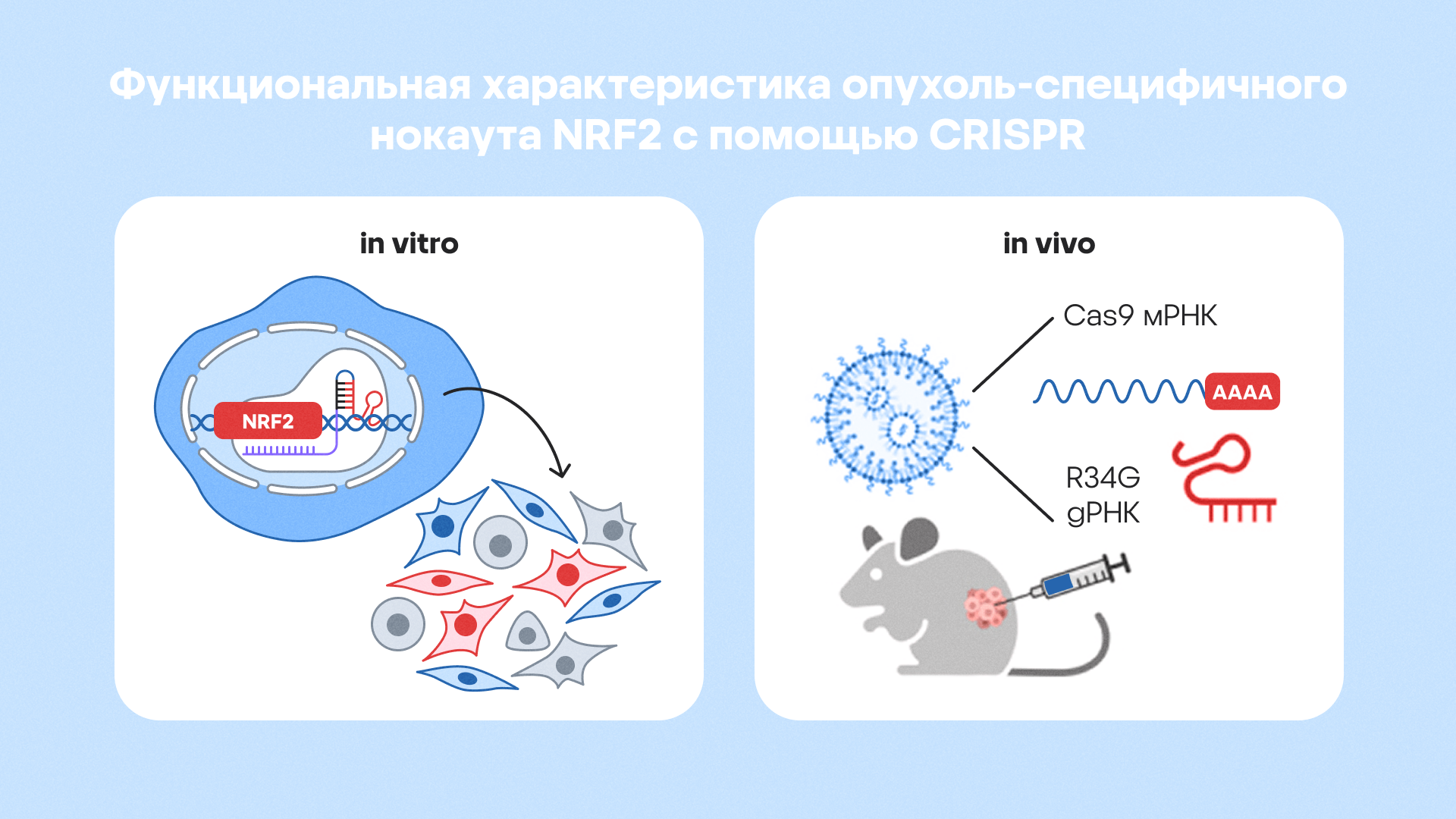
Исследователи применили технологию CRISPR-Cas9 для точечного редактирования генов в опухолевых клетках, включая ген NRF2, который экспрессируется при НМРЛ. Комбинированная терапия в моделях in vitro и in vivo позволила отключить резистентные пути, восстановить чувствительность к химио- и иммунотерапии, а также сократить объем опухолей на 70–90% без значительного вреда здоровым тканям. Функциональная характеристика показала, что CRISPR-редактирование усиливает апоптоз именно в опухолевых клетках, минимизируя off-target-эффекты. Источник: адаптировано из PubMed
Берем AXL на прицел: как сделать лечение резистентных опухолей более эффективным
Рак почки, или почечно-клеточная карцинома, а также другие сóлидные опухоли часто могут быть устойчивы к терапии из-за гиперактивации гена, кодирующего белок AXL. Эта рецепторная тирозинкиназа играет важную роль в онкогенезе, росте опухолей и метастазировании, а также помогает опухолевым клеткам уклоняться от иммунного ответа. Все эти факторы делают AXL потенциальной мишенью для лечения злокачественных новообразований.
Для того чтобы повлиять на белок AXL и «заблокировать» его работу, можно действовать в разных направлениях. Как раз об этих способах воздействия на AXL в. опухолевых клетках рассказывает один из цитируемых обзоров 2025 года, где предлагаются различные стратегии таргетной терапии: от применения низкомолекулярных ингибиторов тирозинкиназ до разработки моноклональных антител, конъюгатов антител с лекарственными препаратами (ADC), анти-AXL-CAR и комбинированной терапии. — AXL signaling in cancer: from molecular insights to targeted therapies.
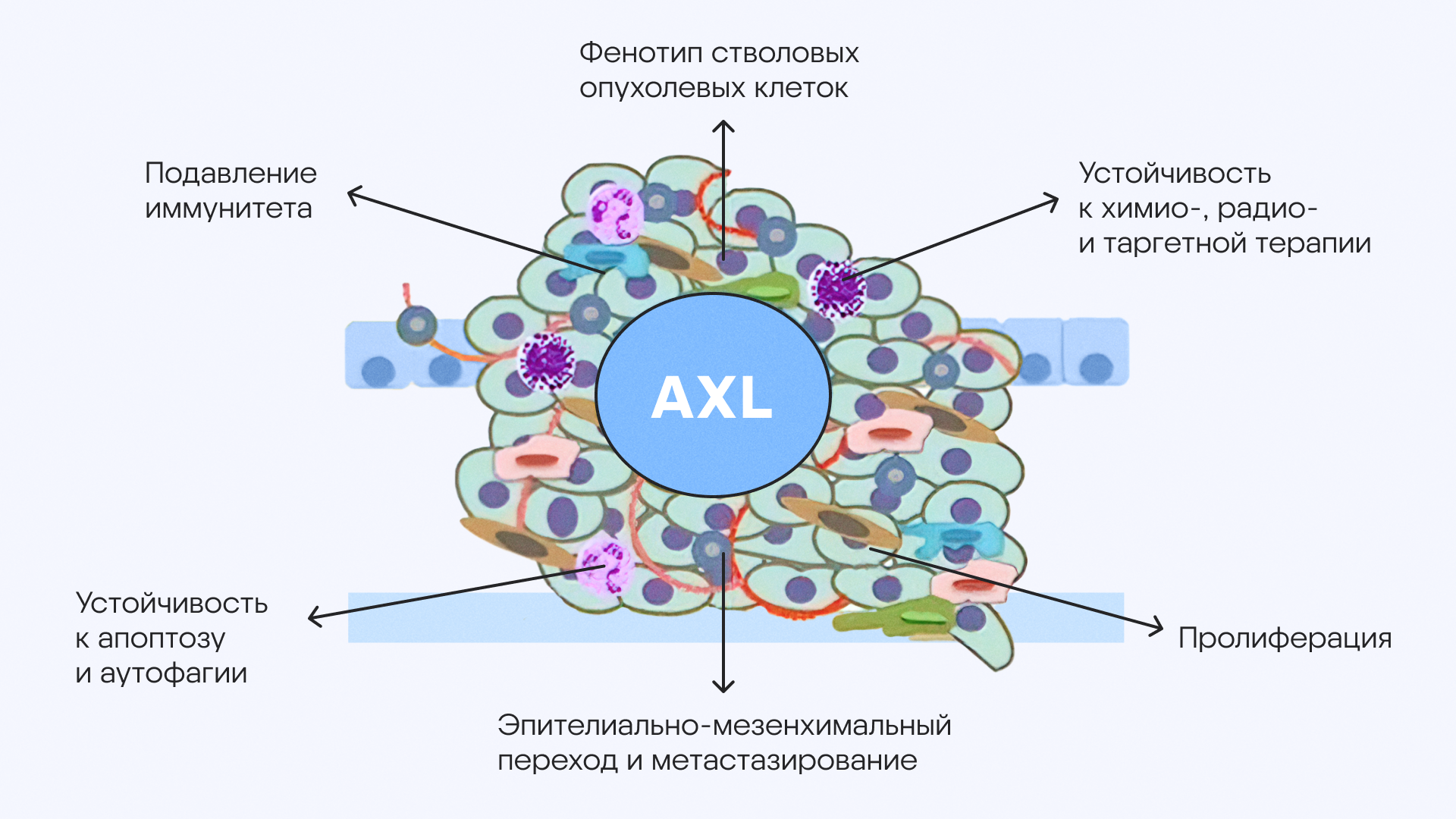
Сигнальный путь, связанный с AXL, в микроокружении опухоли способствует ее прогрессированию и дальнейшему метастазированию за счет множества взаимосвязанных механизмов. Источник: адаптировано из MDPI